波谱原理及解析(二版)习题答案
波谱解析1-4答案

1 波谱解析试题1一、名词解释 :1.发色团2. 化学位移二、简答题 :1.红外光谱在结构研究中有何用途?2.偏共振去偶碳谱在结构研究中具有什么样的意义?三、化合物可能是A 或B ,它的紫外吸收λmax 为314nm (lg ε=4.2),指出这个化合物是属于哪一种结构。
四、下面为化合物A 、B 的红外光谱图,可根据哪些振动吸收峰推断化合物A 、B 中分别存在哪些官能团?A :B :(A) (B)五、归属下列化合物碳谱中的碳信号。
(15)六、某化合物的分子式为C 14H 14S ,其氢谱如下图所示,试推断该化合物的结构式,并写出推导过程。
(15分)七、某化合物分子式为C3H7ON, 结合下面给出的图谱,试推断其结构,并写出简单的推导过程。
波谱解析试题1答案一、名词解释:1.发色团:从广义上讲, 分子中能吸收紫外光和(或)可见光的结构系统叫做发色团。
因常用的紫外光谱仪的测定范围是200~40Onm 的近紫外区, 故在紫外分析中,只有π-π* 和(或) n-π* 跃迁才有意义。
故从狭义上讲,凡具有π键电子的基团称为发色团2. 化学位移:不同类型氢核因所处化学环境不同, 共振峰将分别出现在磁场的不同区域。
实际工作中多将待测氢核共振峰所在位置 ( 以磁场强度或相应的共振频率表示 ) 与某基准物氢核共振峰所在位置进行比较, 求其相对距离, 称之为化学位移。
二、简答题:1.红外光谱在结构研究中有何用途?(1)鉴定是否为某已知成分(2)鉴定未知结构的官能团(3)其他方面的应用:几何构型的区别;立体构象的确定;分子互变异构与同分异构的确定。
2.偏共振去偶碳谱在结构研究中具有什么样的意义?当照射1H 核用的电磁辐射偏离所有l H 核的共振频率一定距离时, 测得的13C-NMR(OFR) 谱中将不能完全消除直接相连的氢的偶合影响。
此时,13C 的信号将分别表现为q (CH3), t (CH2),d(CH),s(C)。
波谱解析试题及答案

波普解析试题一、名词解释(5*4分=20分)1。
波谱学2。
屏蔽效应3.电池辐射区域4.重排反应5。
驰骋过程二、选择题。
(10*2分=20分)1。
化合物中只有一个羰基,却在1773cm-1和1736cm—1处出现两个吸收峰这是因为:( )A、诱导效应B、共轭效应C、费米共振D、空间位阻2. 一种能作为色散型红外光谱仪的色散元件材料为:()A、玻璃B、石英C、红宝石D、卤化物晶体3。
预测H2S分子的基频峰数为:()A、4 B、3C、2D、14.若外加磁场的强度H0逐渐加大时,则使原子核自旋能级的低能态跃迁到高能态所需的能量是如何变化的:()A、不变B、逐渐变大C、逐渐变小D、随原核而变5.下列哪种核不适宜核磁共振测定:( )A、12CB、15NC、19FD、31P6。
在丁酮质谱中,质荷比质为29的碎片离子是发生了()A、α-裂解 B、I—裂解C、重排裂解 D、γ-H迁移7。
在四谱综合解析过程中,确定苯环取代基的位置,最有效的方法是()A、紫外和核磁 B、质谱和红外C、红外和核磁 D、质谱和核磁8。
下列化合物按1H化学位移值从大到小排列()a.CH2=CH2b。
CH CH c.HCHO d.A、a、b、c、d B、a、c、b、dC、c、d、a、bD、d、c、b、a9。
在碱性条件下,苯酚的最大吸波长将发生何种变化?()A.红移B. 蓝移C。
不变D。
不能确定10.芳烃(M=134), 质谱图上于m/e91处显一强峰,试问其可能的结构是:( )A. B. C。
D.三、问答题(5*5分=25分)1.红外光谱产生必须具备的两个条件是什么?2。
影响物质红外光谱中峰位的因素有哪些?3.色散型光谱仪主要有哪些部分组成?4。
核磁共振谱是物质内部什么运动在外部的一种表现形式?5. 紫外光谱在有机化合物结构鉴定中的主要贡献是什么?四、计算和推断题(9+9+17=35分)1.某化合物(不含N元素)分子离子区质谱数据为M(72),相对丰度100%; M+1(73),相对丰度3。
波谱分析教程第二版答案

波谱分析教程第二版答案【篇一:波谱分析教程数据】外(红移蓝移)3 应用:化合物透明,说明分子中不存在共轭体系,无羰基;如果在210~250nm 有吸收,表示有k 吸收带,可能还有两个双键的共轭体系;如果在260~300nm 。
4. 开链共轭双烯(217),同环共轭双烯(253 ),延长一个双键(30),(—oac,0; —or,6; —sr,30 ;—x,5; —nr2,60 )二.红外产生红外吸收的条件:只有在振动中伴随着偶极矩短变化的振动形式才具有红外吸收,即具有红外活性,偶极矩变化幅度越大,吸收强度越大。
(基团振动产生偶极矩的变化;辐射能量满足振动能级跃迁需要)6. 羰基化合物:c = o:1900〜1600. ①醛:c = o : 1735〜1715 ; c —h :2820〜2720两个峰;②酮c = o : 1720〜1710 :③羧酸:o —h : 3350 或3200~2500 ; c = o:1760 或1710.特征峰:o —h 面外摇摆920宽;④酯c = o 1745~1720 ;⑤醚c —o —c对称1100,非对称1210〜1160;⑥酰卤 c = o 1800 附近;⑦酰胺:c = o 1690~1650 , 伯胺(n —h伸缩3520 , 3400双峰弯曲1640~1600 );仲胺(n —h 伸缩3470〜3400 双峰弯曲1550〜1530 )三.质谱(单位:ppm )1. 炔烃:(1.6〜3.4ppm):(=醛基氢:(脂肪醛9~10);(芳香醛9. 5〜10.5);4(.苯环h:7.27)5. r —;ar—缔合10.5~16); ar —;2,r2,ar2 ;6. 偶合常数:1.2j /j 同(键数偶—负值;奇数—正值) ,取代基电负性会使2j 的绝对值减少(正向),邻位四.碳谱:ppm {sp3(0〜60);sp2(100〜165);sp(67〜92); 饱和烷烃(-2.5〜55);—ch3(- 2.5);ch2 = ch2(123.3); hc 三ch(71.9)端基碳(67~70 );苯环(128.5 );芳环碳(153.0~106.5 ) ; c = o(160~220);醛羰基(190〜205); 酮羰基(195〜220);羧酸(170〜185); 羧酸及其衍生物(155〜185); 酰氯,酰胺(160〜175)} 五.质谱【篇二:2009 年波谱分析试卷 b 参考答案】1、化合物cl22cl 的核磁共振波谱中,h 的精细结构为三重峰。
《波谱解析 》期末考试试卷(答案)
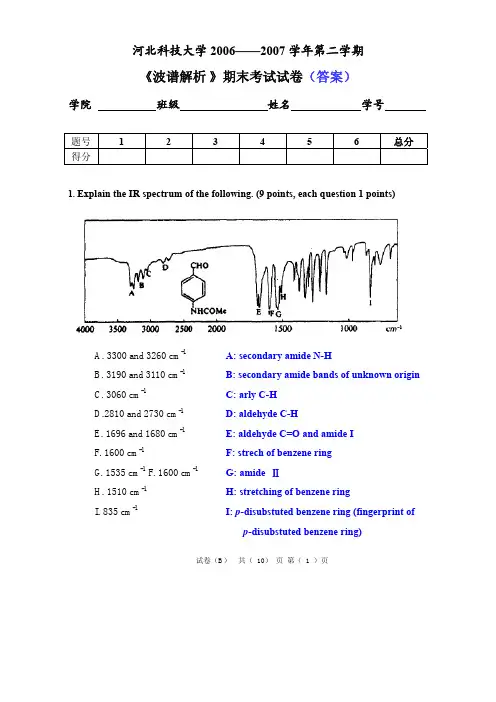
河北科技大学2006——2007学年第二学期《波谱解析》期末考试试卷(答案)学院班级姓名学号题号 1 2 3 4 5 6 总分得分1. Explain the IR spectrum of the following. (9 points, each question 1 points)A. 3300 and 3260 cm-1 A: secondary amide N-HB. 3190 and 3110 cm-1B: secondary amide bands of unknown originC. 3060 cm-1 C: arly C-HD.2810 and 2730 cm-1D: aldehyde C-HE. 1696 and 1680 cm-1E: aldehyde C=O and amide IF. 1600 cm-1 F: strech of benzene ringG. 1535 cm-1 F. 1600 cm-1G: amide ⅡH. 1510 cm-1H: stretching of benzene ringI. 835 cm-1 I: p-disubstuted benzene ring (fingerprint ofp-disubstuted benzene ring)试卷(B)共( 10)页第( 1 )页2. Deduce the structures for the products of the following reactions. (24 points)(1)Answer:MS: M+compound D may be the trimer of the starting material.So, adole condensation has been taken place between three molecular of thestarting material.1H NMR shows no methyl group.13C NMR shows carbonyl group.So the structure of compound D is the trimer of the starting material undertaking adol condensation.After reconfirm of the above data the structure is correct.试卷(B)共( 10)页第( 2 )页试卷(B ) 共( 10) 页 第( 3 )页(2)Answer:MS: The molecular weight of starting material has 146. MS: m + 110 suggests that atom Cl is removed from the starting material. The formula is C 7H 10O. IR: 1720cm -1shows that it has carbonyl group. The structure should be:COC 7H 10OExact Mass: 110.071H NMR data confirms the above structure.COCH 3CH 3H HHH2.22.26.27.7 1.11.1试卷(B ) 共( 10) 页 第( 4 )页3. Three compounds F, G and H, having molecular formula C 4H 8O. Based on the following 13C NMR and IR data, please suggest a structure for each compound, and then see whether your suggestions are compatible with the following information. (20 points)F: IR : 1730 cm -1; 13C NMR: δ201.6, 45.7, 15.7 and 13.3 G: IR : 3200 (broad) cm -1; 13C NMR: δ134.7, 117.2, 61.3 and 36.9H: IR: no peaks except CH and fingerprint;13C NMR: δ 67.9 and 25.8L: IR: 3200 ( broad) cm -1; 13C NMR: δ62.9, 36.0, 20.3 and 15.2Answer:F:H OG: H:OL:① Formula C 4H 8O, DBE=1. IR of F shows Oabsorption in 1730 cm -1.It could be an aldehyde or a ketone. 13C NMR shows no symmetrical carbon atom. So it should be an aldehyde, not ketone.② IR of G shows it has hydrogen bonds. 13C NMR of G shows Csp2. Because hydrogenation of G gives L, the G only isOH .③ H reacts with neither NaBH 4 nor H 2, so the structure has a ring. ④ L is the product of F and G. L structure can be easily deducedOH .4. Determination the compound structure based on the following spectra.(16 points)Answer:UV absorption strength ε= 0.28*72*100106*1=19. The intensity is very weak. It isa typical of the n-π* absorption of a saturated ketone or aldehyde.试卷(B)共( 10)页第( 5 )页IR has a very strong band at 1715cm-1, it should be a C=O.The 13C NMR shows that 4 carbon atoms are different. One (at δ208.8) is carbonyl carbon1H NMR: (δ 2.4) a quartet(2.09) a singlet(1.04) a tripletThe ratio of protons is 2:2:3.The whole structure is methyl ethyl ketone, CH3COCH2CH3.OThe mass spectrum verifies the final structure.43O3729试卷(B)共( 10)页第( 6 )页试卷(B ) 共( 10) 页 第( 7 )页5. Three compounds of formula C 4H 6 have been prepared by the routes shown below.Elucidate structures of these isomers. (15 points)Answer:A:B:C:A: 1.0 (4H, S) shows symmetrical -CH 2-; 5.35 (2H, S) shows CH 2RR.So is the structure, and 13C NMR verifies that structure.B: 2.13 (3H, S) shows -CH 3. 6.4 (1H, t, J =1Hz) showsCR RHC H 2R . 13CNMRtells 4 different carbons. All information gives the structure of .C:δ 7.18 (2H, d, J = 1Hz) R-CH=CH-R. 0.97 (3H, d, J = 5Hz) -CH 3. 1.46 (1H, 9t). So the structure is.6. Determination the compound structure based on the following spectra.(16 points)试卷(B)共( 10)页第( 8 )页Answer:UV absorption strength ε=0.75*210*1000.784*1=20089, a very strong intensity. Itmust have a long conjugated system.λmax=260 Substituted benzene with conjugated group.C 80.0% H 4.8%C: H: O=8012:4.81:10080 4.816−−=7:5:1MS: M+210 C14H10O2 DBE = 1013C NMR shows C=O and Csp2So the structure should be OOIR of the structure gives the information of benzene and carbonyl. So the structure is correct.Verification by MS:m/z=105.试卷(B)共( 10)页第( 9 )页。
波谱解析试题及答案

波普解析试题一、名词解释(5*4分=20分)1.波谱学2。
屏蔽效应3。
电池辐射区域4。
重排反应5。
驰骋过程二、选择题。
( 10*2分=20分)1。
化合物中只有一个羰基,却在1773cm-1和1736cm-1处出现两个吸收峰这是因为:()A、诱导效应B、共轭效应C、费米共振D、空间位阻2。
一种能作为色散型红外光谱仪的色散元件材料为:()A、玻璃B、石英C、红宝石D、卤化物晶体3.预测H2S分子的基频峰数为:()A、4B、3C、2D、14。
若外加磁场的强度H0逐渐加大时,则使原子核自旋能级的低能态跃迁到高能态所需的能量是如何变化的:()A、不变B、逐渐变大C、逐渐变小D、随原核而变5.下列哪种核不适宜核磁共振测定: ()A、12CB、15NC、19FD、31P6。
在丁酮质谱中,质荷比质为29的碎片离子是发生了()A、α-裂解B、I-裂解C、重排裂解D、γ—H迁移7。
在四谱综合解析过程中,确定苯环取代基的位置,最有效的方法是()A、紫外和核磁 B、质谱和红外 C、红外和核磁 D、质谱和核磁8。
下列化合物按1H化学位移值从大到小排列( )a。
CH2=CH2 b。
CH CH c.HCHO d.A、a、b、c、dB、a、c、b、dC、c、d、a、bD、d、c、b、a9。
在碱性条件下,苯酚的最大吸波长将发生何种变化?( )A.红移 B。
蓝移 C。
不变 D. 不能确定10。
芳烃(M=134),质谱图上于m/e91处显一强峰,试问其可能的结构是: ( )A.B。
C. D.三、问答题(5*5分=25分)1.红外光谱产生必须具备的两个条件是什么?2.影响物质红外光谱中峰位的因素有哪些?3. 色散型光谱仪主要有哪些部分组成?4。
核磁共振谱是物质内部什么运动在外部的一种表现形式?5。
紫外光谱在有机化合物结构鉴定中的主要贡献是什么?四、计算和推断题(9+9+17=35分)1。
某化合物(不含N元素)分子离子区质谱数据为M(72),相对丰度100%;M+1(73),相对丰度3。
波谱原理及解析(二版)习题答案

《波谱原理及解析》(二版)习题参考答案第2章 UV(1)有机分子常见的有σ→σ* 、n →σ*、 π→π*、n →π* 跃迁、还有电荷转移跃迁和配位体场微扰的d →d *跃迁等。
得到紫外-可见吸收光谱的主要是π→π*、n →π* 跃迁;含原子半径较大的杂原子的n→σ*跃迁造成;还有电荷转移跃迁和配位体场微扰的d →d *跃迁。
(2)a. 227; b.242; c.274; d.286; e.242; f.268; g.242; h.353; i.298; j.268。
(3)(1)可以,232,242;(2)可以,237,249;(3)可以257,222;(4)可以,259,242。
(4)上式:蓝移,ε变小,参见书; 下式:蓝移,ε变小,参见书。
(5)2.65⨯104(6)258nm (11000)为对硝基苯甲酸;255nm (3470)为邻硝基苯甲酸。
后者有位阻,共轭差。
(7)乙酰乙酸乙酯有烯醇式和酮式,烯醇式有共轭体系,其π→π*在240nm 附近。
可见溶剂极性小,烯醇式多,ε大。
(8).(9).为B ,254nm(10).H 2C 3CH 3(11).样品在水中不溶,丙酮和苯的透明下限太大,水、丙酮和苯不能用。
乙醇、环己烷、甲醇可用,乙醇最好,无毒、便宜,且测定后与文献值对照不用做溶剂校正。
(12).A 大,因A 中的NH 2上的未共用电子对与苯环形成共轭,而B 上的NH 2上的未共用电子对与苯环不形成共轭。
第3章 IR(1).不一定,只有有偶极距变化的振动产生红外吸收。
(2)υC=O 的大小:RCOOR ’>RCOR ’>RCONHR ’(3)A 的υC=O 大,B 有二甲氨基给电子共轭效应。
(4)(a )p-CH 3-Ph-COOH 与Ph-COOCH 3不同,前者有COOH 、对二取代;后者有酯基及单取代苯。
所以,在3200~2500、900~650cm -1处不一样。
波谱解析法课后答案
波谱解析法课后答案【篇一:有机波谱解析(习题一)】>1、试推测有机化合物a、b和c的结构式c4h8cl(a)c4h8o(b)2+c4h10o(c)c4h6c4h8o24-1 (b)有碘仿反应,红外光谱图在1715cm有强吸收峰。
a的nmr数据为3h(单峰),2h(四重峰),3h(三重峰)。
4、根据1hnmr谱推测下列化合物的结构。
[其中:s 表示单峰;d 表示双峰;b 表示宽峰;t 表示三重峰;q 表示四重峰;m 表示多重峰;h 表示七重峰]5、2,3-二甲基-2-溴丁烷与(ch3)3co-k+反应后生成两个化合物;6、推测下列化合物的结构。
1.4(s,1h),2.7(s,2h),7.2(s,5h)ppm;1.6(m,2h),2.7(s,1h),4.4(t,1h),7.2(q,4h)ppm;1.9(s,2h)ppm;且该化合物与hio4无反应。
9.9(s,1h)ppm;有机波谱解析答案chch1、a、 2 ch 2 ch 3 b、 ch 3 coch 23ccl3 c、ch3chch2ch32、a、 (ch3 ) 3 cchch 3 b、 2 c=c(ch3 ) 2 c、 ch3coch3(ch3)1740cm-1为酯羰基伸缩振动特征吸收峰。
och3ch2ch3ch3c(ch3)3ch4、1) 2)3) chch3ab3ach3c3ad 5、a、b、 chh3ch3a3ch3b峰。
所以,该化合物的结构为: hoch 2 3 。
ch2chch2c(ch3)2所以,该化合物的结构为:。
合物的结构为:brchch 2 ch 3。
ch3ch3无反应,说明不是邻二醇,其它峰说明脂肪链为: ch 2 ch 2或33连的碳不连h,所以,该化合物的结构为:(ch ) ch )。
3222326) ch 3 ch 2ch 2 cho 7)是(ch3)3cch2coch3而不是(ch3)3ccoch2ch38) ch 3 coch 2 ch 2coch 3 9) ch 3coch 2 ch(och3 ) 2ch2coch310)11) clcoch2ch3【篇二:紫外光谱分析法习题答案】班级姓名分数一、选择题1. 在紫外-可见光度分析中极性溶剂会使被测物吸收峰 (3 )(1) 消失(2) 精细结构更明显(3) 位移 (4) 分裂2. 双光束分光光度计与单光束分光光度计相比,其突出优点是 ( 4) (1) 可以扩大波长的应用范围;(2) 可以采用快速响应的检测系统(3) 可以抵消吸收池所带来的误差;(4) 可以抵消因光源的变化而产生的误差3. 许多化合物的吸收曲线表明,它们的最大吸收常常位于200─400nm 之间,对这一光谱区应选用的光源为 ( 1 )(1) 氘灯或氢灯 (2) 能斯特灯(3) 钨灯(4) 空心阴极灯灯4. 助色团对谱带的影响是使谱带 ( 1 )(1)波长变长 (2)波长变短(3)波长不变(4)谱带蓝移5. 指出下列哪种是紫外-可见分光光度计常用的光源? ( 4 )(1) 硅碳棒(2) 激光器(3) 空心阴极灯 (4) 卤钨灯6. 指出下列哪种不是紫外-可见分光光度计使用的检测器?( 1 )(1) 热电偶(2) 光电倍增管 (3) 光电池(4) 光电管7. 紫外-可见吸收光谱主要决定于 ( 2 )(1) 分子的振动、转动能级的跃迁; (2) 分子的电子结构(3) 原子的电子结构; (4) 原子的外层电子能级间跃迁8. 基于发射原理的分析方法是 ( 2 )(1) 光电比色法 (2) 荧光光度法(3) 紫外及可见分光光度法 (4) 红外光谱法9. 基于吸收原理的分析方法是( 4 )(1) 原子荧光光谱法;(2) 分子荧光光度法; (3) 光电直读光谱法; (4) 紫外及可见分光光度法10.在紫外-可见分光光度计中, 强度大且光谱区域广的光源是 ( 3)(1) 钨灯 (2) 氢灯 (3) 氙灯(4) 汞灯11. 物质的紫外-可见吸收光谱的产生是由于( 3 )(1) 分子的振动 (2) 分子的转动 (3) 原子核外层电子的跃迁 (4) 原子核内层电子的跃迁12. 阶跃线荧光的波长( 1 )(1)大于所吸收的辐射的波长;(2)小于所吸收的辐射的波长(3)等于所吸收的辐射的波长;(4)正比于所吸收的辐射的波长ch3ocooh(b)(a)(1) abc (2) cba(3)bac(4)cabch3o(c) 114. 在紫外-可见光谱区有吸收的化合物是( 4 )(1) ch3-ch=ch-ch3(2) ch3-ch2oh(3) ch2=ch-ch2-ch=ch2 (4) ch2=ch-ch=ch-ch315. 双波长分光光度计和单波长分光光度计的主要区别是( 2 ) (1)光源的个数; (2)单色器的个数; (3)吸收池的个数; (4)单色器和吸收池的个数- 16. 下列哪种方法可用于测定合金中皮克数量级(1012)的铋?( 2 )(1)分光光度法(2)中子活化(3)极谱法(4)电位滴定法 17. 在分光光度法中,运用朗伯-比尔定律进行定量分析采用的入射光为( 2 )(1)白光(2)单色光(3)可见光(4)紫外光18. 分子运动包括有电子相对原子核的运动(e电子)、核间相对位移的振动(e振动)和转动(e转动)这三种运动的能量大小顺序为( 3 )(1) e振动e转动e电子 (2) e转动e电子e振动 (3) e电子e振动e转动 (4) e电子e转动e振动二、填空题1. 在紫外-可见吸收光谱中, 一般电子能级跃迁类型为:(1)______________跃迁, 对应________________光谱区(2)______________跃迁, 对应________________光谱区(3)______________跃迁, 对应________________光谱区(4)______________跃迁, 对应________________光谱区[答] 1. ?─?*, 真空紫外;2. n─?*, 远紫外;3. ?─?*, 紫外;4. n─?*, 近紫外, 可见.2. 可见-紫外、原子吸收的定量分析吸收光谱法都可应用一个相同的_____________________定律, 亦称为 ___________ 。
波谱解析试题及答案大全
波谱解析试题及答案大全一、选择题1. 波谱解析中,核磁共振(NMR)技术主要用于研究分子中的哪种相互作用?A. 电子-电子相互作用B. 核-核相互作用C. 核-电子相互作用D. 电子-核相互作用答案:C2. 在红外光谱(IR)中,羰基(C=O)的伸缩振动通常出现在哪个波数范围内?A. 1000-1800 cm^-1B. 1800-2500 cm^-1C. 2500-3300 cm^-1D. 3300-3600 cm^-1答案:A3. 质谱(MS)中,分子离子峰(M+)通常表示分子的哪种信息?A. 分子的分子量B. 分子的化学式C. 分子的空间构型D. 分子的电子结构答案:A4. 紫外-可见光谱(UV-Vis)中,芳香族化合物的最大吸收波长通常在哪个范围内?A. 200-300 nmB. 300-400 nmC. 400-500 nmD. 500-600 nm答案:B5. 拉曼光谱(Raman)与红外光谱的主要区别在于?A. 样品的制备方法B. 样品的溶解性C. 样品的物理状态D. 样品的化学性质答案:C二、填空题6. 在核磁共振氢谱中,化学位移(δ)的单位是______。
答案:ppm7. 红外光谱中,双键的伸缩振动通常出现在______ cm^-1以上。
答案:16008. 质谱中,同位素峰是指分子离子峰的______。
答案:质量数不同的同位素分子离子峰9. 紫外-可见光谱中,最大吸收波长越长,表示分子的______越强。
答案:共轭效应10. 拉曼光谱中,散射光的频率与激发光的频率之差称为______。
答案:拉曼位移三、简答题11. 简述核磁共振技术中,自旋-自旋耦合(J-耦合)现象对氢谱的影响。
答案:自旋-自旋耦合现象会导致核磁共振氢谱中相邻质子之间的信号发生分裂,分裂的峰数取决于耦合质子的数量,这种现象可以帮助确定分子中质子的相对位置和连接方式。
12. 解释红外光谱中,碳氢键的伸缩振动和弯曲振动分别对应哪些波数范围,并说明其对分子结构分析的意义。
《波谱解析》试题B(含答案)
资料B一、填空1. 比尔定律成立的条件有,和。
2. UV测定中,要使△C/C较小,供试品溶液的吸光度应控制在范围内如偏低,可采取的措施有。
3. R带的跃迁类型为,波长范围为,吸收强度为,相应结构单元为。
4.能引起变化的振动称为红外活性振动。
5.红外光谱中特征区的波数范围是。
6. 红外光谱中振动能级由基态(V =0)跃迁到第一激发态(V =1)时产生的吸收峰称为峰。
振动能级由基态(V=0)跃迁到第二激发态(V=2)或第三激发态(V = 3)所产生的吸收峰称为峰。
7.在核磁共振波谱法中,测量化学位移值δ常用的参照物质是。
8.在NMR光谱中,正屏蔽效应使质子共振吸收信号向场位移,δ值。
9.在NMR波谱中,结构为的化合物,在一级图谱中,有组峰,有个不同的自旋系统。
10.在MS中,若不含氮或含有偶数氮的碎片离子的质量为偶数,一定含有_____数电子。
11.质谱图上出现质量数比相对分子质量大1或2个质量单位的峰,即M+1和M+2峰,其相对丰度符合___________,这些峰称为________ _ 峰。
12.在MS中,当发生OE母→OE子裂解时,丢掉的中性碎片是,属于裂解。
13.在质谱中,亚稳离子峰的作用是。
二、选择题1. 对200~400nm 范围内的辐射没有吸收的物质是( )。
A B CD CH 2=CHCH =CH 22. 某共轭二烯烃在正已烷中λmax 为219nm ,若改在乙醇中测定,吸收峰将( )。
A 红移 B 蓝移 C 峰高降低 D 位置不变3. 下列化合物中,其紫外光谱上能同时产生K 带、R 带的是( )。
A. C 6H 5—CH=CHCH 2OH B. CH 2=CHCH 2—O —CH 3 C. CH 2=CHCH 2CH 2CH 3 D. CH 2-CH =CH —CO —CH 34. 化合物 ,其K 带最大吸收波长λmax 为( )。
A. 373nm B. 355nm C. 390nm D. 385nm5. 红外吸收光谱的产生是由于( )。
波谱解析 第二章 红外光谱习题参考答案
10.
首先计算不饱和度:U=0,结构中含氧,推测可能是饱和醇或者醚。 3366cm-1:-OH 伸缩振动。(中等宽峰,含醇羟基,此化合物为饱和醇) 2974cm-1:-CH3 的 C-H 伸缩振动。 1381,1375cm-1:偕二甲基特征吸收。 1050 cm-1:伯醇 C—O 伸缩振动 综上所述,推测该化合物的结构为:
9. (较难判断)
首先计算不饱和度:U=8,结构中可能含有两个苯环或多个双键。 结合红外谱图分析, 3085,3021cm-1:苯环 C-H 伸缩振动。 2961,2856cm-1:-CH2 的 C-H 伸缩振动。 1601,1500,1452 cm-1:苯环骨架变形振动。 752,703cm-1:单取代苯环 C-H 面外弯曲振动。 谱图中没有明显的烯烃的峰,因此推测结构中应该含有两个苯环,其他的碳 氢均为饱和连接,且没有发现甲基的特征峰。 综上所述,推测该化合物的结构为:
5/6
12.
首先计算不饱和度:U=1,存在一个双键。 结合红外谱图分析, 3294cm-1:N-H 伸缩振动。 2946cm-1:-CH3 的 C-H 伸缩振动。 1655cm-1:羰基伸缩振动(酰胺Ⅰ峰)。 1563cm-1:仲酰胺 C-N-H 弯曲振动(酰胺Ⅱ峰)。 1372 cm-1:甲基对称变角振动。 1299cm-1:仲酰胺的酰胺Ⅲ峰。 721cm-1:仲酰胺 N-H 面外弯曲振动(酰胺Ⅴ峰)。 此外,2820~2720cm-1 无明显吸收峰,结构中不含醛基 综上所述,推测该化合物的结构为:
4.
(1)
O O
A
B
C
B 化合物中含有共轭双键,羰基双键 π 电子发生共轭而离域,降低了双键的
力常数,从而使 C=O 伸缩振动频率相对于 A 降低。C 化合物为烯醇酯,烯氧基
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《波谱原理及解析》(二版)习题参考答案第2章 UV(1)有机分子常见的有σ→σ* 、n →σ*、 π→π*、n →π* 跃迁、还有电荷转移跃迁和配位体场微扰的d →d *跃迁等。
得到紫外-可见吸收光谱的主要是π→π*、n →π* 跃迁;含原子半径较大的杂原子的n→σ*跃迁造成;还有电荷转移跃迁和配位体场微扰的d →d *跃迁。
(2)a. 227; b.242; c.274; d.286; e.242; f.268; g.242; h.353; i.298; j.268。
(3)(1)可以,232,242;(2)可以,237,249;(3)可以257,222;(4)可以,259,242。
(4)上式:蓝移,ε变小,参见书; 下式:蓝移,ε变小,参见书。
(5)2.65⨯104(6)258nm (11000)为对硝基苯甲酸;255nm (3470)为邻硝基苯甲酸。
后者有位阻,共轭差。
(7)乙酰乙酸乙酯有烯醇式和酮式,烯醇式有共轭体系,其π→π*在240nm 附近。
可见溶剂极性小,烯醇式多,ε大。
(8).(9).为B ,254nm(10).H 2C 3CH 3(11).样品在水中不溶,丙酮和苯的透明下限太大,水、丙酮和苯不能用。
乙醇、环己烷、甲醇可用,乙醇最好,无毒、便宜,且测定后与文献值对照不用做溶剂校正。
(12).A 大,因A 中的NH 2上的未共用电子对与苯环形成共轭,而B 上的NH 2上的未共用电子对与苯环不形成共轭。
第3章 IR(1).不一定,只有有偶极距变化的振动产生红外吸收。
(2)υC=O 的大小:RCOOR ’>RCOR ’>RCONHR ’(3)A 的υC=O 大,B 有二甲氨基给电子共轭效应。
(4)(a )p-CH 3-Ph-COOH 与Ph-COOCH 3不同,前者有COOH 、对二取代;后者有酯基及单取代苯。
所以,在3200~2500、900~650cm -1处不一样。
另外,后者有1330~1230 cm -1最强峰,无955~915 cm -1宽峰;前者有3200~2500特征峰、955~915 cm -1宽峰,最强峰为υC=O 。
(b )苯酚有单取代苯环,3100~3000、1625~1450、900~650的相关吸收;环己醇在3000~2800、~1465有相关吸收。
δOH 和υC-O 的吸收位置也不一样。
(5)A 是环状酸酐,有两个υC=O ;B 是内酯,有1个υC=O 。
(6)为前者。
(7)Ph-COCH 3 ;(8)p-NO 2-Ph-CHO; (9)1-辛烯,(10)(a )1738 cm -1、1650 cm -1、1717 cm -1分别B 、C 、A 的υC=O ;(b) 当溶剂极性减小时烯醇式增多,故C 增强,A 、B 减弱;(c) 此强吸收对应着烯醇式中αβ不饱和酯的UV 光谱,溶剂由乙醇变为己烷时烯醇式增多,故此吸收增强。
(11)邻二甲苯。
(12) 乙酸乙酯。
33C CH 3CH 23333(242nm)第4章 1HNMR(1). B 0b >B 0a >B 0c ; δb <δa <δc 。
σ增大,δ减小。
(2).左边化合物:δb <δa 。
因为Ha 受氧原子的吸电子效应大,受C-C 各向异性去屏蔽效应也多。
右边化合物:δb <δa 。
Ha 受Cl 原子的吸电子效应大于H b 受Br 原子的吸电子效应。
(3).(a)4个质子磁全同,单峰;(b)两个单峰,CH 2Cl 位移大;(c)图从左到右:四重峰(OCH 2)、单峰(OCH 3)、三重峰(CH 3);(d)图从左到右:单峰(OH )、四重峰(CH 2)、三重峰(CH 3);或四重峰(CH 2)、单峰(OH )、三重峰(CH 3) (e) 图从左到右:三重峰(CHO )、8重(CH 2)、三重峰(CH 3)。
(4) (a)A 2X 2; (b)A 3M 2X; (c)2个自旋系统AMX ,另有A 3; (d)AB B ’XX ’Y .(5) O(6)CH 3OCH 3OBr CHO(7) NH 2(s, ~6.3);CH 2(q, ~2.3);CH 3(t, ~1.3)。
(8).① (CH 3)2C(OCH 3)2;②(CH 3)3C-O-CO-CH 3;③Ph-C(CH 3)2CH 2Cl ④CH 3COOCH 2CH 2Ph ; (9)①CH 3CCl 2CH 3;②CH 3CH 2CHCl 2;③CH 3CHClCH 2Cl;④CH 2ClCH 2CH 2Cl (10)图从左到右,从上到下对应:(b),(a),(c),(e).(11)a 大 b 小,b 在另一个苯环的正上方,受屏蔽。
(12)a-4重峰,b-6重峰(2组3重峰),c-单峰,d-4重峰第5章 13CNMR1.PhCOCH 2CH 2CH 3;2.二氧六环;3.PhCH 2OH ;4.5. DEPT 谱可确定CH 3、CH 2、CH ,从去偶谱中减去DEPT 谱中出现的有质子的碳即为季碳。
6.CF 3COOCH 37.N8.第6章 MS1.(a)m *56.47, (b)由90→62产生m *42.7,由62→48产生m *37。
2. m/Z 57为(CH 3)3C +, m/Z 155为分子离子丢CH3.所得。
简单裂解易在支链碳处断裂,得到带支链较多的离子较稳定。
3.烯丙基裂解丢甲基得97离子,烯丙基裂解丢乙基得83离子。
4. 3.3-二甲基-2-丁醇。
5. 符合,简单裂解得71、43离子,麦氏重排得58离子。
6.(A )。
HNO7.同时脱水、脱烯得42离子。
8.正确。
9. (1)C 2H 3Cl ;(2)C 2H 6S 。
10.CH 3CO-Ph-NO 211.p-Br-Ph-OCH 2CH 3。
12.溴苯 13.2-己酮第7章 综合解析(结构式中数字为1HNMR 和13CNMR 的δ值) 1. Diethyl ketoneH 2CCC H 2OH 3CH 3C 232O11(A)(A)(B)(B)1.1 A 2.4 B212.1 135.5 27.9 32. P-bromotolueneBrH 3CHHH 324231Br5(A)(A ')(B)(B ')(C) 6.96 A 7.29 B 2.3 C136.7 1131.2 2130.8 3119.1 420.9 53. Tert-butylcarbinolCH 3C CH 2CH 3H 3COH 3213OH(A)(A)(A)(B)(C)0.91 A 3.28 B 2.05 C73.2 162.6 226.1 34.Benzyl acetateH 2C O CH 3O 344425O C 6O170.7 1136.1 2128.6 3128.2 466.2 520.8 67.3 A 5.09 B 2.06 CAA AAA B C5.Tert-pentylbenzeneC CH 3CH 3H 2C CH 33431257768(A)(B)(C)(D)(E)(F)(A ')(B ')(E)7.3 A 7.3 B 7.2 C 1.6 D 1.3 E 0.7 F149.4 1128.0 2125.9 3125.3 437.9 536.3 628.7 79.1 86.heptanalH 3C(CH 2)2(CH 2)2CH 2CHO 7634521O(A)(B)(C)(D)(E)9.8 A 2.4 B 1.6 C 1.3 D 0.9 E202.8 144.0 231.6 328.9 422.5 5*22.1 6*14.0 77.1.2.3-TrichloropropaneCL21ClCLH H(B)(C)4.24 A 3.9 B 3.8 C58.5 145.1 28.1-Phenyl-1-2-ethanediol23145OH 6OHH COH CH 2OH (B)(C)(D)(D)(D)(D)(D)(A)(B)3.7 to 3.6 A 3.69 B4.7 C 7.3 D140.5 1128.4 2127.8 3126.1 474.7 567.9 69.Diisopropyl etherH 3CCHH 3COCHCH 3CH 3H 3CCHH 3CO211(B)(A)(A)1.1 A 3.6 B 23 168.5 210. HydrocinnamaldehydeH 2C H 2C CHO4536127(A)(B)(C)(D)(D)(D)(D)(D)2.8 A 2.9 B28.1 145.2 2126.3 3128.5 4128.6 5140.3 6201.5 711. L-2-amino-1-propanolH 3CC C OH H H HNH 2321OHH HH NH 2A(D)(D)(B)(C)(E)A 3.53*B 3.24*C 3.10D 2.53E 1.051 67.92 48.53 19.5第8章 旋光光谱与圆二色光谱1.它的平面投影(按八区律)如图所示,它应有正的Cotton 效应。
2.从下面各自的投影图可看出,二者都应当有正的 Cotton 效应,胆甾-2-酮的摩尔振幅应比胆甾-3-酮大的多。
3.该化合物的甲基有e 构象的A 与a 构象的B 两种结构,A 结构为正Cotton 效应,B 结构为负Cotton 效应,由于实验值为正,故该化合物为是甲基有e 构象的A 结构。
4.(1)对应Ⅱ,(2)对应Ⅳ,(3)左旋,(4)3者波长基本相等。
OOHH CH 3A BC 8H5或简化成。
