烷烃和环烷烃的化学性质及制备
第二章烷烃和环烷烃
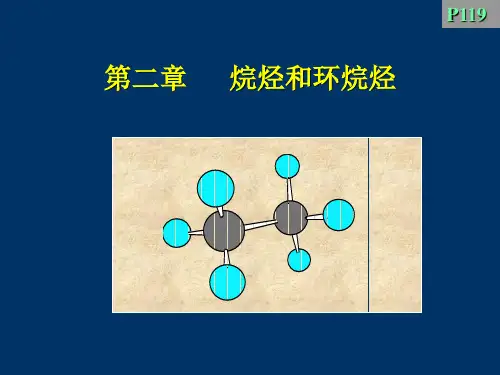
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
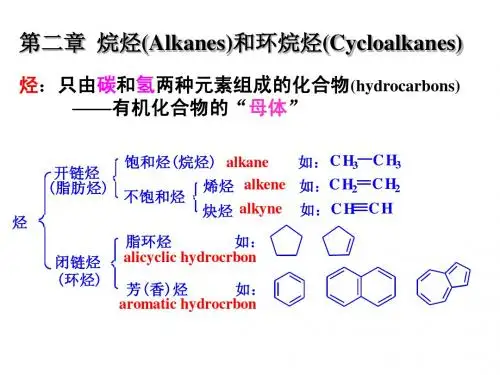
烷烃、环烷烃

烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
有机化学课件第-二-章烷烃和环烷烃_图文

烷烃熔点的特点 (1) 随相对分子质量增大
而增大。 (2) 偶数碳烷烃比奇数碳
烷烃的熔点升高值 大 (如右图)。 (3)相对分子质量相同的烷 烃,叉链增多,熔点 下降。
偶数碳 奇数碳
(二) 沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低。 (非极性,只有色散力)
H2O2 + Fe2+
RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
自由基的稳定性
均裂 H=359.8kJ/mol (88kcal/mol) 共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
苯甲基自由基
稀丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
Hammond假设:过渡态总是与能量相近 的分子的结构相近似。
甲烷氯代反应势能图
甲烷氯代反应势能图的分析
1、第一步反应的活化能比较大,是速控步骤。 2、第二步反应利于平衡的移动。 3、反应 1 吸热,反应 2 放热,总反应放热,所以反应 只需开始时供热。 4、过渡态的结构与中间体(中间体是自由基)相似, 所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
甲烷氯代反应的适用范围
1、 该反应只适宜工业生产而不适宜实验室制备。 2 、该反应可以用来制备一氯甲烷或四氯化碳,不适 宜制备二氯甲烷和三氯甲烷。 3、无取代基的环烷烃的一氯代反应也可以用相应方法 制备,C(CH3)4的一氯代反应也能用此方法制备。
(2) 甲烷卤代反应活性的比较
第二章 烷烃和环烷烃
C H3C H2C H2 C H3C H2C H2C H2 C H3C HC H 2 C H3
(正)丁基 Bu 异丁基 i -Bu
C H3C HC H C H3 仲丁基 2 s-Bu C H3 C H3 C C H3 叔丁基 t-Bu
在生理状况下,机体自由基一方面不断产 生,另一方面又不断清除,活性氧处于产生与清 除平衡状态。一旦活性氧的产生和清除失去平衡 ,过多的自由基就会造成对机体的损害,从而引 起多种疾病,并可诱发癌症和导致衰老。 天然抗氧化酶系统:超氧化物歧化酶(SOD) 、 过 氧 化 氢 酶 ( CAT)、 谷 胱 甘 肽 过 氧 化 物 酶 (GSH-Px)
构象异构
(一) 烷烃的构造异构(constitutional isomerism)
戊烷有3种碳链异构体
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷 异戊烷
CH3 CH3-C-CH3 CH3
新戊烷
碳原子数 异构体数 4 5 6 7 2 3 5 9
碳原子数 8 9 10 20
异构体数 18 35 75 366 319
天然抗氧剂(自由基清除剂):VE、 Vc、 2巯基乙胺、谷胱甘肽、辅酶Qn(泛醌)、-硫辛酸 等
第二节 环 烷 烃
一、脂环烃的分类和命名
(一) 分类 C3-C4
根 据 环 数 多 少 分
小环 普通环
单脂环烃
C5-C6
C7-C12
中环
C13以上 大环 多脂环烃 桥环 螺环
(二) 命名
1. 单脂环烃: 在相应的烃名前加“环”字;英文名加词头cyclo
2.烷烃和环烷烃
③ 写出少二个碳原子的直链式为主链
CH3 H3C C CH3
CH3
新戊烷
第一节 分类、构造异构和碳原子的级
烃:仅由C、H两种元素组成的化合物。
烷烃 脂肪烃 烯烃 烃 脂环烃 炔烃
芳香烃
(2)单环烷烃的构造异构 环的大小和环上取代基的不同而引起的异构; 与单烯烃互为异构。
C4H8
H2C C CH3 CH3
e
四、环己烷的构象
1、椅式、船式和扭船式构象 角偏差(α) = (109.5o-120o) / 2=-5.25o 较大。
通过环内C-Cσ键旋转,调整其内角接近109.5o, 使完全无角张力——椅式和船式构象。
(1)椅式构象
H
H
H
5
H
6
H
1
H
4
3H
H
H
2
H
H
① 无角张力。
② C1、C3、C5上或C2、C4、C6上处于竖直向上或 向下的三个氢原子间距离为2.3Å,约等于氢原子范 德华半径之和(2.5Å)——无范德华排斥力(跨环张力)。
把支链作为取代基。
1、常见的烷基: 相应的烷烃去掉一个氢原子后留下的原子团。
通式:CnH2n+1
常以 R- 表示
甲基(Me)—— CH3乙基(Et) —— C2H5-
异丙基(i-Pr)—— H3C CH
CH3
正丁基(n-Bu)—— CH3CH2CH2CH2-
异丁基(i-Bu)—— H3C CH CH2
一、烷烃的结构
结构
C:sp3 Csp3-Hs Csp3-Csp3 σ键
1、σ键:轴向重叠形成的共价键(头碰头), 呈圆柱形轴对称。
2、σ键特性 ① 原子轨道轴向重叠(重叠程度大,键较牢固)。 ② 成键轨道呈轴对称,可“自由旋转”。
第二章饱和烃:烷烃和环烷烃

2
CH
8CH
CH2
3CH2
7
1
2
6CH2
CH
5
CH2
4
式中两环共用的叔碳原子(1,5)称为“桥头”
从一个桥头到另外一个桥头的链或键称为“桥”或―桥路‖
此例中有三个桥,即碳链2-3-4,碳链6-7和碳链8
29
命名原则
确定母体名称:按成环碳原子的总数称为“某烷”。 注明环数:以“二环”作词头,放在母体名称前面。 注明桥的结构:将各桥所含碳原子数按由多到少的次 序用数字表示,放在词头和母体之间的方括号中,在数 字之间的右下角用小圆点“.”隔开。 编号:从一个桥头开始循环最长的桥编到另一桥头, 然后再循余下的最长的桥编回到起始桥头。最短的桥最 后编号,且仍从起始桥头一端的碳原子开始编号。
18
例如
CH3 CH CH3 CH2 CH3
二甲基乙基甲烷
CH2CH3 CH3 C CH CH3
二甲基乙基异丙基甲烷
CH3 CH3
该命名法虽能清楚地表示分子的结构,但是不能 适用于结构较复杂的烷烃的命名。目前文献中已 很少使用。
19
(3)系统命名法(重点)
系统命名法是我国根据1892年日内瓦国际化学会议首次拟定
饱和脂肪烃(烷烃):是指分子中的碳原子以单 键相连,其余的价键都与氢结合而成的化合物。
H H C H H H H C H H C H H H H C H H C H H C H H H H C H H C H H C H H C H H
甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 丁烷(C4H10)
H H
H C
CH3 CH3 C H C CH3
C
有机化学第四章烷烃和环烷烃
1. 乙烷的构象
小于两个H 的 von der waals 半 径(1.2Å)之和, 有排斥力
<60o
2 H
H C H H
2.3 Å
H C H H
60o
H H H H 1 1 2 H H H
C1旋转
H H
1 1 H
C1旋转
H H
2H 11 H H H
H
交叉式构象 staggered conformer 原子间距离最远 内能较低 (最稳定)
奇数碳
沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低(非极性,只有色散力)。 (2)随相对分子质量增大而增大(运动能量增大,范德华引力增大)。 (3)相对分子质量相同、叉链多、沸点低。(叉链多,分子不易接近)
密度
烷烃的密度均小于1(0.424-0.780) 偶极矩均为0。
饱和烃的偶极矩 溶解度
自由基型链反应(chain reaction)
甲烷的溴代反应机理
(1) (2) (3)
Br Br Br +
hv or
Br
+ Br Br H + CH3
链引发 chain initiation
H
CH3
CH3 + Br
Br
CH3 Br + Br
第(2), (3)步反应重复进行 (4) (5) (6) Br Br CH3 + + + Br CH3 CH3 Br Br
扭曲式构象 skewed conformer (有无数个)
重叠式构象 eclipsed conformer 键电子云排斥, von der waals排斥力,内能较高 (最不稳定)
有机化学2---烷烃和环烷烃
英文缩写 Me Et n-Pro i-Pro n-Bu i-Bu s-Bu t-Bu
CH2 CH2 CH3
CH CH3 CH3
CH2CH2CH2CH3
CH2CHCH3 CH3
C HC H 2 C H 3 C H3
CH3 C CH3 CH3
2.2 烷烃和环烷烃的命名
◇ 环烷基: 环丙基 环丁基 环戊基 环己基
CH4 CH3CH2CH3 C3H8 CH3CH2CH2CH3 C4H10
环烷烃的通式为CnH2n
2.1 烷烃和环烷烃的构造异构
同系列——通式相同,组成上相差CH2 及其整数倍的一系 列化合物。 同分异构体——分子式相同的不同化合物。 构造异构体——分子式相同,分子的构造不同的化合物。 例:通式为C5H12
思考:为什么不是3-甲基-5-异丙基庚烷?
2.2 烷烃和环烷烃的命名
2.2.4 环烷烃的命名 脂环烃是脂肪烃连接成环的化合物。 分子中只有单键的脂环烃是环烷烃 含有双键的脂环烃是环烯烃。 (1)单环环烷烃 以环作为主体,按环的碳原子数目称为环某烷; 单环 二环 多环
环丙烷
环丁烷
环戊烷
环己烷
2.2 烷烃和环烷烃的命名
CH3CH2CH2CH2CH3 CH3CHCH2CH3 CH3 CH3 CH3 CH3 CH3 新戊烷
正戊烷
异戊烷
通式为C5H10的环烷烃
CH3
H3C CH3
CH2CH3
CH3
CH3
2.1 烷烃和环烷烃的构造异构
正丁烷
CH3 CH2 CH2 CH3
简式: CH3(CH2)2CH3
CH3
CH3 CH CH3
2 饱和烃:烷烃和环烷烃
2.1 烷烃和环烷烃的构造异构 2.2 烷烃和环烷烃的命名 2.3 烷烃和环烷烃的结构 2.4 烷烃和环烷烃的构象 2.5 烷烃和环烷烃的物理性质 2.6 烷烃和环烷烃的化学性质 2.7 烷烃和环烷烃的主要来源和制法
第二章-烷烃与环烷烃
分子式相同,
烷 烃 和 环 烷 烃
6
有 机 化 学
烷烃和环烷烃同分异构体的推导
(逐步缩短碳链): ①写出最长链;
烷 烃 和 环 烷 烃
②写出少一个碳原子的直链,把一个碳当支链, 找出可能的异构体;
③写出少二个碳原子的直链,把二个碳当两个
支链,或一个支链,找出可能的异构体。
7
有 2.2 烷烃和环烷烃的命名 机 化 学 一、伯、仲、叔和季碳原子 1、伯碳原子
合物,称为同系列。
烷 烃 和 环 烷 烃
4、同系物
同系列中的化合物互称为同系物。
5、系差
同系列中相邻两个化合物在组成上的差别。烷
烃系差为CH2。
5
有 机 化 二、烷烃和环烷烃的构造异构 学 碳架异构:
碳的骨架不同。 构造异构体: 同分异构体: 分子式相同,分子内原子间相互连 分子式相同,结构不同。 接的顺序不同,即分子的构造不同。 是不同的化合物。
异丁基 (CH3)2CHCH2-
i-Bu11
有 机 (3)仲某基: 仲丁基: 化 学
CH3
CH3CH2CH - s-BuCH3 CH3 CH3
(4)叔某基: 叔丁基: (CH3)3C- t-Bu- ; 叔戊基: CH3CH2C
烷 (5)新某基: 新戊基 : CH3—C—CH2— 烃 CH3 和 2 、亚烷基 环 烷 烷烃分子中,去掉两个氢原子后剩余的基团。 烃
烷 ③相同基团合并写出,位置用2,3……阿拉伯数字标出, 取代 烃 和 基数目用二,三……中文数字标出。 环 ④阿拉伯数字与汉字之间必须用短横线分开; 烷 ⑤阿拉伯数字之间必须用逗号分开。 烃
最长碳链,最小定位,同基合并,由简到繁。
22
烷烃和环烷烃
烃——分子中只含有碳和氢两种元素的有机化合物。 烷烃——碳原子完全被氢所饱和的烃。
烃是有机化合物的母体。
开 链 烃 (脂 肪 烃 )
饱和烃
烷烃 烯烃
不饱和烃 烃 脂环烃( 环状烃 芳香烃(
炔烃 二烯烃
` `
` `
... ... )
CH3
... ... )
第二章 饱和烃:烷烃和环烷烃
2.1 烷烃和环烷烃的通式和构造异构
尾端含有
结构片段,其余为直链,为异某基
尾端含有
结构片段,其余为直链,为新某基
预备知识:烷基和环烷基
环烷烃环上失去1个氢原子,为环某基
烷烃和环烷烃的命名
环丙基
环丁基
环戊基
环己基
烷烃分子从形式上去掉两个氢原子所剩下的基团叫亚烷基。
如:
CH2 亚甲基 CHCH3 亚乙基 C(CH3)2 亚异丙基 -CH2CH21,2-亚乙基 -CH2CH2CH2CH2CH2CH21,6-亚己基
CH2 CH2
CH3
CH3 CH3
环戊烷
CH3
即
H CH3
CH3
即
H CH3
CH3 H
CH H3C
CH3
H
1-甲基-4-异丙基环己烷
反-1,4-二甲基环己烷
当环上碳原子数比碳链的原子数还少时,或者碳链连有多个 环时,将环作取代基
• P31, 习题2.6
烷烃和环烷烃的命名
(2) 二环环烷烃
• 分子中含有两个碳环的是双环化合物。
例如:
CH3 CH CH2CH3 CH3
二甲基乙基甲烷
CH3 CH3 C CH3
CH3
四直链烷烃:
烷烃和环烷烃的命名
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷烃和环烷烃的化学性质及制备
一、烷烃的主要化学性质
总体:稳定,自由基型反应居多。
(一)燃烧和氧化
一般条件下不与普通氧化剂反应,剧烈可燃烧,C →CO 2,H →H 2O ,(杂→氧化物)
有机化学中:氧化=加氧or 去氢,还原=加氢or 去氧
(二)卤代反应(实质:取代反应)
取代反应(substitution reaction )是指有机化合物受到某类试剂的进攻,致使分子中一个原子(或基团)被这个试剂所取代的反应。
分为亲电取代、亲核取代、自由基取代三类。
探讨一类有机反应主要从以下四个方面展开:反应产物、反应类型、反应历程、反应活性(反应活性又可从试剂和底物两个方面讨论)。
烷烃的取代属于自由基取代反应。
反应产物:一~多卤代烷
反应类型:自由基型(反应条件:光照 or 高温) 反应历程:链引发、增长、终止 反应活性:试剂角度考虑:氟 〉〉氯 〉溴 〉〉碘
底物角度考虑:叔氢 〉仲氢 〉伯氢
二、烷烃的来源和制备
1、烷烃是其他有机物的母体,一般不经人工合成,而是从天然气和石油中获得。
2、天然来源烷烃是相当复杂的混合物,难以分离。
若需纯粹烷烃,可人工合成来制备。
3、工业生产采用柯尔伯电解羧酸盐来制取
4、实验室通过武兹、科瑞-郝思合成法以及还原反应来获得。
(1)武慈反应(制备对称烷烃)
2RX (乙醚) + Na → R-R + 2NaX ( X = Br 、I )
(2)科瑞-郝思反应
R 2CuLi (二烷基铜锂) + R ’X → R-R ’ + RCu (烷基铜) + LiX
(3)还原
卤代烃、醇、醛、酮、酸等还原制得(见以后章节)
三、环烷烃的主要化学性质
总体:大环像烷,小环像烯。
(一)取代反应(卤代,自由基型)
+ Br + HBr
Br
日光
环己烷
溴代环己烷
(二)氧化反应
1、可燃 → CO 2 + H 2O
2、特殊条件 → 开链二元羧酸
+ O
2
Co HOOC(CH 2 )4 COOH 己二酸
(合成尼龙66之主要原料)
3、常温、常压、普通氧化剂 → 不反应
应用:环烷烃常温下不能使酸性高锰酸钾褪色(开链烷烃也不能),可用于鉴别(见以后章节)。
(三)加成反应(开环)
加成反应:受试剂进攻,旧键打开后,两端原子各连接上一个新原子(或基团)的反应,常在不饱和键和低级环化物中发生,最常见的是烯烃的亲电加成和羰基的亲核加成。
环烷烃中,小环的结构特点决定了其内能高、不稳定,更易开环发生加成反应(本章节中不讨论此反应的类型及历程)。
1、催化加氢 → 烷烃
+ H
2Ni
CH 3CH 2CH 3
+ H 2Ni 120~180
℃ CH 3CH 2CH 2CH 3+ H 2
Pt >300
℃
CH 3CH 2CH 2CH 2CH 3
由反应条件知:不同底物中小环活性高,更易反应。
2、加卤素 → 卤代烷烃(只适用于小环)
+ Br
2室温4
BrCH 2CH 2CH 2 Br
+ Br 2
4
BrCH 2 CH 2CH 2CH 2 Br
(红棕)(无色)CH 3+ Br 2
CCl 4
Br
CH 2CH 2CHCH 3
对于取代环烷烃,断键发生在H 最多和H 最少间。
应用:鉴别:小环能使Br 2/H 2O 或
Br 2/CCl
4褪色,而大环不能(开链烷烃亦不能)。
例如:
or Br
2 / H 2O
Br / CCl (-)褪色
可见:大环似烷,小环似烯(烯也能使溴水褪色)
3、加卤化氢 卤代烷烃(只适用于小环和活泼卤化氢如HBr 、HI )
+ HBr
CH 3
+ HBr (马氏规律)
Br
3CH 2CHCH 3
BrCHCH 2CH 3
对于取代环烷,反应产物遵循“马氏规律”:断于H
最多和H 最少间,H 加在H 多上。
四、环烷烃的制备(不要求,略)
五、鉴别题举例
要求:鉴别(和分离)题均按以下表达方式进行解题。
1、环丙烷和丙烷
解:CH 3CH 2CH 3
24
褪色(——)
2、1,2-二甲基环丙烷, 环戊烷
解:CH 3
H 3C 24
褪色(——)。
