氧、硫及其重要化合物
(完整word)25知识讲解——氧和硫(基础)

高考总复习《氧硫》【考纲要求】1.了解氧及其重要化合物的性质。
2.了解硫及其重要化合物的性质;了解大气污染的来源、危害与治理.3.重点掌握二氧化硫、硫酸的性质.【知识网络】硫及其化合物转化关系FeS【考点梳理】考点一、氧单质及其化合物1.氧气的化学性质:常温下较稳定,加热或点燃时表现强氧化性。
2.臭氧:O3⑴物理性质:在常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,它的密度比氧气的大,也比氧气易溶于水.液态臭氧呈深蓝色,沸点为—112.4℃,固体臭氧呈紫黑色,熔点为—251℃。
⑵化学性质及用途:臭氧的化学性质比氧气活泼.①不稳定性:2O3=3O2;但在空气中高压放电就能产生臭氧:3O2放电2O3②强氧化性:Ag、Hg等金属在空气或氧气中不易被氧化,但可以被臭氧氧化。
也可使湿润的淀粉-KI试纸变蓝:2KI+O3+H2O=I2+O2+2KOH③用途:臭氧是一种很好的漂白剂和消毒剂.空气中的微量O3,能刺激中枢神经加快血液循环,令人产生爽快的感觉但当空气中臭氧的含量超过10—5%(体积分数)时,就会对人体、动植物以及暴露空气中的物质造成危害,臭氧可以吸收来自太阳的大部分紫外线,是人类和生物的保护伞。
近年来,臭氧层受到氟氯烃等气体的破坏,形成“臭氧空洞”,危害地球环境,各国应采取共同行动保护,氧层,维护人类和生物的生存环境。
3.过氧化氢(H2O2)(1)结构化学式:H2O2电子式:结构式: H-O-O-H(2)物理性质无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性。
(3)化学性质H2O2,氧元素的化合价为中间价态(—1),即有氧化性又有还原性。
氧化性:H2O2+H2S=S↓+2H2O还原性:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O自身氧化-还原:(实验室用此法代替KClO3分解制氧气),家庭中的“氧立得”使用时中间产物就有过氧化氢.4.H2O(1)H2O做氧化剂2Na+2H2O=2NaOH+H2↑(2)H2O做还原剂2F2+2H2O=4HF+O2(3)H2O既不做氧化剂又不做还原剂2Na2O2+2H2O=4NaOH+O2↑Cl2+H2O=HCl+HClO3NO2+H2O=2HNO3+NO(4)H2O既做氧化剂又做还原剂2H2O电解2H2+O2↑考点二、硫及其氧化物1.硫:(1)物理性质:硫为黄色晶体,不溶于水,微溶于酒精,易溶于CS2。
硫及其重要化合物完美版
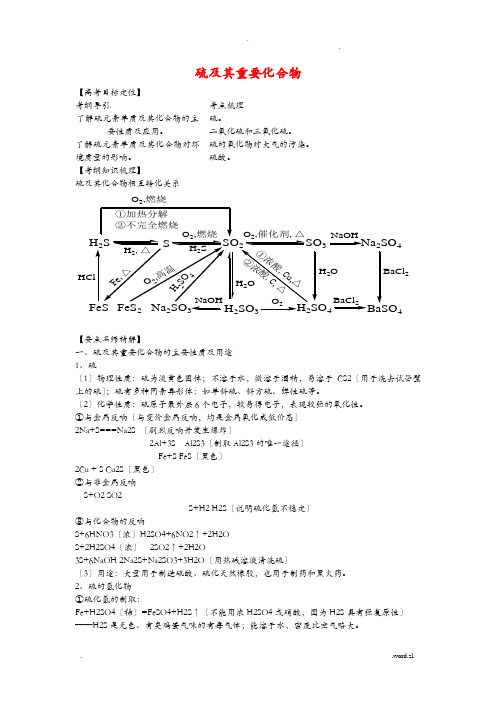
硫及其重要化合物【高考目标定位】 考纲导引考点梳理 了解硫元素单质及其化合物的主要性质及应用。
了解硫元素单质及其化合物对环境质量的影响。
硫。
二氧化硫和三氧化硫。
硫的氧化物对大气的污染。
硫酸。
【考纲知识梳理】硫及其化合物相互转化关系H 2SSSO 23Na SO 4223H 22SO 4HClH 2,△O 2,燃烧H 2SO ,燃烧①加热分解②不完全燃烧2NaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△【要点名师精解】一、硫及其重要化合物的主要性质及用途 1、硫〔1〕物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2〔用于洗去试管壁上的硫〕;硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
〔2〕化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反响〔与变价金属反响,均是金属氧化成低价态〕 2Na+S===Na2S 〔剧烈反响并发生爆炸〕2Al+3S Al2S3〔制取Al2S3的唯一途径〕 Fe+S FeS 〔黑色〕 2Cu + S Cu2S 〔黑色〕 ②与非金属反响 S+O2 SO2S+H2 H2S 〔说明硫化氢不稳定〕 ③与化合物的反响S+6HNO3〔浓〕H2SO4+6NO2↑+2H2O S+2H2SO4〔浓〕 2SO2↑+2H2O3S+6NaOH 2Na2S+Na2SO3+3H2O 〔用热碱溶液清洗硫〕〔3〕用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2、硫的氢化物 ①硫化氢的制取:Fe+H2SO4〔稀〕=FeSO4+H2S ↑〔不能用浓H2SO4或硝酸,因为H2S 具有强复原性〕 ——H2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质 A .可燃性:当22/O S H n n ≥2/1时,2H2S+O2 2S+2H2O 〔H2S 过量〕当22/O S H n n ≤2/3时,2H2S+3O22SO2+2H2O 〔O2过量〕当23222<<O S H n n 时,两种反响物全部反响完,而产物既有硫又有SO2B .强复原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S 氧化。
氧硫及其化合物

氧、硫及其化合物一、氧及其化合物1.臭氧(1)与O2互为同素异形体:(2)臭氧化学性质:①极强氧化性:使润湿的淀粉KI试纸变蓝(方程式)_____________________②漂白和消毒(3)臭氧层2.H2O2(1)结构:电子式______________,结构式____________,化学键类型____________ (2)化学性质:①氧化性:I-(H+)、Fe2+(H+)、酸性条件下溶解Cu应用:杀菌消毒、漂白(讨论含酚酞的NaOH溶液)②还原性:与KMnO4(H+)反应③不稳定性:应用:实验室制氧气方法3.H2O的作用(1)氧化性:Na、Mg、Fe、C(反应条件)(2)还原性:(3)既有氧化性又有还原性:(4)既不显氧化性又不显还原性:Cl2+H2O、NO2+H2O、Na2O2+H2O等水解(盐、CaC2、卤代烃、酯、多糖)二、硫及其化合物1.硫元素的特点——多变价(-2;0;+4;+6)2.硫单质(1)物理性质(2)化学性质①弱氧化性:可氧化金属(Na、Fe、Cu、Ag、Hg等);H2②还原性:O2SO2的化学性质小结__________________________________。
SO2的实验室制备__________________________________________。
工业制法_______________________________________________。
几种漂白剂的比较:思考:SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗?4.三氧化硫5.硫酸(1)物理性质:浓硫酸稀释:(2)浓硫酸特性:①吸水性:干燥剂思考:浓硫酸做干燥剂可以干燥的气体_______________________________________;不能用来干燥____________________________气体。
②脱水性:属化学变化③强氧化性:钝化;Cu;C;浓硫酸与铜反应的方程式及现象:浓硫酸与碳反应的方程式:碳和浓硫酸反应产物的验证实验各试剂的作用_________________________________________________。
11-2-氧和硫族元素

ቤተ መጻሕፍቲ ባይዱ性质
无色无味,非极性分子 ② 顺磁性 ③ 稳定 ④ 氧化性:常温 与还原剂反应, 高温时,与大多数元素反 应;用O2饱和的中性水是较好的氧化剂。 O2 + NO / Sn2 + / SO 2-/ I- → NO (红棕) / Sn4+/ SO 2-/ I 3 2 4 2
①
① 淡蓝色,鱼腥味气体 偶极距=0.53,极性共价键,极性分子 抗磁性 ④ 很不稳定,常温下2O3 → 3O2(MnO2催化,加热) ⑤ 强氧化性 φ°/H2O = 2.07V φ°/OH- = 1.24V O3 + NO→ NO2 O3 + I-+ H→ I2 + O2↑+ H2 O O3 + CN-→OCN- + O2↑ O3 + OCN- →O2↑ + N2↑ + CO2 3O3 + 2Ag→ Ag2 O2 + 2O2 O3 + XeO3 + 2H2 O = H4XeO6 + O2 ② ③
用途
动植物赖以生存 医疗急救:30mol/1LH2O 工业生产:氢氧焰,氧炔焰,炼钢 吹氧
① 杀菌、消毒剂 ② 确定烃不饱和双键的位置 CH3CH2CH=CH2 → CH3CH2CHO + HCHO CH3CH=CHCH3 → 2CH3CHO
① ② ③ ④ ⑤
制H2SO4 橡胶制品硫化剂(S2Cl2) SO4盐,SO3盐,硫化物 火柴、焰火原料 6 用于漂染、农药、医药
O3 + NO→ NO2 3O3 + 2Ag → Ag2O2 + 2O2 (过氧化银 ) O3 + XeO3 + 2H2O = H4XeO6 + O2 O3 +2 I-+ H+= I2 + O2+ H2O (测定O3 ) O3 + CN- →O2 + N2 + CO2
氧硫及其化合物

氧化物,它跟碱性氧
含硫化石燃料
金属矿物
脱硫
【特别提醒】
-
中学常见的四大还原性离子
- - +
2 还原性:S2 >SO2 3 >I >Fe
①易被空气中的O2氧化而变质。 ②易被KMnO4(H+)、HNO3、溴水、氯水、Fe3+(不氧化Fe2+)、漂 白粉溶液等氧化。 ③SO2、H2SO3、Na2SO3均有强还原性,且还原性:SO2 3 >H2SO3>SO2。 ④同理:H2S、S2-、HS-均有强还原性。
4.SO2 4 的检验
-
检验SO 2 4 的正确操作方法:被检液
-
加足量盐酸酸化 ――→ 取清液
滴加BaCl2溶液 - ――→ 有无白色沉淀(判断有无SO2 4 )
2 2 2 3 防止 CO 、 SO 、 Ag 、 SiO 、 PO 3 3 3 4 先加稀盐酸的目的是
- - + - -
离子的干扰
,再加BaCl2溶液,有白色沉淀产生,可能发生反应
常见的能用于漂白的物质的比较
四种常见的SO2尾气处理方法 方法一:钙基固硫法 为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃 烧时硫、生石灰、O2共同反应生成硫酸钙,从而使硫转移到煤渣 中,反应原理为CaO+SO2 △ △ ===== CaSO3,2CaSO3+O2 =====
△ 2CaSO4,总反应方程式为2CaO+2SO2+O2=====2CaSO4。
考点三 1.物理性质
硫酸及硫酸根离子的检验
98%的浓H2SO4是一种无色、黏稠的油状液体,密度远大于 水。浓H2SO4与水以任意比互溶,溶解时可放出大量的热,浓 H2SO4稀释的方法是:将 注入
水
浓H2SO4
氧硫及其化合物

一、硫及其重要化合物的主要性质及用途1、硫(1)物理性质:硫为 固体; 溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
硫在元素周期表中的位置硫原子结构示意图 硫离子结构示意图 (2)化学性质:硫原子最外层 个电子,较易 电子,表现较强的 。
①与金属反应(与变价金属反应,均把金属氧化成低价态,如Na 、Al 、Fe 、Cu ) (剧烈反应并发生爆炸)(制取Al 2S 3的唯一途径) (色)( 色)②与非金属反应(O 2、H 2)、 (说明硫化氢不稳定) ③与化合物的反应S + HNO 3(浓)= S + H 2SO 4(浓)= S + NaOH = (用热碱溶液清洗硫) (3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2、硫的氢化物①硫化氢——H 2S 是无色、有 气味的有毒气体; 溶于水,密度比空气略 。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时, (H 2S 过量) 当22/O S H n n ≤2/3时, (O 2过量) 当23222<<O SH n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、I 2、Fe 3+、HNO 3、浓H 2SO 4、KMnO 4等均可将H 2S 氧化。
C.不稳定性:300℃以上易受热分解③H2S的水溶液叫氢硫酸,是二元弱酸。
电离方程式氢硫酸在空气中放置变浑浊,方程式④实验室制法:化学方程式:FeS+2H+===Fe2++H2S↑(稀HCl 、稀H2SO4)不用浓硫酸、浓盐酸制H2S的原因浓H2SO4有强氧化性,能氧化H2S;浓盐酸有挥发性,使产生的H2S气体中混有HCl气体。
⑤不溶于水也不溶于稀酸的金属硫化物有CuS(黑)、Ag2S(黑)、PbS(黑)它们可溶于浓硝酸。
所以CuSO4、Pb(NO3)2可以与H2S反应生成沉淀:Pb(NO3)2+H2S===PbS↓+2HNO3。
高一氧硫及其化合物知识点

高一氧硫及其化合物知识点一、氧化还原反应氧硫化物是由氧和硫的化合物组成。
在这些化合物中,氧与硫的氧化态是随着元素的化合形式而变化的。
氧的氧化态通常为-2,但在氧硫化物中,其氧化态会发生变化。
氧化还原反应是指化学反应中,物质的氧化态发生改变的过程。
当氧化剂得到电子并接受电通的时候,其氧化态会发生增加,而还原剂则会失去电子,其氧化态会减少。
二、高一氧硫的性质与应用1. 氧气氧气在化学反应中是一种重要的氧化剂。
它能与其他元素或化合物反应,使其氧化。
同时,氧气也是生物体呼吸过程中的必需物质。
2. 二氧化硫二氧化硫是一种无色气体,有刺激性气味。
它是高一氧硫化合物中常见的一种,也是被广泛应用的化合物之一。
二氧化硫的主要应用领域包括:- 工业:二氧化硫是制造硫酸的重要原料,广泛用于生产纸张、塑料、农药等产品。
- 食品:二氧化硫是一种食品添加剂,常被用于保鲜果蔬,防止其变色和腐烂。
- 环境保护:作为一种污染物,二氧化硫对环境有害。
因此,在燃煤和工业废气处理中,需要对二氧化硫进行净化处理,以减少其对大气的污染。
3. 三氧化硫三氧化硫是一种无色晶体,在空气中不稳定,会与水和氧反应。
它的主要应用是制造硫酸。
三氧化硫的制备方法包括:硫在高温下与氧反应,通过催化剂促使这个反应快速进行。
4. 亚硫酸亚硫酸是一种无色气体,呈强酸性,有刺激性气味。
它在一些化学反应中起着重要的作用。
亚硫酸的主要应用包括:- 漂白:亚硫酸是一种常用的漂白剂,广泛用于纺织品、纸张等行业。
- 消毒:亚硫酸也可以用于消毒,如清洁和消毒水。
- 食品加工:亚硫酸是一种食品添加剂,可用于保鲜、防腐和抗氧化。
5. 硫酸硫酸是一种无色液体,具有强酸性。
它是一种重要的化学品,广泛应用于各种工业中。
硫酸的主要应用领域包括:- 化肥:硫酸是制造化肥的重要原料,如硫酸铵、硫酸钾等。
- 汽车电池:硫酸被用作蓄电池中的电解液。
- 腐蚀剂:硫酸在工业中也用作腐蚀剂,用于清洗金属表面。
氧族元素及其化合物

2Ag+2O3 →Ag2O2+2O2
氧族元素及其化合物
臭氧能迅速且定量地把I-氧化成I2,常利用该反应来测定O3的 含量,称之为碘量法。
臭氧具有强氧化性和不易导致二次污染的优点,因此常用作消毒杀 菌剂、空气净化剂和漂白剂等。在废气净化领域,可以利用臭氧氧化废 气中二氧化硫,并制得硫酸以回收利用;在废水处理领域,臭氧可氧化 废水中的有机物,通常与传统水处理技术进行组合,以满足废水深度净 化的要求。
在实验室里,可以将过氧化钠加到冷的稀硫酸或稀盐酸中来制备 H2O2:
Na2O2+H2SO4+10H2O →Na2SO4·10H2O+H2O2 工业上制备过氧化氢,目前主要有电解法和蒽醌法两种方法。
氧族元素及其化合物
三、 硫及其重要化合物 1. 单质硫
单质硫有几种同素异形体,最常见的是正交硫和单斜硫。当 加热到368.6 K时,正交硫不经熔化就转变成单斜硫,当把它冷 却时,就发生相反的转变过程,所以368.6 K是正交硫与单斜硫 之间的平衡转变点:
无机化学
氧族元素及其化合物
一、 氧族元素的通性
周期表第ⅥA族包括氧(O)、硫(S)、硒 (Se)、碲(Te)、钋(Po)五种元素,通称 为氧族元素。其中硒和碲是稀有元素,钋是放射 性元素,最重要的是氧和硫两种元素。有关氧族 元素的一些性质见表8-14。
氧族元素及其化合物
氧族元素及其化合物
氧族元素和卤素相似,随原子序数的增加,原子半径和离子半径增 大,而电负性和电离能则降低。由氧向钋过渡,元素的非金属性逐渐减 弱,金属性逐渐增强,氧和硫是典型的非金属,硒和碲是两性的准金属, 钋是金属。氧族元素的非金属活泼性弱于相应的卤族元素。
