第三章 溶液中配合物的稳定性
合集下载
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
配合物在溶液中的稳定性

(二)压力对配合物稳定性的影响
TI(Ⅰ)< TI(Ⅲ) 酒石酸根离子(L2-)配合物的lgK1值 强制构型:螯合剂的空间结构和金属离子的配位要求不相适应而产生较大的空间张力而降低络合物稳定性。
一般来说,中心离子半径小,空间位阻效应大。
Ca2+ <Sc2+ <Ti2+ <V2+ >Cr2+ >Mn2+ <Fe2+ <Co2+ <Ni2+ >Cu2+ >Zn2+
S结C构N相- 似 • 的N多配M齿位g配2+体在>空间C结a构2+允许>的S情r况2+下…, ….
一、中心离子对配合物稳定性的影响。
Li+ > Na+ > K+……. 配体的碱性大小可用加质子常数KH衡量碱性大小。 [Cd(en)2]2+ K稳=1. 1.螯合效应:在配位原子、配位数也一样的情况下,螯合物的结构比非螯合物稳定,也就是说螯环的形成使螯合物具有特殊的稳定性 。
。 Ca2+
<•Sc2+水<T和i2+ 金<V2属+ >C金r2+属>M离n2+子<F的e2+半<C径o2+大<N小i2+ 如>Cu下2+ >:Zn2+
• Li > Na > K ……. 强一制般构 5、型6:环螯稳合定+剂,的饱空和间5圆结环构+ 和饱金和属6+离圆子环的配位要求不相适应而产生较大的空间张力而降低络合物稳定性。
配合物稳定性3

配合物的氧化还原反应稳定性
两个配合物之间的氧化还原反应
• 两种机理 • 外层机理和内层机理
外界反应机理
[IrCl6]2- + [Fe(CN)6]4+ = [IrCl6]3- + [Fe(CN)6]3+
K = 4.1*105 L/mol˙s 属快速反应
Fe2+ ,Ir3+ d6组态,Fe3+ ,Ir4+ d5组态, 强场情况,取代反应惰性。 反应过程不可能有取代反应
内界反应机理
1)内界反应机理必备条件:
• A、两种反应物之一(通常是氧化剂)必须 带有桥连配体(具有两对以上孤对电子); • B、反应物之一(通常是还原剂)是取代反 应活性的。
2)基元步骤 (1)前身配合物的形成: Ox -X + Red –Y = Ox-X---Red + Y
(2)前身配合物的活化及电子转移: Ox-X---Red = -Ox---X-Red+ 电子转移机理: A、化学机理:桥基配体得到电子成为自由基 阴离子,随后电子再进入氧化剂的金属离子。 B、隧道机理:量子力学隧道效应。
外界反应机理
1)生成前驱配合物。
Ox + Red = Ox || Red (前驱配合物) 快反应 两种反应物相互接近达到一定平衡距离。 2) 前驱配合物的化学活化、电子转移及后继配合物的 形成。 Ox || Red = -Ox || Red+ 慢反应 化学活化:使两种反应物的内部结构(如M-L键 长)及中心原子的电子自旋状态相似,以便发生电子 转移,生成后继配合物。
** 判据:如果两个取代反应惰性的配合物, 它们之间电子转移速率较快,一般属外界机 理。
实验
• [Co(NH3)6]3+ + [Cr(H2O)6]2+
两个配合物之间的氧化还原反应
• 两种机理 • 外层机理和内层机理
外界反应机理
[IrCl6]2- + [Fe(CN)6]4+ = [IrCl6]3- + [Fe(CN)6]3+
K = 4.1*105 L/mol˙s 属快速反应
Fe2+ ,Ir3+ d6组态,Fe3+ ,Ir4+ d5组态, 强场情况,取代反应惰性。 反应过程不可能有取代反应
内界反应机理
1)内界反应机理必备条件:
• A、两种反应物之一(通常是氧化剂)必须 带有桥连配体(具有两对以上孤对电子); • B、反应物之一(通常是还原剂)是取代反 应活性的。
2)基元步骤 (1)前身配合物的形成: Ox -X + Red –Y = Ox-X---Red + Y
(2)前身配合物的活化及电子转移: Ox-X---Red = -Ox---X-Red+ 电子转移机理: A、化学机理:桥基配体得到电子成为自由基 阴离子,随后电子再进入氧化剂的金属离子。 B、隧道机理:量子力学隧道效应。
外界反应机理
1)生成前驱配合物。
Ox + Red = Ox || Red (前驱配合物) 快反应 两种反应物相互接近达到一定平衡距离。 2) 前驱配合物的化学活化、电子转移及后继配合物的 形成。 Ox || Red = -Ox || Red+ 慢反应 化学活化:使两种反应物的内部结构(如M-L键 长)及中心原子的电子自旋状态相似,以便发生电子 转移,生成后继配合物。
** 判据:如果两个取代反应惰性的配合物, 它们之间电子转移速率较快,一般属外界机 理。
实验
• [Co(NH3)6]3+ + [Cr(H2O)6]2+
配合物在溶液中的稳定性

第三章 配合物在溶液中的稳定性
第一节 稳定常数的表示方法
一、总稳定常数
M + nL = MLn
a[ML ] K n= a[M ] a [L] n [MLn] . f[ML ] K n= [Mn+][L]n f[M ] f [L] n
n n+ n n+
[MLn] K n= [Mn+][L]n
lgfi = 0.509Zi2√I
一、中心离子性质对配合物稳定性的影响
(一) 中心离子的电子结构 1、惰气型金属离子 碱金属: Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+ 及:Al3+、Sc3+、Y3+、La3+(镧系、锕系)
例 1 :对同一种配体(如二苯酰甲烷)形 成的配合物 稳定性:Li > Na > K > Rb > Cs Be > Mg > Ca > Sr > Ba 电荷相同的情况下,随半径增大,稳 定性变小 。
……………… …………
β= K1K2K3….Kn
大多数配合物形成体系的逐级稳定 常数是随配位数增加逐渐下降的。
原因: 1、统计效应; 2、立体障碍(只要配位水比水分子体积大, 这就是不可避免的); 3、静电效应(指配位体间的相互排斥)。
ML`N-nLn + L = ML`N-n-1Ln+1 + L`
正反应的速率(基元反应)为:kf[ML`N-n-Ln][L] kf∝(N-n) 正反应速率应为:k`f(N-n)[ML`N-n-Ln][L] 逆反应速率为:kb[ML`N-nkb∝(n+1) 1Ln+1][L`] k`b(n+1) [ML`N-n-1Ln+1][L`]
第一节 稳定常数的表示方法
一、总稳定常数
M + nL = MLn
a[ML ] K n= a[M ] a [L] n [MLn] . f[ML ] K n= [Mn+][L]n f[M ] f [L] n
n n+ n n+
[MLn] K n= [Mn+][L]n
lgfi = 0.509Zi2√I
一、中心离子性质对配合物稳定性的影响
(一) 中心离子的电子结构 1、惰气型金属离子 碱金属: Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+ 及:Al3+、Sc3+、Y3+、La3+(镧系、锕系)
例 1 :对同一种配体(如二苯酰甲烷)形 成的配合物 稳定性:Li > Na > K > Rb > Cs Be > Mg > Ca > Sr > Ba 电荷相同的情况下,随半径增大,稳 定性变小 。
……………… …………
β= K1K2K3….Kn
大多数配合物形成体系的逐级稳定 常数是随配位数增加逐渐下降的。
原因: 1、统计效应; 2、立体障碍(只要配位水比水分子体积大, 这就是不可避免的); 3、静电效应(指配位体间的相互排斥)。
ML`N-nLn + L = ML`N-n-1Ln+1 + L`
正反应的速率(基元反应)为:kf[ML`N-n-Ln][L] kf∝(N-n) 正反应速率应为:k`f(N-n)[ML`N-n-Ln][L] 逆反应速率为:kb[ML`N-nkb∝(n+1) 1Ln+1][L`] k`b(n+1) [ML`N-n-1Ln+1][L`]
第三章水环境化学水中无机污染物的迁移转化

32
胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
环境化学 2008_第三章 化学污染物的转化行为
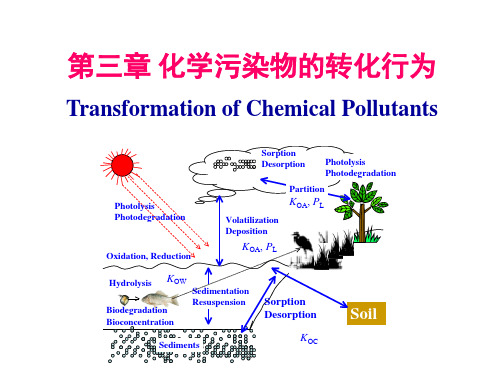
迁移:污染物在环境介质内部或环境介质之间的物理运动 (时间和空间)。不发生化学变化。 物理转化:相变、渗透、凝聚、吸附以及放射性元素蜕变等。 化学转化:光化学氧化、氧化还原和络合水解等作用。 生物化学转化:生物的吸收和代谢作用而发生的变化 。
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
高等有机化学第三章配合物在溶液中的稳定性

称为积
累稳定常数。
积累稳定常数的表示
M + L ML
M + 2L ML2
………..
M + nL MLn
ß 1=
[ML] [M][L]
ß 2=
[ML2] [M][L]2
ß n=
[MLn] [ML][L]n
我们可以得出第i级积累稳定常数ß i与逐级稳 定常数之间的关系: ß i=K1K2……Ki
S~C>I>Br>Cl>N>O>F
配离子的中心离子的性质、配体的性质以 Lewis酸碱分成硬的、交界的和软的酸碱。
硬碱中的价电子结合紧密(半径小),软碱中的价电子容易被极化(半径大)。
(4)(9-17)e-构型的金属 离子(d1-9)
(3)(18+2)e-构型的金属离子(d10s2)
及中心离子与配体之间的相互作用有关。 根据这种反应的实质,可以把路易斯酸称作电子接受体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。
上式中的K 、K ….K 称为配离子的逐级稳定 或者说,软酸、软碱之所以称为软,是形象地表明他们较易变形,硬酸、硬碱之所以称为硬,是形象地表明他们不易变形。
1 2 Lewis酸碱分成硬的、交界的和软的酸碱。
如,卤素离子(碱)对Al3+离子给电子能力为:
n
除去金属离子的性质外,配体的性质也直接影响配合物的稳定性。
n-1 n n 决定中心原子作为配合物形成体的能力的因素的主要有金属离子的电荷、半径及电子构型。
[ML ][L] ②含有价层未充满的原子的化合物,如BX3,AlX3;
n-1
显然,路易斯酸应该有空的价轨道,这种轨道可以是 轨道,也可以是 轨道。
(3)(18+2)e-构型的金属离子(d10s2)
累稳定常数。
积累稳定常数的表示
M + L ML
M + 2L ML2
………..
M + nL MLn
ß 1=
[ML] [M][L]
ß 2=
[ML2] [M][L]2
ß n=
[MLn] [ML][L]n
我们可以得出第i级积累稳定常数ß i与逐级稳 定常数之间的关系: ß i=K1K2……Ki
S~C>I>Br>Cl>N>O>F
配离子的中心离子的性质、配体的性质以 Lewis酸碱分成硬的、交界的和软的酸碱。
硬碱中的价电子结合紧密(半径小),软碱中的价电子容易被极化(半径大)。
(4)(9-17)e-构型的金属 离子(d1-9)
(3)(18+2)e-构型的金属离子(d10s2)
及中心离子与配体之间的相互作用有关。 根据这种反应的实质,可以把路易斯酸称作电子接受体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。
上式中的K 、K ….K 称为配离子的逐级稳定 或者说,软酸、软碱之所以称为软,是形象地表明他们较易变形,硬酸、硬碱之所以称为硬,是形象地表明他们不易变形。
1 2 Lewis酸碱分成硬的、交界的和软的酸碱。
如,卤素离子(碱)对Al3+离子给电子能力为:
n
除去金属离子的性质外,配体的性质也直接影响配合物的稳定性。
n-1 n n 决定中心原子作为配合物形成体的能力的因素的主要有金属离子的电荷、半径及电子构型。
[ML ][L] ②含有价层未充满的原子的化合物,如BX3,AlX3;
n-1
显然,路易斯酸应该有空的价轨道,这种轨道可以是 轨道,也可以是 轨道。
(3)(18+2)e-构型的金属离子(d10s2)
配合物在水溶液中的稳定性

[Ag(CN)2]- +
判断[Ag(NH3)2]+是否可能转化为[Ag(CN)2]-。
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
Cu2+ + 4NH3
[Cu(NH3)4]2+
平衡浓度/( mol/L) 1.0×10-3
x
1.0
已知[Cu(NH3)4]2+ 的= 2.09×1013
上页 下页 返回 帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
将上述各项代入累积稳定常数表示式:
K稳
[Cu(NH 3 ) 4 ] 2 [Cu 2 ][NH 3 ] 4
1.比较同类型配合物的稳定性 较高。但不同类型配合物的稳定性则不能仅用 K 比较。 稳
K 对于同类型配合物,稳定常数 稳 较大,其配合物稳定性
例1:比较下列两配合物的稳定性: [Ag(NH3)2]+ [Ag(CN)2]= 107.23 = 1018.74
由稳定常数可知[Ag(CN)2]-比[Ag(NH3)2]+稳定得多。
3.判断配离子与沉淀之间转化的可能性
配离子与沉淀之间的转化,主要取决与配离子的稳定性和 沉淀的溶解度。配离子和沉淀都是向着更稳定的方向转化。
【例3】
在1L[Cu(NH3)4]2+溶液中(c(Cu2+)为4.8×10-17mol/L), 加入0.001molNaOH,问有无Cu(OH)2沉淀生成? 若加入 0.001molNa2S,有无CuS沉淀生成? (设溶液体积基本不变)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规则在配合物稳定性中的应用
1)硬酸倾向于与硬碱结合;
2)软酸倾向于与软碱结合;
配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:
F>Cl>Br>I (1)
O>>S>Se>Te (2)
N>>P>As>Sb (3)
而与软酸中心离子形成配合物的倾向的顺序为:
F < Cl < Br < I (4)
O << S ~ Se ~ Te (5)
N << P > As > Sb (6)
对(6)的解释:
σ键增强
N << P > As > Sb
空d轨道:无3d 4d 5d
反馈π键减弱
π键作用大于σ键。
对于O << S ~ Se ~ Te (5),可作类似解释。
3、软硬酸碱规则应用实例
Mg2+ + NH3·H2O Mg(OH)2↓
Ag+ + NH3·H2O [Ag(NH3)2]+
五、其他因素对配合物稳定性的影响
1、温度的影响
对于放热的配位反应,T上升,K减小;
而对于吸热的配位反应,T上升,K增大。
2、压力的影响
压力变化很大时,不可忽略。
如:Fe3+ + Cl- == [FeCl]2+
压力由0.1atm增至2000atm时,K减小约20倍。
*研究海洋中配合物的平衡时要考虑压力的影响。
3、溶剂的影响
1)当溶剂有配位能力时,有如下竞争反应:
ML + S == MS + L
S配位能力越强,ML稳定性越差。
如[CoCl4]2-在下列溶剂中的稳定性顺序:。
