2020年领军高考化学一轮复习必刷好题专题14有关铝化合物反应的图象(含解析) (1)
2020-2021备战高考化学压轴题专题复习——铝及其化合物推断题的综合及答案解析

2020-2021备战高考化学压轴题专题复习——铝及其化合物推断题的综合及答案解析一、铝及其化合物1.工业上的许多反应工艺来源于实验室里的简单操作,比如用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如图:请回答下列问题:(1)写出铝土矿中加入NaOH溶液的反应方程式___。
(2)沉淀C的化学式___,颜色为___,写出它的一种用途___。
(3)操作I、操作II、操作III的名称为___,这个过程用到的玻璃仪器有烧杯、___。
(4)整个生产过程中,除可以循环使用的物质有___(写出3种,填化学式),用此法制取铝的副产品是___(写出2种,填化学式)。
(5)氧化铝熔点高,氯化铝熔点低,工业上为什么不用熔点较低的氯化铝而用熔点更高的氧化铝为原料电解制铝?___。
【答案】Al2O3+2NaOH═2NaAlO2+H2O Fe2O3红棕色作颜料(或炼铁)过滤漏斗、玻璃棒 NaOH、CaO、CO2 Fe2O3、O2氯化铝是共价化合物,在熔融状态下以分子形式存在,不能导电,不能用于电解。
氧化铝是离子化合物,熔融时能够电离而导电,因此电解铝用氧化铝而不用氯化铝【解析】【分析】铝土矿中含有氧化铝和氧化铁,向铝土矿中加入NaOH溶液,发生反应Al2O3+2OH-═2AlO2-+H2O,氧化铁不溶,然后过滤,得到溶液B为NaOH、NaAlO2混合溶液,沉淀C为Fe2O3;向溶液B中通入CO2,发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-、2OH-+CO2=CO32-+H2O,然后过滤得到沉淀Al(OH)3和Na2CO3溶液,向溶液中加入CaO,发生反应Na2CO3+CaO+H2O═2NaOH+CaCO3↓,然后过滤,将NaOH循环利用;将Al(OH)3加热得到Al2O3,电解熔融Al2O3得到Al,据此分析解答。
【详解】(1)根据上面的分析,铝土矿中加入NaOH溶液,氧化铝与氢氧化钠反应生成偏铝酸钠,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O;(2)根据上述分析,沉淀C为Fe2O3,氧化铁为红棕色粉末,俗称铁红,除了用于金属冶炼以外,还可用作顔料,故答案为:Fe2O3;红棕色、作颜料(或炼铁);(3)实现固体和液体的分离采用过滤法,操作Ⅰ、操作Ⅱ和操作Ⅲ都是过滤操作,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,故答案为:过滤;漏斗、玻璃棒;(4)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用,溶液E中的氢氧化钠也能循环利用;根据流程图和上述分析,操作Ⅰ所得的Fe2O3和电解熔融Al2O3得到的O2为副产品,故答案为:NaOH、CaO和CO2;Fe2O3和O2;(5)氯化铝是共价化合物,在熔融状态下以分子形式存在,不能导电,不能用于电解。
【高考复习】高考化学一轮复习铝及铝的化合物同步检测(附答案)

【高考复习】高考化学一轮复习铝及铝的化合物同步检测(附答案)铝粉和铝箔在空气中加热能猛烈燃烧,并发出眩目的白色火焰。
以下是铝及铝的化合物同步检测,希望考生可以在做题时发现自己的问题。
1.化学与科学、技术、社会、环境密切相关。
下列说法不正确的是()A.常温下浓硝酸与铝发生钝化,可用铝制容器存放浓硝酸B.向MgCl2、AlCl3溶液中分别加入过量的氨水来比较镁、铝的金属性强弱C.铝合金的大量使用归功于人们能使用电解法从氧化铝中获得铝D.明矾在水中能形成Al(OH)3胶体,可用作净水剂解析:选B 向MgCl2、AlCl3溶液中分别加入过量氨水,均生成氢氧化物沉淀,不能比较出Mg(OH)2、Al(OH)3的碱性强弱,故不能比较Mg、Al的金属性强弱。
2.(2021西安模拟)下列反应的离子方程式书写正确的是()A.向氯化铝溶液中加入过量氨水:Al3++4NH3H2O===AlO+4NH+2H2OB.向浓烧碱溶液中加入铝片:Al+2OH-===AlO+H2C.用浓NaOH溶液溶解Al2O3:2OH-+Al2O3===2AlO+H2OD.向碳酸镁中滴加稀盐酸:CO+2H+===CO2+H2O解析:选C 向氯化铝溶液中加入过量氨水生成Al(OH)3而不是AlO,A错误;B项得失电子不守恒,应为:2Al+2OH-+2H2O===2AlO+3H2D项MgCO3难溶于水,不能拆写成Mg2+和CO的形式。
3.(2021山东高考)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是()A.氢氧化钠溶液B.稀硫酸C.盐酸D.稀硝酸解析:选A 本题考查金属铝的性质,意在考查考生运用元素化合物知识的能力。
根据关系式:2Al~2NaOH,2Al~3H2SO4,2Al~6HCl,A项正确,B、C项错误;Al与稀硝酸反应不产生氢气,D项错误。
4.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。
2020年高考化学一轮复习讲练测专题3.2铝及其重要化合物(讲)含解析

D .铝制品表面镀有一层铜,可以保护铝
【答案】 C
【解析】铝尽管很活泼,但由于表面能形成致密的氧化物薄膜,故可用作铝制炊具。
【方法技巧】铝与酸或碱反应生成 2Al + 6HCl===2AlCl 3+ 3H2↑
H2 的量的关系
2Al + 2NaOH + 6H2O===2Na[Al(OH) 4] + 3H2↑
其净水的原理是 Al 3++ 3H2O
Al(OH) 3(胶体 )+ 3H+ ,Al(OH) 3 胶体吸附水中的杂质形成沉淀而净水。
【方法拓展】数形结合与 “铝三角 ”
1. Al 3+、 Al(OH) 3、 [Al(OH) 4] -之间的转化关系
(1) ①Al 3+ +3NH 3·H2O===Al(OH)
4] -。
③ 2Al(OH)
△ 3=====
Al 2O3+ 3H2 O。
(3) 制备 ①向铝盐中加入氨水,离子方程式为
Al 3++ 3NH 3·H2O ===Al(OH)
3↓+
3NH
+
4
。
② Na[Al(OH) 4]溶液中通入足量 CO 2,离子方程式为
[Al(OH)
4] -+ CO 2===Al(OH)
高温 3MnO 2+ 4Al===== 3Mn +2Al 2O3; ②金属焊接,如野外焊接钢轨等
5.铝的制备和用途 (1) 制备原理
电解 电解熔融 Al 2O3: 2Al 2 O3(熔融 )===== 4Al + 3O2↑。
【特别提醒】工业上冶炼 Al 用电解熔融 Al 2O3 而不用 AlCl 3 的原因是 AlCl 3是共价化合物,熔融态不导电。 (2) 铝的用途 纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。 【方法技巧】对比记忆镁的化学性质
2020届高三高考化学一轮复习小题狂练《铝及其化合物》含答案及详细解析

绝密★启用前2020届高三高考化学一轮复习小题狂练《铝及其化合物》1.有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为()A. 1∶2B. 2∶1C. 1∶1D. 2∶32.向100 mL 1.0 mol•L﹣1的AlCl3溶液中逐滴加入0.5 mol•L﹣1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是()A..B..C..D..3.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl﹣与之比为()A. 2∶3B. 1∶3C. 3∶2D. 2∶14.某溶液中含MgCl2和AlCl3各0.01 mol,向其中逐滴加入1 mol·L-1的NaOH溶液至过量,下列关系图正确的是()A.B.C.D.5.Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成。
现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH 溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是()A.⑤③①B.②③④C.③⑤④D.③②①6.在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的()A. Ba(OH)2溶液B. NaOH溶液C.氨水D.硫酸7.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。
关于该物质的说法正确的是()A.该物质属于两性氢氧化物B.该物质是Al(OH)3和Na2CO3的混合物C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H+D.该药剂不适合于胃溃疡患者服用8.下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是()A. AlCl3B. Al(OH)3C. Al2(SO4)3D. NaAlO29.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述不正确的是()A.试剂X可以是氢氧化钠溶液B.反应①过滤后所得沉淀为氧化铁C.图中所示转化反应包含氧化还原反应D.反应②的化学方程式为2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO310.有一块镁铝合金,其中镁与铝的质量比是8∶9。
高三化学一轮复习镁铝知识点及练习题词(有答案)
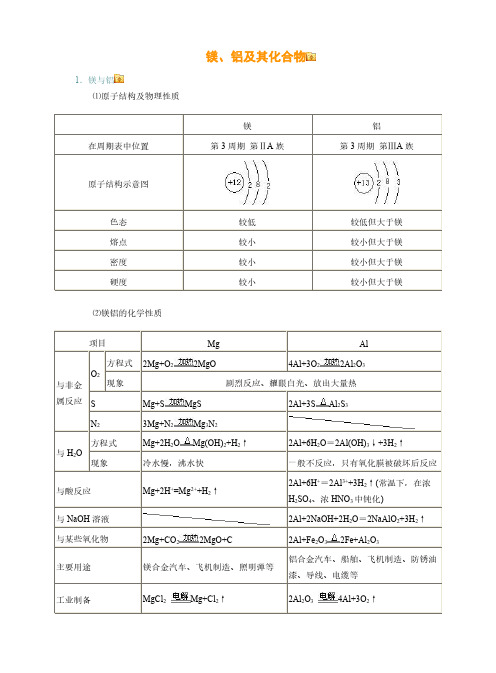
镁、铝及其化合物1.镁与铝⑴原子结构及物理性质镁铝在周期表中位置第3周期第ⅡA 族第3周期第ⅢA 族原子结构示意图色态较低较低但大于镁熔点较小较小但大于镁密度较小较小但大于镁硬度较小较小但大于镁⑵镁铝的化学性质项目Mg Al 与非金属反应O 2方程式2Mg+O 22MgO4Al+3O 22Al 2O 3现象剧烈反应、耀眼白光、放出大量热SMg+S MgS 2Al+3SAl 2S 3N 23Mg+N 2Mg 3N 2与H 2O方程式Mg+2H 2OMg(OH)2+H 2↑2Al+6H 2O =2Al(OH)3↓+3H 2↑现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应与酸反应Mg+2H +=Mg 2++H 2↑2Al+6H +=2Al 3++3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)与NaOH 溶液2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑与某些氧化物2Mg+CO 22MgO+C 2Al+Fe 2O 32Fe+Al 2O 3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl 2Mg+Cl 2↑2Al 2O 34Al+3O 2↑2.镁和铝氧化物的对比氧化物MgO Al 2O 3属类碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H 2OMgO+H 2O =Mg(OH)2↓(反应缓慢进行)不溶解也不反应酸液MgO+2H +=Mg 2++H 2OAl 2O 3+6H +=2Al 3++3H 2O NaOH 溶液不溶解也不反应Al 2O 3+2NaOH =2NaAlO 2+H 2O 重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3属类碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2Mg 2++2OH-H 2O+AlO 2-+H +Al(OH)3Al 3++3OH-与HCl 等酸溶液Mg(OH)2+2HCl=MgCl 2+2H 2O (可溶于NH 4Cl 等强酸弱碱盐)Al(OH)3+3HCl =AlCl 3+3H 2O 与NaOH 溶液不反应Al(OH)3+NaOH=NaAlO 2+2H 2O 热不稳定性Mg(OH)2MgO+H 2O2Al(OH)3Al 2O 3+3H 2O实验室制法可溶性镁盐加NaOH 溶液Mg 2++2OH -=Mg(OH)2↓可溶性铝盐加氨水Al 3++3NH 3·H 2O =Al(OH)3↓+3NH +44.铝及其化合物间相互转化、铝三角及相关图象实验操作实验现象图象离子方程式①向可溶性铝盐溶液中滴加NaOH 溶液至过量先生成沉淀又溶解Al 3++3OH -=Al(OH)3↓;Al(OH)3+OH -=AlO 2-+2H 2O②向可溶性铝盐溶液中滴加稀氨水至过量出现白色沉淀Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+③向NaOH 溶液中滴加可溶性铝盐溶液至过量开始无明显变化,一段时间后出现沉淀Al 3++4OH -=AlO 2-+2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H ++AlO 2-+H 2O =Al(OH)3↓;Al(OH)3+3H +=Al 3++3H 2O⑤向可溶性偏铝酸盐溶液中逐渐通入CO 2气体至过量先无明显变化,后出现沉淀AlO -2+2H 2O+CO 2(过量)=Al(OH)3↓+HCO -32AlO 2-+3H 2O+CO 2(少量)=Al(OH)3↓+CO 2-3⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量出现白色沉淀4H ++AlO 2-=Al 3++2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓知识拓展:⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。
与铝有关的反应图像分析

与铝有关的图像分析一、向AlCl 3溶液中滴加NaOH 溶液 O ~A 段:()Al OH Al OH 333+-+=↓A ~B 段:()Al OH OH AlO H O 3222+=+--从图1不难看出,向氯化铝溶液中滴加氢氧化钠溶液,若达不到最大沉淀量时,对应的氢氧化钠溶液的体积有两种情况:一是氯化铝过量即加入的氢氧化钠不足;二是加入的氢氧化钠将生成的氢氧化铝溶解了一部分。
图1二、向强碱溶液中滴入铝盐溶液:先无沉淀,当Al 3+全部转化为AlO 2-时,再加入铝盐溶液,则偏铝酸盐与铝盐溶液发生了相互促进水解的反应,产物都是()Al OH 3。
如图3所示:图3发生反应的离子方程式为: O ~A 段:Al OH AlO H O 32242+--+=+A ~B 段:()AlAlO H O Al OH 3223364+-++=↓三、向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液(I )向铝盐中滴加氨水时,当氨水增加到()()n Aln NH H O 33213+=:·:时,产生最大沉淀量如图4所示。
图4(II )向氨水中滴加铝盐溶液时,开始时氨水过量,如图5所示,离子反应方程式为:()3332334NH H O Al Al OH NH ·+=↓+++图5由图4与图5不难看出,氢氧化铝沉淀是不溶于弱碱氨水中的。
四、向偏铝酸盐溶液中滴入强酸当()()n AlO n H 211-+=::时,产生最大沉淀量,继续滴入强酸,沉淀逐渐溶解。
如图6所示。
图6五、向盐酸中滴加偏铝酸盐溶液滴入的偏铝酸钠先与盐酸反应生成()Al OH 3沉淀,继而马上被盐酸溶解,反应方程式为:42232H AlO Al H O +-++=+继续滴加的NaAlO 2则与Al3+发生水解反应,离子方程式为:()Al AlO H O Al OH3223364+-++=↓沉淀量的变化可用图7表示。
图7六、向NaAlO2溶液中通入CO2由于产生的()Al OH3沉淀不溶解在碳酸中,产生的沉淀不消失,如图8所示。
铝及其化合物的反应图像课件

3.往NaAlO2溶液中逐滴加入HCl至过量
(1) O→A AlO2 - +H2O+H+===Al(OH)3↓
A→B Al(OH)3+3H+===Al3++3H2O。 (2)现象:开始出现白色沉淀⇒白色沉淀又全部溶解。 (3)图象
高考总复习·化学
4.往盐酸中逐滴加入NaAlO2溶液至过量
(1) O→A AlO2 - +4H+===Al3++2H2O Al3++3 AlO2 - +6H2O===4Al(OH)3↓
1.(2010年南通一模)(双选)用坩埚钳夹住一小块刚用酸充 分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并 不滴落,下列关于上述实验现象的解释正确的是 ( ) A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜 C.氧化铝的熔点比铝的熔点高 D.用酸处理时未能将氧化铝溶解 解析:铝在空气中表面很快形成氧化膜,由于氧化铝的 熔点很高,包裹住铝,所以铝熔化时不会滴落下来。 答案:BC
解析:因Mg、Al与HNO3、浓H2SO4反应不生成H2,故排 除B、D;因NaOH溶液只能与Al反应,不与Mg反应,所以生 成的气体少。 答案:A
6.向含有1 mol明矾的溶液中逐滴入Ba(OH)2溶液,充分 反应,下列说法不正确的是 ( )
A.当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol
(1) O→A Al3++3OH-===Al(OH)3↓
A→B
Al(OH)3+OH-=== AlO2 - +2H2O。
(2)现象:开始产生白色沉淀并逐渐增多⇒白色沉淀开始 溶解⇒白色沉淀全部溶解。 (3)图象
高考总复习·化学
2.往NaOH溶液中逐滴加入AlCl3溶液至过量
3Al3++12OH-=== 3AlO - (1) O→A Al3++4OH-=== AlO2 - +2H2O +6H2O A→B Al3++3 AlO2 - +6H2O===4Al(OH)3↓。 (2)现象:开始无现象⇒出现白色沉淀,且沉淀不溶解。 (3)图象
2020-2021备战高考化学压轴题专题复习—铝及其化合物推断题的综合含答案解析

2020-2021备战高考化学压轴题专题复习—铝及其化合物推断题的综合含答案解析一、铝及其化合物1.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的化学式:A_____________、B___________、C______________、F_____________、 H____________、乙______________(2)写出下列反应化学方程式:反应①_________________________________________________反应⑤_________________________________________________反应⑥_________________________________________________【答案】Na Al Fe FeCl2 Fe(OH)3 Cl2 2Na + 2H2O=2NaOH + H2↑ 2FeCl2 + Cl2=2FeCl3 FeCl3+ 3NaOH =Fe(OH)3↓+ 3NaCl【解析】【分析】【详解】金属单质A的焰色为黄色,则A为Na;反应①为Na与水反应生成NaOH和H2,则物质D 为NaOH,气体为H2;金属B与NaOH反应生成H2,则金属B为Al;黄绿色气体为Cl2,反应②为H2与Cl2化合成HCl,则气体丙为HCl,物质E为盐酸;金属C与盐酸反应生成F,F 与Cl2反应生成物质G,G与NaOH反应得红棕色沉淀,则金属C为Fe,F为FeCl2,G为FeCl3;(1)A、B、C、F、H、乙的化学式依次为Na、Al、Fe、FeCl2、Fe(OH)3、Cl2。
(2)反应①的化学方程式为2Na+2H2O=2NaOH+H2↑;反应⑤的化学方程式为Cl2+2FeCl2=2FeCl3;反应⑥的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题14 有关铝化合物反应的图象1.某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀关系如图,则下列说法正确的是( )A.横坐标为0-50mL时,所有反应为:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓B.B点生成沉淀的总物质的量0.02molC.若往C点的溶液中加入足量盐酸,沉淀将全部溶解D.H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:2:2:1【答案】C【解析】A. 横坐标为0-50mL时,所有反应为:0-10mL时,H++OH-= H2O;10-50mL时,Mg2++2OH-=Mg(OH)2↓ 、Al3++3OH-=Al(OH)3↓,A项错误;B. B点生成沉淀为Mg(OH)2、Al(OH)3的总物质的量为n[Al(OH)3]+ n[Mg (OH)2]=0.001mol+0.0005mol=0.0015mol,B项错误;C. 若往C点的溶液中加入足量盐酸,Mg(OH)2+2HCl=MgCl2+2H2O、NaAlO2+4HCl=NaCl+AlCl3+2H2O,将全部溶解,C项正确;D. 经计算,溶液中H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:0.001mol:0.0005mol:0.001mol,即2:1:2,D项错误。
2.将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为()A.B.C.D.【答案】C【解析】混合液中通入CO2,依次发生反应为:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+2NaOH=Na2CO3+H2O、CO2+3H2O+2NaAlO2=2Al(OH)3↓+Na2CO3、CO2+H2O+Na2CO3=2NaHCO3,CaCO3+CO2+H2O=Ca(HCO3)2,则图象中开始就有碳酸钙沉淀生成,之后沉淀的量不变,氢氧化钠完全反应后开始生成氢氧化铝沉淀,此段沉淀的量又增大;当偏铝酸钠完全反应后,Na2CO3、CaCO3分别与二氧化碳反应,由以上分析可知,满足该变化的图象为C。
3.已知Ba(AlO2)2可溶于水。
图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是 ( )A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多B.c—d时溶液中离子的物质的量:AlO2–比Ba2+多C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3D.d—e时溶液中离子的物质的量:Ba2+不能等于OH–【答案】B【解析】A.在a-b发生反应A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,由方程式可知,沉淀的物质的量:Al(OH)3<BaSO4,故A错误;B.c-d发生反应2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O,1molBa(AlO2)电离出2molAlO2-、1molBa2+,故AlO2-比Ba2+多,故B正确;C.a-b发生A12(SO4)3+3Ba(OH)2=2Al(OH)2↓+3BaSO4↓,由方程式可知,沉淀的物质的量:Al(OH)3<BaSO4,b~d中Al(OH)3沉淀逐渐溶解转化3为Ba(AlO2)2,故a-d时沉淀的物质的量:BaSO4大于A1(OH)3,故C错误;D.d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,当加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等,故D错误。
4.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。
①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。
则下列说法正确的是()A.溶液中的阳离子只有H+、Mg2+、Al3+B.溶液中n(NH4+)=0.2molC.溶液中可能含CO32-、SO42-、NO3-D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1【答案】B【解析】A项、溶液中的阳离子有H+、Mg2+、Al3+、NH4+,故A错误;B项、第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol,故B正确;C项、溶液中一定不含CO32-、NO3-、Fe3+,故C错误;D项、溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误。
5.现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为()A.1:3 B.1:6 C.2:3 D.3:2【答案】C【解析】由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg (OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH 溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,所以2n[Mg(OH)2]+3×0.1mol=0.4mol,故n[Mg(OH)2]=0.05mol,根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=2×0.05mol=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)=32n[Al(OH)3]=32×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3。
6.向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。
则下列离子组在对应的溶液中一定能大量共存的是A.a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-B.b点对应的溶液中:Na+、S2-、SO42-、Cl-C.c点对应的溶液中:K+、Ag+、Ca2+、NO3-D.d点对应的溶液中:K+、NH4+、CO32-、SO42-【答案】B【解析】A.a点溶液显碱性,NaOH过量,则不可能存在HCO3-,不能共存,A项错误;B.b点恰好生成偏铝酸钠,溶液显碱性,Na+、ClO-、SO42-、Cl-不反应,能大量存在,B项正确;C.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,还生成氯化钠,则不可能存在Ag+,不能共存,C项错误;D.d点为氯化铝溶液,氢氧根离子与铵根离子反应,不能大量共存,D项错误。
7.向体积为2 L、物质的量浓度均为1mol/L的NH3·H2O、Ba(OH)2、KAlO2的混合溶液中缓缓地通入CO2至过量,则下列说法正确的是()A.整个过程中通入的CO2(x轴)与生成沉淀(y轴)的关系如图所示B.当沉淀达到最大值时,至少通入标准状况下的CO2的体积为89.6LC.缓缓通入CO2与KAlO2反应时的离子方程式为:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-D.沉淀刚达到最大值时,溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH-)>c(NH4+)>c(H+)【答案】D【解析】A项、整个过程中,依据碱性强弱顺序可知,反应顺序为Ba(OH)2、KAlO2、NH3·H2O,图像与实际反应不符,故A错误;B项、当沉淀达到最大值时,2mol Ba(OH)2完全转化为Ba CO3沉淀,消耗2mol二氧化碳;2mol KAlO2完全转化为Al(OH)3,消耗1mol二氧化碳,故当沉淀达到最大值时通入二氧化碳的物质的量为3mol,标准状况下的CO2的体积为6.72 L,故B错误;C项、缓缓通入CO2与KAlO2反应时,反应生成氢氧化铝沉淀和碳酸钾,反应的离子方程式为2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故C错误;D项、沉淀刚达到最大值时,溶液中溶质K2CO3和NH3·H2O的物质的量比为1:2,溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH-)>c(NH4+)>c(H+),故D正确。
8.如图是向MgCl2、AlCl3混合溶液中,开始滴加7mL试剂A,之后改滴试剂B,所得沉淀y(mol)与试剂体积V(mL)间的关系.以下结论不正确的是()A.A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1B.原混合液中,c(Al3+)︰c(Mg2+)︰c(Cl-)=1︰1︰5C.A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=1︰2D.从6到9,相应离子反应式H+ + OH-===H2O【答案】C【解析】A.根据加入前6mL试剂时,先有沉淀生成而后溶解,所以试剂A是NaOH,则B是盐酸;又由图可知,5→6(1 mL)、9→11(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH 和HCl。
根据铝元素守恒:NaOH ~ Al(OH)3 ~ AlO2- ~ H+1 1 1 10.001L•c(NaOH)0.002L•c(HCl)由此可以推出:c(NaOH):c(HCl)=2:1,故A正确;B. 从加入5 mL A生成沉淀最多,再继续加1 mL A沉淀量减少到最小值,相应反应的离子方程式为:Al(OH)+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3) mol;由前5 mL NaOH形成最大沉3淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol,溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中C(Al3+):C(Mg2+):C(Cl-)=1:1:5,故B 正确;C.由A项分析可知,A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1,故C错误;D. 从6到7是氢氧化钠过量,不发生反应。
从7到9沉淀的物质的量不变,则发生的反应为氢氧化钠与盐酸的反应,反应的离子方程式为H++OH-=H2O。
