气体摩尔体积
气体摩尔体积

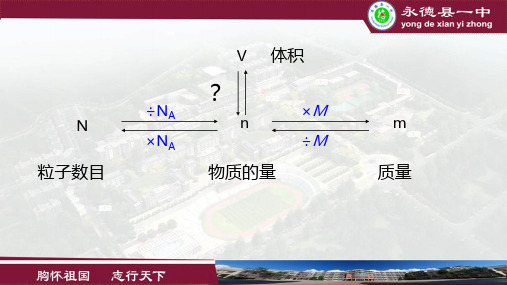
二、影响物质体积大小的因素
①微粒数目 ②微粒大小 ③微粒间距
固体、液体:紧密排列 ∴微粒大小>>微粒间距 ∴固体、液体体积主要取决于微粒大小 和微粒数目 ∴1mol固体、液体体积一般不相同
气体: 微粒间距>>微粒大小 微粒间距取决于 ——温度和压强 ∴气体体积主要取决于温度、压强和微 粒数目 ∴1mol气体在相同的温度和压强下,体 积相同
三、阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气 体都含有相同数目的分子。 推论1:在同温同压下,气体的体积正比于气 体的物质的量 推论2:在同温同压下,不同气体的体积比等 于它们的物质的量之比
1、相对密度(两种气体的密度之比)
ρ1 D= ρ2
ρ1 M 1 = ρ2 M2
2、混合气体平均式量(平均摩尔质量) (平均ቤተ መጻሕፍቲ ባይዱ对分子质量,平均分子量)
总质量 M= 总物质的量
M = M A × a % + M B × b% + ......
【练习】
1、空气的成分为:N2 78%,O2 21%,稀有 气体0.94%(全部看作成分最多的氩— 40),CO2 0.03%,水蒸气0.03%。 求(1)空气的平均式量,(2)150g空气 中含氧气的质量。 2、计算25℃、101kPa条件下,3L氧气和9L 甲烷组成的混合气体的平均式量。
第二节 气体摩尔体积
Molar Volume of Gas
计算1mol下列物质在0℃,1个标准大气 压下的体积:
①铁 ρ=7.8g/cm3 ②铝 ρ=2.7g/cm3 ③ 铅ρ=11.3g/cm3 ④水 ⑤ 纯硫酸ρ=1.81g/cm3 ⑥ 纯酒精 ρ=0.789g/cm3 ⑦ 氢气 ρ=0.0893g/L ⑧ 氧气 ρ=1.429g/L ⑨二氧化碳 ρ=1.97g/L
标况下气体摩尔体积公式

标况下气体摩尔体积公式
标况下气体摩尔体积公式是描述气体在标准状态下的摩尔体积的公式。
在标准状态下,气体的压力为1 atm,温度为273.15 K,摩尔体积为22.4 L/mol。
该公式为:
V = Vm × n
其中,V为气体的体积,Vm为气体的摩尔体积,n为气体的摩尔数。
摩尔体积是指一个摩尔物质所占据的体积。
在标准状态下,气体摩尔体积为22.4L/mol。
因此,在标准状态下,1摩尔气体的体积为22.4升,2摩尔气体的体积为44.8升,以此类推。
该公式在气体化学、热力学和工业生产等领域有广泛应用,可帮助计算和预测气体在标准状态下的行为和性质。
- 1 -。
气体摩尔体积

判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA(╳ ) 3、常温常压,1molHe含有的原子数为NA ( √ ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( √ )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
的原子数相同( ╳
)
) ) )
2. 1molCO2占有的体积约是22.4L( 3. 标况下, 1molH2O的体积约是22.4L( 4. CO在标况下占有的体积约是22.4L(
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
5. 1molCO2和1molSO2所占有的体积相同,
所含的分子个数也相同(
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ╳ 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA( ) 3、常温常压,1molHe含有的原子数为NA ( ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
标准状况下气体摩尔体积

标准状况下气体摩尔体积
首先,我们来看一下标准状况下气体摩尔体积的计算方法。
根
据理想气体状态方程PV=nRT,我们可以推导出气体摩尔体积的计算
公式为V_m=V/n,其中V表示气体的体积,n表示气体的摩尔数。
在
标准状况下,V_m=V/n=22.4L/mol。
这个数值是在标准状况下所有理
想气体的摩尔体积都是相同的,不受气体种类的影响。
其次,标准状况下气体摩尔体积的应用。
标准状况下气体摩尔
体积是化学计算中非常重要的一个物理量。
通过摩尔体积,我们可
以方便地计算气体的体积、摩尔数等相关物理量。
比如,当我们知
道气体的摩尔体积和摩尔数时,就可以很容易地计算出气体的体积;反之,如果我们知道气体的体积和摩尔体积,也可以计算出气体的
摩尔数。
这对于化学实验和工业生产中的气体的使用和生产都具有
重要的意义。
另外,标准状况下气体摩尔体积还可以帮助我们理解气体的性质。
根据理想气体状态方程,我们知道在标准状况下,1摩尔的任
何理想气体的体积都是22.4升。
这说明在相同的温度和压强下,不
同种类的气体所占的体积是相同的,这就揭示了气体的摩尔体积与
气体种类无关的特点。
这个特点也是理想气体状态方程成立的基础
之一。
总之,标准状况下气体摩尔体积是描述气体性质的重要物理量,它的计算方法简单清晰,应用范围广泛。
通过摩尔体积,我们可以
方便地计算气体的体积、摩尔数等相关物理量,也可以帮助我们理
解气体的性质。
因此,对于化学学习和实践中,标准状况下气体摩
尔体积的理解和运用都具有重要的意义。
化学气体摩尔体积知识点

化学气体摩尔体积知识点化学气体摩尔体积是指在一定的温度和压力下,气体的摩尔体积与气体的摩尔数之间的关系。
摩尔体积是指单位摩尔气体所占据的体积,通常用升或立方米表示。
在理想气体状态方程中,PV = nRT,其中P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R是理想气体常数,T表示气体的温度。
根据这个方程,我们可以推导出气体的摩尔体积的计算公式。
我们需要知道气体的摩尔质量。
摩尔质量是指1摩尔气体的质量,在化学中常用g/mol表示。
例如,氧气的摩尔质量是32g/mol,氮气的摩尔质量是28g/mol。
我们需要知道气体的密度。
密度是指单位体积内的质量,常用g/L 或kg/m³表示。
通过知道气体的摩尔质量和密度,我们可以计算出气体的摩尔体积。
计算公式如下:摩尔体积 = 密度 / 摩尔质量举个例子来说明。
假设我们知道氧气的密度是1.43 g/L,摩尔质量是32 g/mol。
那么,我们可以计算出氧气的摩尔体积:摩尔体积 = 1.43 g/L / 32 g/mol = 0.0447 L/mol这意味着在给定的条件下,1摩尔的氧气占据0.0447升的体积。
需要注意的是,摩尔体积受温度和压力的影响。
根据理想气体状态方程,当温度或压力发生变化时,摩尔体积也会相应改变。
在实际应用中,我们常常需要根据实验条件来计算气体的摩尔体积。
需要注意的是,摩尔体积只适用于理想气体。
理想气体是指在一定温度和压力下,气体分子间无相互作用力,体积可以忽略的气体。
在实际情况中,气体分子间会存在相互作用力,摩尔体积的计算会受到影响。
对于非理想气体,摩尔体积的计算需要考虑更多的因素。
总结起来,化学气体摩尔体积是指在一定条件下,单位摩尔气体所占据的体积。
通过摩尔质量和密度的关系,可以计算出气体的摩尔体积。
然而,摩尔体积受温度和压力影响,只适用于理想气体。
对于非理想气体,需要考虑更多的因素。
了解气体的摩尔体积有助于我们在化学实验和工业生产中的气体计量和控制。
气体摩尔体积

气体摩尔体积一、气体摩尔体积1. 定义:单位物质的量的气体所占的体积2. 符号:V m3. 常用单位:L/mol4. 影响物质体积的因素从微观来看有:(1)粒子个数;(2)粒子本身的大小;(3)粒子间距离。
① 固体和液体的体积:粒子大小② 气体的体积:粒子间距离(但在同温同压下,气体粒子间的距离相等)5. 标准状况下气体摩尔体积标准状况( STP ):0℃、1.01×105Pa在标准状况下任何气体的摩尔体积都约是22.4L/mol在应用气体摩尔体积时应注意以下2个问题:1、四要素:标准状况下、1mol 、任何气体、体积约为22.4L2、适用对象:(1)气体;(2)该气体可以是单一的,也可以是混合气体。
二、n 与 V m 的关系m V V n =三、阿伏加德罗定律1. 定律:在同温同压下,相同体积的任何气体含有相同的分子数。
(且在同温同压下,气体体积的大小只与分子数的多少有关;而分子间距离相等)2. 阿伏伽德罗定律的重要推论根据理想气体状态方程:PV=nRT① 同温同压下,气体的物质的量与其体积成正比:T ,P 相同,2121V V n n = ② 温度,体积相同的气体,压强与其物质的量成正比:T ,V 相同,2121n n p p =1:下列说法中正确的是 ( )A. 1mol O 2和1molN 2所占的体积约为22.4LB. H 2的气体摩尔体积约为22.4LC. 在标准状况下,1molH2和1molH 2O 所占的体积都约为22.4LD. 在标准状况下,22.4L 由N 2、N 2O 组成的混合气体中所含有的N 的物 质的量约为2mol2:将H 2、O 2、N 2三种气体分别装在三个相同容器里,当温度和密度相同时,三种气体压强的大小关系正确的是( )A. )()()(222N p O p H p ==B. )()()(222O p N p H p >>C. )()()(222H p N p O p >>D. )()()(222N p H p O p >>3:在一个密闭容器中盛有11gX 气体(X 的摩尔质量为44g/mol )时,压强为1×104Pa 。
气体摩尔体积

1mol任何气体所占的体积都约是22.4L的理解 (1)标准状况:指0℃、1.01×10^5Pa的状态。温度越高,体积越大;压强越大,体积越小。故在非标准 状况下,其值不一定就是“22.4L”.。但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4升。 (2)1mol气体在非标准状况下,其体积可能为22.4L,也可能不为22.4L。如在室温(20℃,一个大气压)的情况下气体的体积是24L。 (3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离。在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下气体摩尔体积都约是22.4L/mol. (4)此概念应注意:①气态物质;②物质的量为1mol;③气体状态为0℃和1.01×10^5Pa(标准状况);④22.4L体积是近似值;⑤Vm的单位为L/mol和m^3/mol。 (5)适用对象:纯净气体与混合气体均可。 本节是历届高考的热点,对于气体摩尔体积的概念及阿伏加德罗定律、推论的多方位多角度考查,注意相关计算、换算。题型以选择题为主。
物质的体积与组成物质粒子的关系
(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外]。②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。 (2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小。 (3)决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小。 (4)影响气体分子间平均距离大小的因素:温度和压强。温度越高,体积越大;压强越大,体积越小。当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值,故粒子数一定时,其体积是一定值。
气体摩尔体积
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
爆炸现场
2020/12/2
5
爆炸为什么会产生如此大的威力? 爆炸: 有限空间内气体体积急剧膨胀
2020/12/2
6
黑火药 4g
气体 280 L
体积膨胀十几万倍 黑火药爆炸发生反应:
? 2KNO3+ S+3C == K2S + N2 ↑+3CO2 ↑ 固体炸药 体积急剧膨胀 气体
原因:气体微粒间距离大于固体
2020/12/2
10
填写下表:
物质
状 态
1mol物质 粒子数
1mol物 质质量 (g)
体积
密度 (g/cm3)
(20。C)
(cm3)
Fe 固 6.02x1023 56 7.8
7.2
Al 固 6.02x1023 27 2.7
10
Pb 固 6.02x1023 207 11.3 18.3
H2O 液 6.02x1023 18 1(4oC) 18
气体物质
2020/12/2
27
2020/12/2
气体分子间距离很大
28
思考:1mol气体在任何状况下所占的 体积是不是相等?是不是都约为22 .4L?
一定质量气体体积的决定因素:
1、压强
2、温度
2020/12/2
29
影响气体体积的主要因素
影响粒子间距离的因素
温度和压强
温度升高,气体分子之间的 距离增大,气体的体积增大
是否等于22.4L?
2020/12/2
34
2020/12/2
35
1.判断下列说法是否正确?
A. 标准状况下,1 molH2O的体积 B. 约为22.4L。 B. 1 mol气体的体积约为22.4L。
2020/12/2
31
当温度、压强相同时,不同气体分子间的 平均距离几乎相同
则 标准状况时1mol任何气体的体积大约相同, 都约是22.4L
6.02x1023
个分子
0.282m
22.4L (标准状况)
标准状况时的气体摩尔体积示意图
2020/12/2
32
结论:标准状况下1mol 任何气体,所占的体积都约为 22.4L。
28.2cm
约22.4L
注: (1)条件:标准状况,即0℃,101KPa (2)描述对象:1mol任何气体(单一气体或混合气体) (3)结论:体积约是22.4L
2020/12/2
33
2、气体摩尔体积 (1)在标况下,1 mol任何气体所占体积都
约为 22.4L
(2)在相同T、P下,不同气体其Vm相同
20
填写下表: 0。C,101.325kPa(即1个标准大气压)
物质
H2
状 态
1mol物质 粒子数
1mol 物质质 量 (g)
密度(标 准状况
(g/L)
体积 (标准状况) (L )
气 体
6.02x1023 2.016
0.0899
22.4
O2
气 体
6.02x1023 32.00
1.429
CO2 2020/12/2
压强增大,气体分子之间的 距离增大,气体的体积增大
2020/12/2
30
气体摩尔体积
❖概念:单位物质的量气体所占的体积。
❖符号为Vm
❖公式: Vm=
V n
❖常用单位有L/mol(L·mol-1)和m3/mol。
22.4L
(标准状况)
在标准状况下,气体的摩尔体积 为22.4L/mol
在标准状况下,22.4mL任何气体 中都含有6.02×1023个分子
2020/12/2
7
约1700倍
18.0ml
3.06×104ml
100
100℃H2O(g)
50
1mol
1mol H2O(l)
2020/12/2
8
4℃1 molH2O ( 18 mL)
100℃1 mol H2O (g) (3.06×104 mL) (体积扩大1700倍)
2020/12/2
9
1mol的几种物质
2020/12/2
1
约旦首都安曼风光
2020/12/2
2
精品资料
• 你怎么称呼老师? • 如果老师最后没有总结一节课的重点的难点,你
是否会认为老师的教学方法需要改进? • 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭 • “不怕太阳晒,也不怕那风雨狂,只怕先生骂我
笨,没有学问无颜见爹娘 ……” • “太阳当空照,花儿对我笑,小鸟说早早早……”
H2SO4 (纯) 2020/12/2
液 6.02x1023
98
1.83
53.6 11
7.2cm3
6.02×1023 个原子 56克
1mol铁
2020/12/2
固体物质
18.3cm3
10cm3
6.02×1023 个原子 27克
6.02×1023 个原子 207 克
1mol铝
1mol铅
12
液体物质
气 体
6.02x1023 44.01
1.977
22.4 22.321
结论:
对于气体物质来说, 1mol不同气体的体积大约相同
标准状况时都约是22.4L
2020/12/2
22
§3-2 同条件1mol固态、
气 体 摩
液态物质所具有的体 积各不相同 而同条件1mol气态 物质的体积都相同
尔 你能否结合宏观实
18.0cm3
53.6cm3
6.02×1023 个分子
18克
2020/12/2
1mol水
6.02×1023 个分子 98克
1mol硫酸
13
结论:
对于固体物质或液态物质来说, 1mol不同物质的体积是不同的
2020/12/2
14
➢ [阅读课文并讨论] ➢ [启发] 决定物质体积大小的因素有哪些呢? ➢ [回答] 决定物质体积大小的因素有三个:
①物质的粒子数目; ②粒子的大小; ③粒子之间的距离; ➢[效果显示] 决定物质体积大小演示
2020/12/2
15
固体物质
2020/12/2
16
液体物质
2020/12/2
17
构成固态结构微粒间的距离很小
2020/12/2
构成液态结构微粒间的距离也小
18
➢ [] ➢ [] ➢ [] 决定物质体积大小的因素有三个:
①物质的粒子数目; ②粒子的大小;
③粒子之间的距离;
➢[小结] 固体、液体物质粒子间间隔很小,在
微粒数目相同的情况下,固体、液体
的体积主要由粒子本身大小决定。
2020/12/2
19
§3-2
气
同条件1mol固态、 液态物质所具有的体
体 积各不相同
摩 尔
而同条件1mol气态 物质的体积又如何?
体
积
2020/12/2
体 积2020/12/2
例,从微观角度解 释其原因?
23
2020/12/2
24
气体
约4nm
说明:相同粒子数目的气体主要决定于气 体分子间的平均距离,与气体种类无关。
2020/12/2
25
气体
约4nm
说明:相同粒子数目的气体主要决定于气 体分子间的平均距离,与气体种类无关。
2020/12/2
26
