物理化学第五版上册复习题及答案
物理化学第五版上册复习题及答案

第二章热力学第一定律一、选择题1、下列叙述中不具状态函数特征的是:()(A)系统状态确定后,状态函数的值也确定(B)系统变化时,状态函数的改变值只由系统的初终态决定(C)经循环过程,状态函数的值不变(D)状态函数均有加和性2、下列叙述中,不具可逆过程特征的是:()(A)过程的每一步都接近平衡态,故进行得无限缓慢(B)沿原途径反向进行时,每一小步系统与环境均能复原(C)过程的初态与终态必定相同(D)过程中,若做功则做最大功,若耗功则耗最小功3、如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭体系的是:()(A)绝热箱中所有物质(B)两个铜电极(C)蓄电池和铜电极(D) CuSO4水溶液5、在下列关于焓的描述中,正确的是()(A)因为ΔH=QP,所以焓是恒压热(B)气体的焓只是温度的函数(C)气体在节流膨胀中,它的焓不改变(D)因为ΔH=ΔU+Δ(PV),所以任何过程都有ΔH>0的结论6、在标准压力下,1mol石墨与氧气反应生成1mol二氧化碳的反应热为Δr H ,下列哪种说法是错误的? ()(A) ΔH 是CO2(g)的标准生成热(B) ΔH =ΔU(C) ΔH 是石墨的燃烧热(D) ΔU <ΔH7、在标准状态下,反应C2H5OH(l)+3O2(g) →2CO2(g)+3H2O(g)的反应焓为Δr H mθ, ΔC p>0, 下列说法中正确的是()(A)Δr H mθ是C2H5OH(l)的标准摩尔燃烧焓(B)Δr H mθ〈0(C)Δr H mθ=ΔrUmθ(D)Δr H mθ不随温度变化而变化8、下面关于标准摩尔生成焓的描述中,不正确的是()(A)生成反应中的单质必须是稳定的相态单质(B)稳态单质的标准摩尔生成焓被定为零(C)生成反应的温度必须是298.15K(D)生成反应中各物质所达到的压力必须是100KPa9、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B)Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 010、非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=011、下列表示式中正确的是( )(A)恒压过程ΔH=ΔU+pΔV (B)恒压过程ΔH=0(C)恒压过程ΔH=ΔU+VΔp (D)恒容过程ΔH=012、理想气体等温反抗恒外压膨胀,则( )(A)Q>W (B)Q<W (C)Q=W (D)Q=△U13、当理想气体其温度由298K升高到348K,经(1)绝热过程和(2)等压过程,则两过程的()(A)△H1>△H2W1<W2(B)△H1<△H2 W1>W2(C)△H1=△H2 W1<W2(D)△H1=△H2 W1>W214、当理想气体从298K,2×105Pa 经历(1)绝热可逆膨胀和(2)等温可逆膨胀到1×105Pa时,则( )(A)△H1<△H2 W1>W2(B)△H1>△H2 W1<W2(C)△H1<△H2 W1<W2(D)△H1>△H2 W1>W215、对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条(B) 二条(C) 三条(D) 三条以上16、实际气体绝热恒外压膨胀时,其温度将:( )(A) 升高(B) 降低(C) 不变(D) 不确定17、功的计算公式为W=nC v,m(T2-T1),下列过程中不能用此式的是()(A)理想气体的可逆绝热过程(B)理想气体的绝热恒外压过程(C)实际气体的绝热过程(D)凝聚系统的绝热过程18、凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是:( )(A) ΔU> 0 , ΔH > 0 (B) ΔU= 0 , ΔH = 0(C) ΔU< 0 , ΔH < 0 (D) ΔU= 0 , ΔH大于、小于或等于零不确定19、一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A) H1> H2 (B) H1= H2 (C) H1< H2 (D) H1>=H220、将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()(A)ΔT=0 (B)Δp=0 (C)ΔU=0 (D)ΔH=021、刚性绝热箱内发生一化学反应,则反应体系为( )(A)孤立体系(B)敞开体系(C)封闭体系(D)绝热体系22、理想气体可逆绝热膨胀,则下列说法中正确的是( )(A)焓总是不变(B)内能总是增加(C)焓总是增加(D)内能总是减少23、关于等压摩尔热容和等容摩尔热容,下面的说法中不正确的是( )(A)C p,m与C v,m不相等,因等压过程比等容过程系统多作体积功(B)C p,m–C v,m=R既适用于理想气体体系,也适用于实际气体体系(C)C v,m=3/2R适用于单原子理想气体混合物(D)在可逆相变中C p,m和C v,m都为无限大24、下列哪个过程的dT≠0,dH=0?( )(A)理想气体等压过程(B)实际气体等压过程(C)理想气体等容过程(D)实际气体节流膨胀过程25、隔离系统内发生一变化过程,则系统的:(A)热力学能守恒,焓守恒(B)热力学能不一定守恒,焓守恒(C)热力学能守恒,焓不一定守恒(D)热力学能、焓均不一定守恒二、判断题1、体系在某过程中向环境放热,则体系的内能减少。
天津大学《物理化学》第五版-习题及解答

及。
要确定 ,只需对第二步应用绝热状态方程
因此
,对双原子气体
由于理想气体的 U 和 H 只是温度的函数,
整个过程由于第二步为绝热,计算热是方便的。而第一步为恒温可逆
12 / 144
2.24 求证在理想气体 p-V 图上任 一点处,绝热可逆线的斜率的绝对值大于恒温可逆线的绝 对值。
证明:根据理想气体绝热方程,
T
及过程的
。
解:过程图示如下
显然,在过程中 A 为恒压,而 B 为恒容,因此
11 / 144
同上题,先求功 同样,由于汽缸绝热,根据热力学第一定律
2.23 5 mol 双原子气体从始态 300 K,200 kPa,先恒温可逆膨胀到压力为 50 kPa,在绝热可
逆压缩到末态压力 200 kPa。求末态温度 T 及整个过程的 解:过程图示如下
及。 解:先确定系统的始、末态
对于途径 b,其功为
根据热力学第一定律
2.6 4 mol 的某理想气体,温度升高 20 C°,求 解:根据焓的定义
的值。
2.10 2 mol 某理想气体,
。由始态 100 kPa, 50 dm 3,先恒容加热使压力体积
增大到 150 dm 3,再恒压冷却使体积缩小至 25 dm 3。求整个过程的
此
假设气体可看作理想气体,
,则
8 / 144
2.16 水煤气发生炉出口的水煤气的温度是
1100 °C,其中 CO(g)和 H2(g)的摩尔分数均为
0.5。若每小时有 300 kg 的水煤气由 1100 °C 冷却到 100 °C,并用所收回的热来加热水,是
水温由 25 °C 升高到 75 °C。求每小时生产热水的质 量。 CO(g)和 H2(g)的摩尔定压热容
物理化学第五版复习题答案

物理化学第五版复习题答案1. 请解释什么是热力学第一定律,并给出其数学表达式。
答案:热力学第一定律,也称为能量守恒定律,指出能量不能被创造或消灭,只能从一种形式转换为另一种形式。
在封闭系统中,系统的内能变化等于系统吸收的热量与对外做功的代数和。
数学表达式为:\(\Delta U = Q - W\),其中\(\Delta U\)表示内能的变化,\(Q\)表示系统吸收的热量,\(W\)表示系统对外做的功。
2. 描述理想气体状态方程,并解释其各参数代表的意义。
答案:理想气体状态方程为\(PV = nRT\),其中\(P\)代表气体的压力,\(V\)代表气体的体积,\(n\)代表气体的摩尔数,\(R\)是理想气体常数,\(T\)代表气体的绝对温度。
该方程描述了理想气体在一定条件下压力、体积、温度和摩尔数之间的关系。
3. 什么是化学平衡?请举例说明。
答案:化学平衡是指在一个可逆反应中,正反应速率和逆反应速率相等的状态,此时反应物和生成物的浓度不再随时间变化。
例如,氮气和氢气合成氨的反应:\(N_2 + 3H_2 \rightleftharpoons 2NH_3\),在一定条件下,当生成氨的速率与氨分解回氮气和氢气的速率相等时,系统达到化学平衡。
4. 简述熵的概念及其物理意义。
答案:熵是一个热力学函数,用于描述系统的无序程度。
在统计力学中,熵与系统微观状态的数目有关,微观状态数目越多,系统的熵就越大。
物理意义上,熵的增加表示系统从有序状态向无序状态的自发转变,这是自然界普遍存在的现象。
5. 什么是电化学电池?请说明其工作原理。
答案:电化学电池是一种将化学能直接转化为电能的装置。
其工作原理基于氧化还原反应,其中一个电极上发生氧化反应,另一个电极上发生还原反应,电子通过外部电路从氧化电极流向还原电极,从而产生电流。
例如,常见的铅酸电池就是通过铅和二氧化铅之间的氧化还原反应来产生电能。
6. 描述表面张力的概念及其对液体性质的影响。
物理化学期末复习(第五版上)

9. 对任意均相封闭系统,下面的偏微分小于零的是哪一个?( )
H A. T p ;
B.
G p
T
;
A C. V T ;
S D. T p
答案
答案
10.
克拉佩隆-克劳修斯方程
d
ln p dT
vap Hm RT 2
对于下述情况适用的是(
):
A. 水在 25℃、101.325 kPa 下在空气中的蒸发; B. 水在其沸点时的液-气平衡; C. 水在其冰点时的固-液相平衡; D. 水在三相点处的三相平衡
答案
1
1
7.在 298K 时,对于反应 2 H2 (g)+ 2 Cl2 (g)=HCl(g) 的 r Hm 为-92.5 kJ mol-1 ,则此
时反应的 rU m ( )
A.等于 r Hm B.小于 r Hm C.大于 r Hm D.无法判断
答案Βιβλιοθήκη 8.对于节流膨胀过程,下列表述中正确的有( ) A.节流膨胀过程中,系统的焓值不变 B.节流膨胀是绝热可逆过程 C.节流膨胀中系统的热力学能不变 D.节流膨胀中多孔塞两侧压力分别保持恒定
第二章
第一组
1.热力学第一定律表达式为: U Q W ,其只适用于( ) A.单纯的 pVT 变化 B.相变化 C.化学变化 D.封闭系统的任何变化
2.( )组成的封闭系统的热力学能和焓仅仅是温度的函数。 A.理想溶液 B.所有气体 C.稀溶液 D.理想气体
答案
答案
3 公式 dHm Cp,mdT 的适用条件应该是( ) A.等压过程 B.恒外压过程 C.无相变、无化学变化的恒压变温过程 D.组成不变的均相系统的恒压过程
答案
9.对于非理想气体进行绝热自由膨胀时,下述表达式中不正确的是( )
[物理化学(上册)完整习题答案解析]第五版高等教育出版社
![[物理化学(上册)完整习题答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/ef45d9fe240c844769eaee4b.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:11TT p V pV V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T T VV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p VV pnRT V p p nRT V pV V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p摩尔数为 133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H Cn/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
《物理化学(第五版)》第九章复习题答案
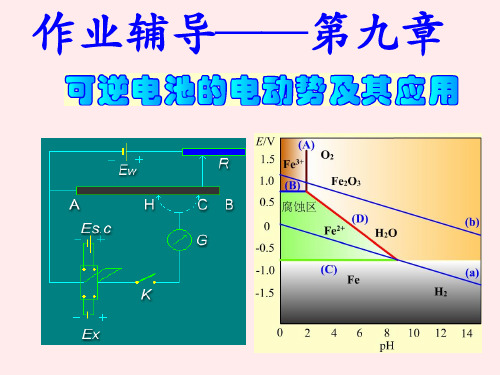
复习题
(1).H2O(1)的标准摩尔生成Gibbs自由能ΔfGmΘ (H2O,1); 电池:Pt|H2(pH2) | H+或OH-(aq) | O2(pO2)|Pt 净反应:H2(pΘ) + 1/2O2(pΘ) = H2O(l)
ΔfGmΘ (H2O,1)=-zEΘF
(2).H2O(1)的离子积常数KΘ; 电池:Pt|H2(pH2)|H+(aH+)||OH-(aOH-)|H2(pH2)|Pt 净反应:H2O(l) ⇔ H+(aH+) + OH-(aOH-)
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
RT m RT m E j= t -t ln = 2t -1 ln F m' F m'
E=E c+E j=
F
m ln m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
t t- RT m1 E j= - ln m2 z z- F
基本公式
用可逆电池的测定值计算热力学函数变化
值
r Gm zFE , r Gm zFE
RT E ln K a zF r Gm E r S m ( ) p zF ( ) p T T E QR T r Sm zFT ( ) p T
《物理化学(第五版)》第十一章复习题答案
复习题11
对于复杂反应,如果有一步放出很多热, 大于决速步的活化能,或激发态分子发生 反应,生成处于基态的生成物,表观上活 化能是负值,所以有负温度系数效应,反 应温度升高,速率反而下降。这种反应不 多,一般与NO氧化反应有关。
复习题12
12.某温度时,有一气相一级反应 A(g)→2B(g)+C(g),在恒温、恒容条件下进 行。设反应开始时,各物质的浓度分别为 a,b,c,气体总压力为p0,经t时间及当A完全 分解时的总压力分别为pt和p∞,试推证该分 解反应的速率常数为
t3 4
a
3 4
a
1 2
a12
k 2 1
3 ka
复习题5
t1 2
a
1 2
a
13
a13
k 3 1
3 2ka 2
t3 4
a
3 4
a
13
a13
k 3 1
15 2ka 2
所以,对a=b的二级反应,t3/4 =3 t1/2。同 理,对a=b=c的三级反应t3/4 =5t1/2。
复习题6
零级反应不可能是基元反应,因为没有零分 子反应。一般是由于总反应机理中的决速步 与反应物的浓度无关,所以对反应物呈现零 级反应的特点。零级反应一般出现在表面催 化反应中,决速步是被吸附分子在表面上发 生反应,与反应物的浓度无关,反应物通常 总是过量的。
复习题2
基元反应一定具有简单反应级数,但具有 简单级数的反应不一定是基元反应,如 H复2杂(g)反+I应2(g。)=2HI(g)是二级反应,但是一个
1 2
d
P
dt
k2
A
B
2
r2
1 2
d A
物理化学上册第五版天津大学出版社第二章 热力学第一定律习题答案

物理化学上册第五版天津大学出版社第二章 热力学第一定律习题答案2-1 1mol 理想气体于恒定压力下升温1℃,试求过程中气体与环境交换的功W 。
解:J T nR nRT nRT pV pV V V p W am b 314.8)(121212-=∆-=+-=+-=--=2-2 1mol 水蒸气(H 2O ,g )在100℃,101.325 kPa 下全部凝结成液态水。
求过程的功。
解: )(g l am b V V p W --=≈kJ RT p nRT p V p gam b 102.315.3733145.8)/(=⨯===2-3 在25℃及恒定压力下,电解1mol 水(H 2O ,l ),求过程的体积功。
)(21)()(222g O g H l O H +=解:1mol 水(H 2O ,l )完全电解为1mol H 2(g )和0.50 mol O 2(g ),即气体混合物的总的物质的量为1.50 mol ,则有)()(2l O H g am b V V p W --=≈)/(p nRT p V p g am b -=-kJ nRT 718.315.2983145.850.1-=⨯⨯-=-= 2-4 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,W a = -4.157kJ ;而途径b 的Q b = -0.692kJ 。
求W b 。
解:因两条途径的始末态相同,故有△U a =△U b ,则 b b a a W Q W Q +=+所以有,kJ Q W Q W b a a b 387.1692.0157.4078.2-=+-=-+=2-5 始态为25℃,200kPa 的5 mol 某理想气体,经a ,b 两不同途径到达相同的末态。
途径a 先经绝热膨胀到 – 28.57℃,100kPa ,步骤的功W a = - 5.57kJ ;在恒容加热到压力200 kPa 的末态,步骤的热Q a = 25.42kJ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章热力学第一定律一、选择题1、下列叙述中不具状态函数特征的是:()(A)系统状态确定后,状态函数的值也确定(B)系统变化时,状态函数的改变值只由系统的初终态决定(C)经循环过程,状态函数的值不变(D)状态函数均有加和性2、下列叙述中,不具可逆过程特征的是:()(A)过程的每一步都接近平衡态,故进行得无限缓慢(B)沿原途径反向进行时,每一小步系统与环境均能复原(C)过程的初态与终态必定相同(D)过程中,若做功则做最大功,若耗功则耗最小功3、如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭体系的是:()(A)绝热箱中所有物质(B)两个铜电极(C)蓄电池和铜电极(D) CuSO4水溶液5、在下列关于焓的描述中,正确的是()(A)因为ΔH=QP,所以焓是恒压热(B)气体的焓只是温度的函数(C)气体在节流膨胀中,它的焓不改变(D)因为ΔH=ΔU+Δ(PV),所以任何过程都有ΔH>0的结论6、在标准压力下,1mol石墨与氧气反应生成1mol二氧化碳的反应热为Δr H ,下列哪种说法是错误的? ()(A) ΔH 是CO2(g)的标准生成热(B) ΔH =ΔU(C) ΔH 是石墨的燃烧热(D) ΔU <ΔH7、在标准状态下,反应C2H5OH(l)+3O2(g) →2CO2(g)+3H2O(g)的反应焓为Δr H mθ, ΔC p>0, 下列说法中正确的是()(A)Δr H mθ是C2H5OH(l)的标准摩尔燃烧焓(B)Δr H mθ〈0(C)Δr H mθ=ΔrUmθ(D)Δr H mθ不随温度变化而变化8、下面关于标准摩尔生成焓的描述中,不正确的是()(A)生成反应中的单质必须是稳定的相态单质(B)稳态单质的标准摩尔生成焓被定为零(C)生成反应的温度必须是298.15K(D)生成反应中各物质所达到的压力必须是100KPa9、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B)Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 010、非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=011、下列表示式中正确的是( )(A)恒压过程ΔH=ΔU+pΔV (B)恒压过程ΔH=0(C)恒压过程ΔH=ΔU+VΔp (D)恒容过程ΔH=012、理想气体等温反抗恒外压膨胀,则( )(A)Q>W (B)Q<W (C)Q=W (D)Q=△U13、当理想气体其温度由298K升高到348K,经(1)绝热过程和(2)等压过程,则两过程的()(A)△H1>△H2W1<W2(B)△H1<△H2W1>W2(C)△H1=△H2W1<W2(D)△H1=△H2 W1>W214、当理想气体从298K,2×105Pa 经历(1)绝热可逆膨胀和(2)等温可逆膨胀到1×105Pa时,则( )(A)△H1<△H2W1>W2(B)△H1>△H2 W1<W2(C)△H1<△H2W1<W2(D)△H1>△H2 W1>W215、对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条(B) 二条(C) 三条(D) 三条以上16、实际气体绝热恒外压膨胀时,其温度将:( )(A) 升高(B) 降低(C) 不变(D) 不确定17、功的计算公式为W=nC v,m(T2-T1),下列过程中不能用此式的是()(A)理想气体的可逆绝热过程(B)理想气体的绝热恒外压过程(C)实际气体的绝热过程(D)凝聚系统的绝热过程18、凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是:( )(A) ΔU> 0 , ΔH > 0 (B) ΔU= 0 , ΔH = 0(C) ΔU< 0 , ΔH < 0 (D) ΔU= 0 , ΔH大于、小于或等于零不确定19、一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A) H1> H2 (B) H1= H2 (C) H1< H2 (D) H1>=H220、将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()(A)ΔT=0 (B)Δp=0 (C)ΔU=0 (D)ΔH=021、刚性绝热箱内发生一化学反应,则反应体系为( )(A)孤立体系(B)敞开体系(C)封闭体系(D)绝热体系22、理想气体可逆绝热膨胀,则下列说法中正确的是( )(A)焓总是不变(B)内能总是增加(C)焓总是增加(D)内能总是减少23、关于等压摩尔热容和等容摩尔热容,下面的说法中不正确的是( )(A)C p,m与C v,m不相等,因等压过程比等容过程系统多作体积功(B)C p,m–C v,m=R既适用于理想气体体系,也适用于实际气体体系(C)C v,m=3/2R适用于单原子理想气体混合物(D)在可逆相变中C p,m和C v,m都为无限大24、下列哪个过程的dT≠0,dH=0?( )(A)理想气体等压过程(B)实际气体等压过程(C)理想气体等容过程(D)实际气体节流膨胀过程25、隔离系统内发生一变化过程,则系统的:(A)热力学能守恒,焓守恒(B)热力学能不一定守恒,焓守恒(C)热力学能守恒,焓不一定守恒(D)热力学能、焓均不一定守恒二、判断题1、体系在某过程中向环境放热,则体系的内能减少。
错2恒温过程的Q一定是零。
()3、经历任意一个循环过程时,系统从环境吸收的热等于系统对外所做的功()对4尽管Q和W都是途径函数,但(Q+W)的数值与途径无关。
()5、由于热力学能是状态函数,则理想气体的状态改变时,其热力学能一定跟着改变()错6、封闭体系经历一个不作其它功的等压过程,其热量只决定于体系的初终态()对7在绝热、密闭、坚固的容器中发生化学反应,△U一定为零,△H 不一定为零。
()8不可逆过程就是过程发生后,系统不能再复原的过程。
()9、因△H = Q p所以只有等压过程才有△H。
()10、理想气体,不管是恒压过程,还是恒容过程,公式⎰=∆dTCHp 都适用。
()三、计算题1、0.01m3氧气由273K,1MPa经过(1)绝热可逆膨胀(2)对抗外压p=0.1MPa做绝热不可逆膨胀,气体最后压力均为0.1MPa,求两种情况所做的功。
(氧气的C p,m=29.36J·K-1·mol-1)2、10mol的理想气体分别经过下述(a)和(b)两个过程,在673K从1.8×10-3m3等温膨胀到2.4×10-3m3,试计算其膨胀功W及体系所吸收的热Q。
(a)可逆恒温膨胀;(b)对抗外压为2.026×105Pa的等温膨胀。
3、在298.2K,101325Pa时有0.5molZn与过量稀硫酸反应,生成氢气和硫酸锌,已知此反应放热为7.155×104J,试计算:(1)上述过程中Q,W,ΔU,ΔH 的值;(2)若上述反应在密闭容器中发生,求Q,W,ΔH,ΔU的值。
4、将1kg水过冷到-5℃,在101.325kPa下,加入极少量的冰屑.使过冷水迅速结冰,并使冰与水的混合物的温度迅速升至冰点,冰的熔化热为333.5J·g-1,0℃至-5℃水的比热为4.238J·K-1,求结出冰的质量。
5、已知水在100℃时的蒸发热为2259.36J·g-1,则在100℃时蒸发30g 水,系统的Q,W,ΔH,为多少?6、将1mol单原子理想气体,在1.013×105Pa下从298K加热到373K,再恒温可逆膨胀至体积增加一倍,最后绝热可逆膨胀至温度为308K,求全过程的W,Q,ΔU,ΔH。
7、1molO 2由0.1MPa ,300K 恒压加热到1000K ,求过程的Q 、W 、△U 及△H 。
已知:C p,m (O 2)=(31.64+3.39×10-3T-3.77×10-5T 2)J·K -1·mol -18、1mol 单原子分子理想气体B ,由300K , 100.0kPa 经一可逆过程到达终态,压力为200.0kPa ,过程的Q =1000.0J , ΔH=2078.5J (1)计算终态的温度、体积及过程的W , ΔU 。
(2)假设气体先经等压可逆过程,然后经等温可逆过程到达终态,此过程的Q,W,ΔU,ΔH 是多少?9、298K 时,1molCO 与0.5mol 的O 2按下式反应CO+1/2O 2==CO 2,生成1mol 的CO 2,已知:CO 2的C p.m =38.49J·K·mol -1; Δf H m ø(CO 2,298K)=-393.5kJ·mol -1; Δf H m ø(CO ,298K)=-110.45kJ·mol -1。
求 (1)298K 时,Δr U m ø,Δr H m ø,Q ,W ;(2)若在绝热恒容反应器中进行,求终态最高温度T 2。
10、计算298 K 下,CO(g)和CH 3OH(g)的标准生成焓,并计算反应CO(g)+2H 2(g)=CH 3OH(g)的标准焓变。
已知如下燃烧焓数据: (1)Δc H m (298 K)(CH 3OH(g))=-763.9 kJ·mol -1 (2)Δc H m (298 K)(C(s))=-393.5 kJ·mol -1 (3)Δc H m (298 K)(H 2(g))=-285.8 kJ·mol -1 (4)Δc H m (298 K)(CO(g))=-283.0 kJ·mol -1第二章热力学第一定律一、选择题二、判断题三、计算题1、解:(1)绝热可逆膨胀γ=C p/C V=1.39T2=143Kn=4.41 molQ=0W=-ΔU=-nC V,m(T2-T1)=12070J(2)绝热不可逆膨胀nC V,m(T2-T1)=-p外(V2-V1)=-p2R(T2/p2-T1/p1)T2=203.5KW=-ΔU=-nC V,m(T2-T1)=6452J2、解:(a)∵理想气体dT=0 可逆过程ΔU=Q-W=0∴ Q=-WW=nRTln(p1/p2) =nRTln(V2/V1)=16kJ(b)∵dT=0 ΔU=0 ∴ Q=WW=p(V 2-V 1)=1.2kJ 3、解:(1)等压过程 Δp=0 ΔH=Q p =-7.155×104J W=pΔV=1239.5J ΔU=Q -W=-7.28×104J (2)等容过程 ΔV=0 W=0 ΔU=-7.28×104J Q V =ΔU=-7.28×104J ΔH=-7.155×104J4、解:−−→−∆HΔH 1 ΔH 2该过程由于速度快,可以看作绝热过程 ΔH=0,设最终有xg 水结成冰,则ΔH=ΔH 1+ΔH 2=0 0=1000×4.238×〔0-(-5)〕+(333.5x) 333.5x=21190 x=63.54g 5、解:沸点时p=101325Pa ∴W =p ΔV =∑νB (g)·RT =5166J Q p =ΔH =67780J ΔU =Q -W =626414J 6、解:C V ,m =12.47J·K -1·mol -1 C p,m =20.79J·K -1·mol -1 (1)W 1=nRΔT=624J Q 1=nC p,m ΔT=1559J (2)W 2=Q 2=nRTln2=2150J (3)W 3=-nC V ,m (T 4-T 3)=811J Q 3=0全过程:W=∑W i =3585J Q=∑Q =3709J ΔU=C V ,m ΔT=125J ΔH=C p,m ΔT=208J 7、解:1kg 水 p =101325PaT 2=273K1kg 水 p =101325Pa T 1=268K 1kg 水+冰 p =101325Pa T 2=273K)()(21)(2)(),1()3(2)2(322g OH CH g O g H s C =++-⨯+)()(21)(),4()2(2g CO g O s C =+-由题意视O 2为理想气体,则 W=p(V 2-V 1)=-R(T 2-T 1)=5.82kJ·mol -1 Q p =△H=⎰21T TdT nC m p,=22.69kJ△U=Q-W=16.87kJ 8、解:(1)C p,m =5/2R C V ,m =3/2R ΔH =nC p,m (T 2-T 1) 2078.5=1×5/2×8.314×(T 2-300) T 2=400KV 2=nRT 2/p 2=1×8.314×400/(200.0×103)=16.63dm 3 ΔU =nC V ,m (T 2-T 1)=1×3/2×8.314×100=1247.1J W=ΔU -Q =1247.1-1000.0=247.1J(2) 300K 400K 400K 100kPa 100kPa 200kPa 气态始终态与(1)相同ΔU =1247.1J ΔH =2078.5J W Ⅰ=-p(V 2-V 1)=-nR(T 2-T 1)W Ⅱ=-nRT ㏑(V 3/V 2)=-nRT 2㏑(P 2/P 3) W=W Ⅰ+W Ⅱ =-1×8.314-1×8.314×400×㏑100/200=1474J Q=ΔU -W=1247.1-1474=-226.6J 9、解:(1)Δr H m ø=-283.05kJ·mol -1Q=Δr H m ø=-283.05kJ·mol -1W=∑νB (g)RT=-1.239kJΔr U m ø=Q-W=-281.8kJ(2)∵ΔU=Δr U m ø+ΔU 2=0∴-281.8+38.49×10-3ΔT=0ΔT=7321.7KT 2=7619.7K 10、解:得Δf H m (298 K,CO(g))=-110.5 kJ·mol -1Δf H m (298 K,CH 3OH(g))=-201.2 kJ·mol -1反应CO(g)+2H2(g)=CH3OH(g)Δr H(298 K)=-90.m第三章热力学第二定律一、选择题1、如图,可表示理想气体卡诺循环的示意图是:()(A) 图⑴(B)图⑵(C)图⑶(D) 图⑷2、工作在393K和293K的两个大热源间的卡诺热机,其效率约为()(A) 83%(B) 25%(C) 100%(D) 20%3、不可逆循环过程中,体系的熵变值()(A) 大于零(B) 小于零(C)等于零(D)不能确4、将1 mol 甲苯在101.325 kPa,110 ℃(正常沸点)下与110 ℃的热源接触,使它向真空容器中汽化,完全变成101.325 kPa 下的蒸气。
