暨南大学分析化学课件:络合滴定方式与应用
合集下载
分析化学络合滴定法.ppt

感谢你的阅读
6
一、络合滴定中的滴的稳定性不高,而且还存在分步络
合等缺点。在分析化学中,主要用于干扰物质的掩蔽剂和 防止金属离子水解的辅助络合剂等。
有机络合剂:
应用有机络合剂(多基配位体)的络合滴定方法,已成
为广泛应用的滴定分析方法之一。目前应用最为广泛的有
2019-10-19
感谢你的阅读
12
图6-1 EDTA各型体的分布曲线
2019-10-19
感谢你的阅读
13
从图6—1可以看出,在不同pH值时,EDTA的主要存在型 体如下:
2019-10-19
pH
主要存在型体
<0.9 0.9~1.6 1.6~2.16 2.16~2.67 2.67~6.16 6.16~10.2
︰
[MLn]= βn[M][L]n
2019-10-19
感谢你的阅读
25
3.总形成常数和总离解常数
总形成常数:最后一级累积形成常数又叫总形成常数; 总离解常数:最后一级累积离解常数又叫总离解常数。
对上述1:4型如Cu(NH3)2+的络合物 K形=β4;
总形成常数与总离解常数互为倒数关系,即
2019-10-19
感谢你的阅读
21
1. 络合物的逐级形成常数与逐级离解常数
络合物形成常数(对ML4型来讲)的一般规律是: K1>K2>K3>K4
原因: 随着络合体数目的增多,配体间的排斥作用增强,稳定
性下降。
2019-10-19
感谢你的阅读
22
络合物的离解常数
离解常数:如果从络合物的离解来考虑,其平衡常数称为 “离解常数”。
第一级形成常数: Cu2++NH3= Cu(NH3)2+ K1=[Cu(NH3)2+]/[Cu2+][NH3]=1.4×104
(推荐)《分析化学络合滴定》PPT课件

金属离子所带电荷不同,但配位比均为 1:1,只有极少数例外。定量计算简单。
9
络合物的稳定常数
一、络合物的稳定常数(形成常数)
M+Y
MY
稳定常数
MY KMY MY
KMY大,络合物稳定性高,络合反应完全 M与EDTA的 lgKMY值见P98表5-1
10
二、MLn型络合物的累积稳定常数P102
M+L
ML ML 一级稳定常数 K1 ML
金属离子浓度的影响my突跃范围一定时浓度改变仅影响配位滴定曲线的前侧突跃范围一定时控制控制ll和和h可以增大可以增大kkmymy从而增大滴定突跃从而增大滴定突跃k改变仅影响滴定曲线lglglglgmymymymspsp是选择指示剂的依据计量点时的sppmmy企业文化就是传统氛围构成的公司文化它意味着公司的价值观诸如进取守势或是灵活这些价值观构成公司员工活力意见和行为的规范
Z (N n3 )H 3 .1 15 0lg Z (N n3 )H 5 .4
p H 9 :计 Y (H 算 ) 11 .2 0 或 9 P 1 查 0 l0 g Y (H ) 表 1 .2
查 (P 表 9) 8 lg K Zn Y 1.5 60
lg K Z ' n 1 Y.5 6 0 5 .4 9 1 .2 8 9 .733 2
14
(一)络合剂Y的副反应和副反应系数
1) 与H+的反应(酸效应) 2)与共存干扰离子N络合(共存离子效应)
主反应:
M
+
Y
MY
副反应:
L
OH- H +
N
H+
OH-
ML
MOH HY
NY
MHY
分析化学课件络合滴定法

14
三、金属离子-EDTA(M-Y)螯合物特点 1.广泛的络合性能且络合反应快; 2. 络合比简单(大多数为1:1); 用EDTA滴定金属离子的反应为:
Mn+ + H2Y2- = MY(n-4)+ + 2H+ 计量数为1,通式略电荷 通式为:
M+Y=MY 3.络合物稳定,可形成多个五元环螯合物;
4. 大多数MY无色。
[MLn ] [M ][L]n
=K1K2•••Kn
23
M + L ML
逐级稳定常数 Ki [ML]
K1= [M][L]
ML + L
ML2
K2=
[ML2] [ML][L]
● ● ●
MLn-1 + L
MLn
● ● ●
Kn=
[MLn] [MLn-1][L]
累积稳定常数
1=K1=
[ML] [M][L]
K不稳
[M ][Y1型络合物 ,其形成常数与解离常数互为倒数2。0
2. MLn(1:n)型络合物
累积形成常数:络合物逐 级形成常数的乘积。β
(1) ML2型 M + L ML
K1
[ML] [M][L]
ML + L
ML2
K2
[ML2 ] [ML][L]
总:M+2L
11
EDTA解离
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
= 10-0.90 = 10-1.60
三、金属离子-EDTA(M-Y)螯合物特点 1.广泛的络合性能且络合反应快; 2. 络合比简单(大多数为1:1); 用EDTA滴定金属离子的反应为:
Mn+ + H2Y2- = MY(n-4)+ + 2H+ 计量数为1,通式略电荷 通式为:
M+Y=MY 3.络合物稳定,可形成多个五元环螯合物;
4. 大多数MY无色。
[MLn ] [M ][L]n
=K1K2•••Kn
23
M + L ML
逐级稳定常数 Ki [ML]
K1= [M][L]
ML + L
ML2
K2=
[ML2] [ML][L]
● ● ●
MLn-1 + L
MLn
● ● ●
Kn=
[MLn] [MLn-1][L]
累积稳定常数
1=K1=
[ML] [M][L]
K不稳
[M ][Y1型络合物 ,其形成常数与解离常数互为倒数2。0
2. MLn(1:n)型络合物
累积形成常数:络合物逐 级形成常数的乘积。β
(1) ML2型 M + L ML
K1
[ML] [M][L]
ML + L
ML2
K2
[ML2 ] [ML][L]
总:M+2L
11
EDTA解离
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
= 10-0.90 = 10-1.60
第三章络合滴定法课件

MY
H+
OH -
MHY
M(OH)Y
MLn 辅助配 位效应
2024/8/2
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
混合配位效应
25
配合物MY的副反应及副反应系数MY
主反应:
M
+
Y
MY
副反应: L
OH - H +
N
H+
OH -
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MHY
M(OH)Y
主反应和副反应
H6Y
羟基配位效应 辅助配位效应 酸效应 共存离子效应
混合配位效应
M(OH)
数
2024/8/2
M(L)
Y(H)
Y(N)
MY(H) MY(OH) 副反应系
20
主反应:
M
+
Y
副反应:
L
OH - H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH -
MHY
M(OH)Y
MLn
MLn
辅助配 位效应
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
2024/8/2
混合配位效应
26
EDTA的酸效应Y(H):由于H+存在使
EDTA与金属离子配位反应能力降低的现
象。
M+Y
MY
主反应
H+ HY
H+
H+
H2Y
络合滴定 分析化学课件

[MLn] n=K1K2 ·Kn= · · [M][L]n
表示络合物与
配体之间的关系
2 溶液中各级络合物的分布
M + L = ML ML + L = ML2
● ● ●
[ML] = 1 [M] [L] [ML2] = 2 [M] [L]2
● ● ●
MLn-1 + L = MLn
[MLn ]= n [M] [L]n
1=K1= 1010.26
2=K1K2= 1016.42
+
Y2- + H+ =
Y-
3=K1K2K3= 1019.09
4=K1K2K3K4= 1021.09 5=K1K2..K5= 1022.69 6=K1K2..K6 = 1023.59
H3
Y-
+
H+ = H4Y
H+ = H5 Y+
计算:pH=3.0、5.0时的lg ZnY(H), KZnHY=103.0
pH=3.0, αZnY(H)=1+10-3.0+3.0=2 , lgαZnY(H)= 0.3 pH=5.0, αZnY(H)=1+10-5.0+3.0=1, lgαZnY(H)= 0
2 条件稳定常数
[MY'] MY KMY = =KMY [M'][Y'] M Y
[H+][H4Y] [H5Y]
= 10-1.60
[H+][H3Y] Ka3= = 10-2.00 [H4Y] [H+][H2Y] Ka4= = 10-2.67 [H3Y]
H2Y2- =H+ + HY3HY3- =H+ + Y4-
《络合滴定法》课件

《络合滴定法》PPT 课件
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
分析化学-第五章络合滴定幻灯片

数
H3Y -
0.2
H4Y
0.0
0 2 4 6 8 10 12 14 EDTA 各种型体分布图 pH
配位性质
Analytical Chemistry 分析化学
EDTA 有 6 个配位基
HOO 2CCH H -OO2CH N + CH2CH2
+ N
CH2COO-
H CH2COOH
.. 2个氨氮配位原子 4个羧氧配位原子
[MY] KMY= [M][Y]
亦可用K稳表示
离解常数(K不稳)
K不稳
1 K稳
M + L = ML
逐级稳定常数 Ki
[ML] K1= [M][L]
ML + L = ML2
K2=
[ML2] [ML][L]
Analytical Chemistry 分析化学
累积稳定常数
1=K1=
[ML] [M][L]
6.4 络合滴定中酸度的控制
6.4.1 单一离子滴定的酸度控制 6.4.2 分别滴定的酸度控制 6.4.3 提高络合滴定选择性的途径
6.5 络合滴定的方式和应用 6.5.1 络合滴定的方式 6.5.2 络合滴定的应用
Analytical Chemistry 分析化学
6.1 络合滴定法概述
定义: 以络合反响为根底的一种滴定分析方法
Fe 2+ + 3
NN
邻二氮菲
NN e
2+ 3
桔红色 max
Analytical Chemistry 分析化学
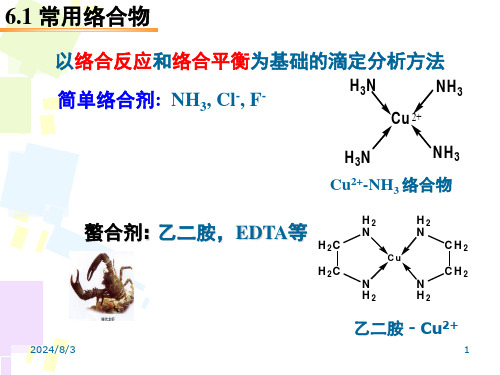
分析化学中的络合物
简单配体络合物
螯合物
多核络合物
Cu(N3H)24
H2C H2C
第六章络合滴定法ppt课件
2024/8/3
3
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
EDTA: δ -pH图
δ
1.0
0.8
H6Y2+
H2Y2-
HY3-
0.6 0.4
H5Y+
H3Y-0.2来自H4Y0.00 2 4 6 8 10
(2)共存离子效应系数
Y(N)
[Y]
[Y]+[NY]
Y(N)= [Y] =
[Y]
= 1+ KNY[N]
多种共存离子
Y(N)= [Y] = [Y]+[N1Y]+[N2Y]+…+[NnY]
[Y]
[Y]
= 1+KN1Y[N1]+KN2Y[N2]+…+KNnY[Nn]
=Y(N1)+Y(N2)+…+Y(Nn)-(n-1)
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
= 10-0.90 = 10-1.60
Ka3=
[H+][H3Y] [H4Y]
= 10-2.00
Ka4=
[H+][H2Y] [H3Y]
Ka5= Ka6=
[H+][HY] [H2Y]
[H+][Y] [HY]
= 10-2.67 = 10-6.16 = 10-10.26
2024/8/3
8
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
易水解
例:Al3+的测定, lg K = 16.1, 足够稳定,但由于
(1) Al3+与EDTA的络合反应缓慢; (2) Al3+对二甲酚橙有封闭作用,缺乏合适的指示剂;
(3) Al3+易水解生成多核羟基化合物;
2020/8/18
故不能用EDTA进行直接滴定。
例 Al3+的测定
pH3.5 AlY
Al3+
pH5~6 冷却,XO 黄→红
AlY PbY ZnY
Zn2+
F-
AlF63PbY+Y(析出)
AlF63PbY
加热
ZnY
冷却 ZnY
黄→红
(测Al,Pb总量) (测Al)
2020/8/18
4. 间接滴定法(P102):
▪ 有些金属离子和非金属离子不与EDTA发生络 合反应或生成的络合物不稳定,这是可采用间 接滴定法
Mg2+总量;
pH>12,Mg(OH)2↓, 用钙指示剂, 测Ca2+量
2020/8/18
2. 返滴定法: P101
返滴定法:在待测溶液中先加入定量且过量的EDTA,使待测
离子完全络合。然后用其他金属离子标准溶液回滴过量的
EDTA。根据两种标准溶液的浓度和用量,求得被测物质的含
量。
封闭指示剂
被测M与Y络合反应慢
2020/8/18
过量Y,加热
Y过量
pH5~6 冷却
AlY ZnY
Zn2+ XO 黄 → 红
nAl nEDTA nZn
由于Al3+与EDTA的反应缓慢,且逆向反应同样是 缓慢的,即,AlY 一旦形成就很稳定,故实际上可 用Zn2+作返滴定剂。
2020/8/18
3. 置换滴定法: (P102)
(1) 置换金属离子:被测M与Y的络合物不稳定
第五章 配位滴定法
第三节 络合滴定方式及
应用
一、直接滴定法 二、返滴定法 三、置换滴定法 四、间接滴定法
2020/8/18
络合滴定方式及应用
1. 直接滴定法:P101
➢ 直接滴定法:用EDTA标准溶液直接滴 定被测离子的方法
➢ lgcK≥6
➢ 反应速率快 ➢ 有合适指示剂指示终点 ➢ 被测离子不水解
▪ 测非金属离子: PO43- 、 SO42-
▪ 待测M与Y的络合物不稳定: K+、 Na+ 含金属离子的药物的间接测定
可作为金属配体的生物碱类药物的间接测定
2020/8/18
总结:
▪ 络合平衡 副反应系数 Y(H) 、 Y(N) 和 M 条件稳定常数 K’MY
▪ pMsp 和pMep(pMt)及 Et ▪ 滴定酸度控制 ▪ 共存离子分步滴定 ▪ 滴定方式及应用
2020/8/18
例: 在酸性介质中
ZrO2+, Th4+, Ti3+, Bi3+, Fe3+……
在弱酸性介质中 Zn2+, Cu2+, Pb2+, Cd2+, ……
在氨性介质中 Ca2+, Mg2+, ……
例 水硬度的测定: Ca2+、 Mg2+ lgKCaY=10.7 lgKMgY=8.7 在pH=10的氨性缓冲溶液中,EBT为指示剂,测Ca2+、
例 Ag与EDTA的络合物不稳定 lgKAgY=7.3 lgKNiY=18.6
Y 紫脲酸铵
2Ag++Ni(CN)42- =2Ag (CN)2-+Ni2+
Y 例 间接金属指示剂
MgY+EBT+Ca2+
2020/8/18
CaY+MgY+EBT
(2) 置换出EDTA
Zn2+ Al3+ pH3~4 AlY Pb2+ Y过 ,加热 PbY+ Y(剩)
