金属 氧化物 酸 碱 盐之间的反应规律以及发生条件
初中酸碱盐反应规律小结

初中酸、碱、盐化学反应规律小结一、用金属活动性顺序正确书写金属与酸、金属与盐的置换反应金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu1、金属与酸、金属与盐是否发生置换反应,既要根据金属活动性顺序加以判断,还要考虑酸和盐的特点。
金属与酸反应:活泼金属+酸—→盐+氢气(H以前)(一般是稀HCl和稀H2SO4)金属与盐反应:金属+盐—→新盐+新金属(2Cu+2H2SO体〔34、3点的5、+21、复分解反应能否发生首先要考虑反应物的溶解性,这是前提条件。
当反应物条件符合以后,才能考虑生成物是否符合复分解反应发生的条件,即生成物是否有沉淀或气体或水产生,如果有则复分解反应能进行,反之则不能进行。
2、酸的溶解性规律:初中接触的酸一般都可溶,其中H2SO4、H3PO4是不挥发性酸。
HCl、HNO3、H2CO3有挥发性,是挥发性酸。
但要注意H2CO3的挥发性表现为不稳定性(是化学性质):H2CO3==H2O+CO2↑。
碱的溶解性规律:钾、钠、钡、铵[KOH、NaOH、Ba(OH)2、NH3·H2O]的碱可溶,Ca(OH)2微溶,其余的碱不溶。
注意:①氨水有挥发性,和H2CO3一样,也表现为不稳定性(是化学性质):NH3·H2O==NH3↑+H2O②AgOH 为白色沉淀,但非常不稳定,在溶液中生成的同时马上分解产生褐色的氧化银沉淀:2AgOH==Ag 2O ↓+H 2O盐的溶解性规律:钾、钠、铵盐、硝酸盐溶得快;盐酸盐(氯化物)不溶氯化银;硫酸盐不溶钡、银、钙(银、钙微溶);碳酸盐溶解钾、钠、铵(的碳酸盐),微溶碳酸镁,其它一般往下沉。
注意:Fe 2(CO 3)3、Al 2(CO 3)3遇水分解。
如:Fe 2(CO 3)3+3H 2O=2Fe (OH )3↓+3CO 2↑ 3、酸和碱的反应:酸+碱→盐+水(中和反应,属于复分解反应)(1)、酸溶液与碱溶液的反应:一般都能发生反应,即酸碱不受限制。
物质间的反应规律
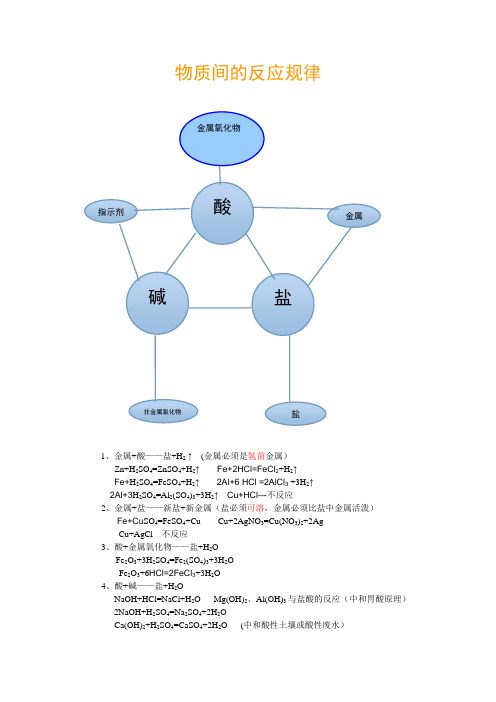
物质间的反应规律1、金属+酸——盐+H2↑(金属必须是氢前金属)Zn+H2SO4=ZnSO4+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑2Al+6 HCl =2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Cu+HCl---不反应2、金属+盐——新盐+新金属(盐必须可溶,金属必须比盐中金属活泼)Fe+Cu SO4=FeSO4+Cu Cu+2AgNO3=Cu(NO3)2+2AgCu+AgCl---不反应3、酸+金属氧化物——盐+H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2OFe2O3+6HCl=2FeCl3+3H2O4、酸+碱——盐+H2ONaOH+HCl=NaCl+H2O Mg(OH)2、Al(OH)3与盐酸的反应(中和胃酸原理)2NaOH+H2SO4=Na2SO4+2H2OCa(OH)2+H2SO4=CaSO4+2H2O (中和酸性土壤或酸性废水)5、酸+盐——新酸+新盐2HCl+Na2CO3=2NaCl+H2O+CO2↑2HCl+K2CO3=2KCl+H2O+CO2↑HCl+NaHCO3=NaCl+H2O+CO2↑2HCl+CaCO3=CaCl2+H2O+CO2↑H2SO4+Ba(NO3)2=BaSO4↓+2HNO36、碱+盐——新碱+新盐(反应物均可溶,生成物有沉淀)Cu SO4+2NaOH=Na2SO4+Cu(OH)2↓Na2CO3+Ca(OH)2=2NaOH+CaCO3↓Cu SO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓Ba(OH)2+CaCO3-------不反应,反应物中有不溶物。
Ba(NO3)2+NaOH--------不反应,生成物中无沉淀7、盐+盐——两种新盐(反应物均可溶,生成物有沉淀)Na2CO3+CaCl2=2NaCl+CaCO3↓AgNO3+NH4Cl=AgCl↓+NH4NO3Ba(NO3)2+NaCl------不反应,生成物中无沉淀Na2SO4+BaCO3------不反应,反应物中有不溶物8、碱+非金属氧化物——盐+H2O(非金属氧化物中非金属元素的化合价在反应前后不变)2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O。
十种成盐规律

十 种 成 盐 规 律●王爱忠对初学化学者来说,,化学方程式书写的入门是一个难点,但化学方程式正确快速书写是学习化学者自始自终必须面对的一个极其重要的问题。
酸、碱、盐、氧化物相互反应的关系是化学反应中最为基本的,它们大体上可用十种成盐规律来概括。
掌握这十种成盐规律,将会对深入学习化学大有裨益。
一、金属+非金属—→无氧酸盐1.成盐规律:金属和非金属(氧元素除外)可以发生化合反应,生成无氧酸盐。
2.成盐条件:(1)化学活泼性较强的金属单质(如K 、Na 、Ca 等)跟化学活泼性较强的非金属单质在加热条件下就能发生化合反应。
例如,2K+Cl 22KCl2Na+Cl 22NaCl2Na+I 22NaI(2)化学活泼性较强的金属单质与化学活泼性较弱的非金属单质通常在高温下才发生化合反应。
例如, 2Cu+S Cu 2S 特例:Hg+S HgS (摩擦即反应)2Ag+S===Ag 2S二、碱性氧化物+酸性氧化物—→含氧酸盐1.成盐规律:碱性氧化物与酸性氧化物相互反应能生成含氧酸盐。
2.成盐条件:除了很活泼的金属氧化物能在常温下吸收二氧化碳生成碳酸盐外,其他氧化物之间通常要在高温下才能发生反应。
例如:Na 2O+CO 2===Na 2CO 3 CaO+SiO 2 CaSiO 3 PbO+SiO 2 PbSiO 3三、金属+酸—→盐+氢气1.成盐规律:活泼的金属与稀酸反应生成盐和氢气。
2.成盐条件:位于金属活动性顺序表中氢前面的金属与稀酸(H 2SO 4或盐酸),可以置换出酸中的氢。
例如,Zn+H 2SO 4(稀)===ZnSO 4+H 2↑Mg+2HCl(稀)===MgCl 2+H 2↑离子方程式为:Zn+2H +===Zn 2++H 2↑Mg+2H +===Mg ++H 2↑但是有例外。
例如,Pb+H 2SO 4≠PbSO 4+H 2↑因为铅与硫酸(浓度低于80%)接触后,在它表面上会迅速生成难溶盐PbSO 4,它阻碍了铅与硫酸继续接触从而使反应停止。
化学方程式规律

化学方程式规律一.三个置换反应规律1.酸+金属==盐+氢气反应条件:①酸不能用强氧化性酸,如硝酸(硝酸根的氧化性强于氢离子)、浓硫酸(浓硫酸根的氧化性强于氢离子),(常用稀硫酸、盐酸)②金属必须位于氢以前(常用Mg、Al、Zn、Fe)Mg+ 2HCl==MgCl2+H2↑Mg+ H2SO4==MgSO4+H2↑2Al+6 HCl== 2AlCl3+3H2↑2Al+3 H2SO4== 2Al2(SO4)3+3H2↑Zn+ 2HCl==ZnCl2+ H2↑Zn+ 2H2SO4==ZnSO4+ H2↑Fe+ 2HCl==FeCl2+H2↑Fe+H2SO4===FeSO4+H2↑2.盐+金属==新盐+新金属反应条件:①盐(反应物)必须溶于水②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠(因为K、Ca、Na放入溶液中首先与水【剂】应先,再于溶液中的盐【溶质】反应) 溶剂溶质的定义溶质,液体叫溶剂。
对于两种液体所组成的溶液,通常把含量较多的组分叫溶剂,少者叫溶质。
分为无机溶剂和有机溶剂两大类。
水是应用最广泛的无机溶剂,酒精、汽油、氯仿及丙酮等是常用的有机溶剂。
Fe+CuSO4==FeSO4+Cu 2Al+3CuSO4==Al2(SO4)3+3CuZn+CuSO4==ZnSO4+Cu Cu+2AgNO3==Cu(NO3)2+2AgCu+Hg(NO3)2==Cu(NO3)2+Hg3.两种还原剂(H2 、、C)跟氧化物反应H2+CuO Cu+H2O C+2CuO 2Cu+CO2↑二.三个分解反应规律1.酸(含氧酸)==非金属氧化物+水【酸可自行分解的是硝酸和碳酸,硫酸和盐酸不行】H2CO3 === H2O+CO2↑HNO3=== H2O+NO2↑2.碱(难溶性)== 金属氧化物+水Cu(OH)2CuO+H2O 2Fe(OH)3Fe2O3+3H2O3.碳酸盐(难溶性)==金属氧化物+二氧化碳CaCO3CaO+ CO2↑(工业制二氧化碳气体)三.四个化合反应规律1.金属+氧气== 金属氧化物2 Mg+O2 2MgO 3Fe+2 O2 Fe3O42Cu+ O22CuO2.非金属+氧气==非金属氧化物S+O2 SO2 4P+5O2 2P2O5C+O2 CO2 (碳充分燃烧)2 C+O2 2 C O(碳不充分燃烧)2H2+O2 2H2O3.金属氧化物+水== 碱(可溶性)CaO+H2O==Ca(OH)2 Na2O+H2O==2NaOH4.非金属氧化物+水==酸CO2+H2O==H2CO3 SO3+O2==H2SO4 SO2+O2== H2SO3四.五个复分解反应规律1.酸+碱==盐+水反应条件:酸可溶Cu(OH)2+2HCl==CuCl2+H2O Al(OH)3+3HCl==AlCl3+3H2OCu(OH)2+H2SO4==CuSO4+2H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2O2.酸+盐==新酸+新盐反应条件:①酸可溶②生成物要有沉淀或水或气体CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO2↑AgNO3+HCl==AgCl↓+HNO3Na2CO3+H2SO4==Na2SO4+H2O+CO2↑H2SO4+BaCl2==2HCl+BaSO4↓H2SO4+Ba(NO3)2==2HNO3+BaSO4 ↓3.盐+碱==新盐+新碱反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaCl Na2CO3+Ca(OH)2==2NaOH+CaCO3↓CuSO4+Ba(OH)2==Cu(OH)2↓+BaSO4 ↓4.盐+盐==新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)NaCl+AgNO3==NaNO3+AgCl↓Na2SO4+BaCl2==2NaCl+BaSO4 ↓Na2SO4+Ba(NO3)2==2NaNO3+BaSO4 ↓5.酸+金属氧化物==盐+水反应条件:酸可溶Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O CuO+2HCl==CuCl2+H2O CuO+ H2SO4==CuSO4+H2OMgO+2HNO3==Mg(NO3)2+H2O五.其它反应1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)2NaOH+CO2==Na2CO3+H2O(吸收CO2 )2NaOH+SO2==Na2SO3+H2O(吸收SO2)2NaOH+SO3==Na2SO4+H2OCa(OH)2+CO2==CaCO3↓+H2O(检验CO2 )2.一种还原剂CO跟氧化物反应(氧化还原反应)CO+CuO Cu+CO23CO+Fe2O32Fe+3 CO2↑六、重要反应1.实验室制取三种气体(常用方法)2KMnO4K2MnO4+MnO2+ O2↑2KClO32KCl+3O2↑2H2O2== 2 H2O + O2↑(以上是实验室制氧气)Zn+ 2HCl==ZnCl2+ H2↑Zn+ 2H2SO4==ZnSO4+ H2↑(实验室制氢气)CaCO3+2HCl==CaCl2+H2O+CO2↑(实验室制二氧化碳气体)七、不常见的某些盐的反应Cu2(OH)2CO32CuO+H2O+CO2↑CuSO4 +5 H2O = CuSO4 ·5 H2O (检验水蒸汽)(白色)(蓝色)CuSO4 ·5 H2O CuSO4 +5 H2O(蓝色)(白色)。
酸碱盐化学方程式及现象

酸碱盐化学方程式及现象一.两个置换反应规律1.酸+金属==盐+氢气反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,常用稀硫酸、盐酸②金属必须位于氢以前常用Mg、Al、Zn、Fe③有铁参加的置换反应生成亚铁盐铁元素显+2价1镁与盐酸反应: Mg+ 2HCl==MgCl2+H2↑现象:金属表面均有气泡生成,金属逐渐溶解;2铝与盐酸反应 2Al+6 HCl== 2AlCl3+3H2↑现象:金属表面均有气泡生成,金属逐渐溶解;3锌与盐酸反应: Zn+ 2HCl==ZnCl2+ H2↑现象:金属表面均有气泡生成,金属逐渐溶解;4铁与盐酸反应: Fe+ 2HCl==FeCl2+H2↑现象:金属表面均有气泡生成,金属逐渐溶解,溶液由无色变为浅绿色;5镁与稀硫酸反应: Mg+ H2SO4==MgSO4+H2↑现象:金属表面均有气泡生成,金属逐渐溶解;6铝与稀硫酸反应: 2Al+3 H2SO4== 2Al2SO43+3H2↑现象:金属表面均有气泡生成,金属逐渐溶解;7锌与稀硫酸反应 Zn+ 2H2SO4==ZnSO4+ H2↑现象:金属表面均有气泡生成,金属逐渐溶解;8铁与稀硫酸反应: Fe+H2SO4===FeSO4+H2↑现象:金属表面均有气泡生成,金属逐渐溶解,溶液由无色变为浅绿色;现象 1至8现象:金属表面均有气泡生成,金属逐渐溶解;4和8另加现象:溶液由无色变为浅绿色2.盐+金属==新盐+新金属反应条件:①盐反应物必须溶于水②有铁参加的置换反应生成亚铁盐铁元素显+2价③金属单质反应物比盐中金属活泼,不用钾、钙、钠9铁与硫酸铜溶液反应: Fe+CuSO4==FeSO4+Cu现象:铁表面有紫红色固体覆盖,溶液有蓝色逐渐变为浅绿色10铝与硫酸铜溶液反应: 2Al+3CuSO4==Al2SO43+3Cu现象:铝表面有紫红色固体覆盖,溶液有蓝色逐渐变为无色11铜与硝酸银溶液反应: Cu+2AgNO3==CuNO32+2Ag现象:铜表面有银白色固体覆盖,溶液有无色逐渐变为蓝色二.五种复分解反应规律1.酸+碱==盐+水中和反应,实质是:氢离子和氢氧根离子生成水分子12氢氧化铝和盐酸反应用氢氧化铝治疗胃酸过多:AlOH3+3HCl==AlCl3+3H2O13氢氧化镁和盐酸反应用氢氧化镁治疗胃酸过多:MgOH2+2HCl ==MgCl2+2H2O14氢氧化钠和盐酸反应: NaOH +HCl== NaCl+ H2O2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件酸和碳酸盐反应时,碳酸盐溶不溶均可15大理石与稀盐酸反应实验室制二氧化碳 CaCO3+2HCl==CaCl2+H2O+CO2↑16碳酸钠与稀盐酸反应可用于检验氢氧化钠变质Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:溶液中有气泡生成,生成的气体使澄清的石灰水变浑浊17碳酸氢钠与稀盐酸反应用小苏打治疗胃酸过多NaHCO3+HCl==NaCl+H2O+CO2↑现象:溶液中有气泡生成,生成的气体使澄清的石灰水变浑浊3.盐+碱==新盐+新碱反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉18碳酸钠与氢氧化钙反应: Na2CO3+CaOH2==CaCO3↓+2NaOH工业制火碱;区别CaOH2和NaOH;除杂NaOH溶液中CaOH2或Na2CO3杂质现象生成白色碳酸钙沉淀19硫酸铜与氢氧化钠溶液反应 CuSO4+2NaOH==CuOH2↓+Na2SO4现象生成蓝色絮状氢氧化铜沉淀4.盐+盐==新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉20碳酸钠溶液与氯化钙溶液反应: Na2CO3 + CaCl2 = 2NaCl + CaCO3↓现象生成白色碳酸钙沉淀5.酸+金属氧化物==盐+水211、铁锈与盐酸反应: Fe2O3+6HCl==2FeCl3+3H2O现象铁锈脱落溶解,溶液由无色变成黄色22铁锈与硫酸反应: Fe2O3+3H2SO4==Fe2SO43+3H2O现象铁锈脱落溶解,溶液由无色变成黄色23氧化铜与盐酸反应: CuO+2HCl==CuCl2+H2O 现象黑色粉末逐渐溶解,溶液由无色变成蓝色24氧化铜与硫酸反应: CuO+ H2SO4==CuSO4+H2O现象黑色粉末逐渐溶解,溶液由无色变成蓝色三、其他反应非金属氧化物+碱溶液==盐+水25氢氧化钙溶液与二氧化碳检验二氧化碳 CaOH2+ CO2== CaCO3↓+ H2O现象澄清石灰水变白色、浑浊,有白色沉淀CaCO3生成26氢氧化钠与二氧化碳反应:氢氧化钠变质、除去CO22NaOH+ CO2== Na2CO3 + H2O27氢氧化钠与二氧化硫反应:用氢氧化钠除去SO22NaOH+ SO2== Na2SO3 + H2O四、酸碱盐溶解口诀溶碱有五位,钾钠铵钡钙;钾钠铵盐均可溶,硝酸盐类也都溶;氯化物只有银不溶,硫酸盐只有钡不溶;碳酸盐只溶钾钠铵七大沉淀:。
酸 碱 盐反应规律及条件

酸碱盐反应规律及条件一、酸的化学性质1.酸与指示剂反应酸与酚酞色与石蕊溶液变色2.酸+活泼金属=(金属为H前酸为稀H2SO4,稀HCL)Mg+HCl= Mg+H2SO4=Zn+HCl= Zn +H2SO4=Fe+HCl= Fe +H2SO4=3.酸+金属氧化物=CuO+ HCl= Fe2O3+ HCl=Fe2O3+H2SO4= CuO+H2SO4=4.酸+碱=Mg(OH)2+ HCl= Mg(OH)2+ H2SO4=NaOH+ HCl=Al(OH)3+ HCl=5.酸+盐=(生成物符合复分解反应条件)BaCl2+ H2SO4= CaCO3+ HCl=AgNO3+ HCl=二、碱的化学性质1.碱与指示剂反应:碱遇酚酞变色,遇石蕊变色。
2.碱+非金属氧化物=CO2+NaOH= CO2+Ca(OH)2=SO2+ NaOH= SO3+ NaOH= 3.碱+酸=Cu(OH)2+H2SO4= KOH+HCl=Ba(OH)2+H2SO4=4.碱+盐=(反应物均溶于水,生成物有↓)CuSO4+NaOH= Na2CO3 +Ca(OH)2= FeCl3+NaOH=CuSO4+Ca(OH)2=三、盐的化学性质1.盐+金属= (盐可溶,金属比盐中金属活泼)Al+CuSO4= Cu+AgNO3=Fe+CuSO4=2.盐+酸=(盐可溶,生成物符合复分解反应条件)K2CO3+HCl=NaHCO3+HCl=3.盐+碱=CuCl2+NaOH=K2CO3+Ca(OH)2=4.盐+盐= (反应物均溶于水,生成物之一有↓产生) BaCl2+Na2SO4= CaCl2+ Na2CO3= AgNO3+NaCl=。
专题二_金属、氧化物、酸、碱、盐的相互关系

点燃
; ; 。
【解析】本题要求学生将单质、氧化物、酸、碱和盐的相互关系根据图示联系具体化学反 应表示出来,学生必须对各类物质的性质熟悉,并能正确书写化学方程式。考查了学 生对知识的理解能力。 【答案】② CO2+H2O==H2CO3 ③ CO2+Ca(OH)2==CaCO3↓+H2O ④ Fe+2HCl==FeCl2+H2↑ ⑤ CaO+2HCl==CaCl2+H2O ⑥ Ca(OH)2+2HCl==CaCl2+2H2O ⑦ CaO+H2O==Ca(OH)2
5. 右图中“—”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可 以转化为戊。下面四组选项中,符合右图要求的是(此题有两个选项) 甲 A B C Al HCl C 乙 H2SO4 Zn CuO 丙 NaOH H2SO4 HCl 丁 CuCl2 Fe O2 戊 Al2O3 CuCl2 CO
3. 盐有4种性质(4条连线): (1) 盐+金属→ (2) 盐+酸→ (3) 盐+碱→ (4) 盐+盐→
4. 金属有3种性质(3条连线): (1) 金属+氧气→ (2) 金属+酸→ (3) 金属+盐溶液→
例:2Mg+O2=== 例:Fe+2HCl== 例:Cu+2AgNO3==
点燃
. .
.
二、理解两种反应条件 1. 复分解反应发生的条件: (1) 从定义上分析:复分解反应是两种化合物相互交换成分生成另外两种化合物的反应。 例如:2NaOH+CO2==Na2CO3+H2O 复分解反应,因为两种反应物没有相互交换成分。 再如:CaCO3+2HCl==CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合 物生成,但却 复分解反应,该反应的实质是:CaCO3+2HCl==CaCl2+H2CO3, H2CO3不稳定分解为H2O和CO2,因此该反应 复分解反应。 (2) 复分解反应发生的条件是:①对于反应物来说:酸与碱反应,二者至少有一种要溶于 水;酸与盐反应时酸必须溶于水;盐与碱、盐与盐反应时,两种反应物必须 溶 于水。②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。 2. 金属与盐溶液发生置换反应的条件: (1) 金属的位置:只有排在 的金属才能把 的金属从其盐溶液中置 换出来; (2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成 相应的碱和氢气,因而不会置换出盐中的金属; (3) 盐必须溶于水; (4) 铁与盐溶液反应时生成 价的亚铁盐,金属与铁盐发生置换反应时,要用 +2价的亚铁盐。
化学反应基本规律

单质、氧化物、酸、碱、盐的相互反应基本关系以下各类别物质间可发生反应:1、金属+酸2、金属+盐3、酸性氧化物+碱4、碱性氧化物+酸5、酸+碱6、酸+盐7、碱+盐8、盐+盐具体情况是:1、金属单质+ 酸→盐+ 氢气(置换反应)规律:在金属活动性顺序中排在氢之前的金属,才能置换酸中的氢;注意:常见的盐酸和稀硫酸可以与氢前面的金属反应生成氢气。
因浓硫酸、硝酸具有氧化性,与金属反应,但一般不能生成氢气;如Zn与稀硝酸反应生成Zn(NO3)2、H2O和NO如:锌+稀硫酸:Zn + H2SO4 =ZnSO4 + H2↑铁+稀硫酸:Fe + H2SO4 = FeSO4 + H2↑铝+稀硫酸:2Al + 3H2SO4 =Al2(SO4)3 + 3H2↑铁+稀盐酸:Fe + 2HCl = FeCl2 + H2↑镁+稀盐酸:Mg+ 2HCl = MgCl2 + H2↑铝+稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑铜+稀盐酸:不反应银+稀硫酸:不反应特别提示:铁与盐酸、稀硫酸反应生成的盐中铁元素显+2价。
2、金属单质+ 盐溶液→另一种金属+ 另一种盐反应条件:①盐可溶;②在金属活动性顺序中,排在前面的金属才能置换后面的金属。
注意:钾、钙、钠很活泼,在盐溶液中不能置换出金属。
(因先与水反应)如:铁+硫酸铜溶液:Fe + CuSO4 =FeSO4 + Cu锌+硫酸铜溶液:Zn + CuSO4 = ZnSO4 + Cu铜+硝酸汞溶液:Cu + Hg(NO3)2= Cu(NO3)2 + HgMg+NaCl溶液:不反应Cu+AgCl:不反应特别提示:铁与盐溶液发生置换反应时,生成物中铁显+2价。
3、碱性氧化物+酸→盐+ 水规律:酸为HCl、H2SO4、HNO3时,它们与任何碱性氧化物都可反应。
其它酸目前暂时不要求掌握。
如:氧化铁+稀盐酸:Fe2O3 + 6HCl =2FeCl3 + 3H2O氧化铁+稀硫酸:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O氧化铜+稀盐酸:CuO + 2HCl = CuCl2 + H2O氧化铜+稀硝酸:CuO + 2HNO3 =Cu(NO3)2 + H2O氧化镁+稀硫酸:MgO + H2SO4 =MgSO4 + H2O氧化钙+稀盐酸:CaO + 2HCl= CaCl2 + H2O4、酸性氧化物+碱→盐+ 水规律:碱为NaOH、KOH、Ca(OH)2、Ba(OH)2时,它们与任何酸性氧化物都可反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe + H2SO4(稀) = FeSO4 + H2
Zn+2HNO3 = Zn(NO3)2 + H2↑(×) Fe + H2SO4(浓) = FeSO4 + H2(×)
2. 金属 + 盐 → 新盐 + 新金属
反应条件:
① 反应物中金属单质不能为 K、Ca、Na 等特别活泼的金属。
② 盐必须是溶液(即盐必须可溶于水),否则固体与固体常温下难反应。
金属、氧化物、酸、碱、盐之间的反应规律以及发生条件
(八种反应生成盐反应)
1. 活泼金属 + 酸 → 盐 + H2↑ 反应条件:
① 在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢生成氢气。
② 反应物中的酸不能为 HNO3 或浓 H2SO4 等氧化性酸。
例:Zn + 2HCl = ZnCl2 + H2
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O 6. 酸 + 盐 → 新盐 + 新酸
反应件:
① 初中阶段反应物中的酸一般指盐酸、硫酸、硝酸
② 盐是碳酸盐时可不溶,若不是碳酸盐,则要求可溶
③ 反应符合复分解反应发生的条件
反应条件:
① 参加反应的两种盐都必须可溶于水。
② 反应符合复分解反应发生的条件(生成物种至少有一种不溶于水)。
例:AgNO3 + NaCl = AgCl↓+ NaNO3 CaCO3 + NaCl → 不反应
BaCl2 + K2 SO4 = BaSO4↓+ 2KCl CuSO4 + NaCl → 不反应
③ 对金属来说,必须是活泼金属置换出盐中的不活泼金属。
④ 多种金属同时在盐溶液(或在混合溶液)中反应,反应的先后顺序要视
金属间的活动性来确定:金属活动性相差越大,置换反应越易发生(优
先反应)。
例:Fe + CuSO4 = FeSO4 + Cu
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
Zn + AgCl → 不反应 3. 金属氧化物 + 酸 → 盐 + H2O
SO2 + 2KOH = K2SO3 + H2O
CO2 + Cu(OH)2 → 不反应 5. 酸 + 碱 → 盐 + H2O
注意:中和反应一定是复分解反应, 但复分解反应不一定是中和反应。
反应条件:
酸如果是盐酸、硫酸、硝酸三种强酸,无论碱是否可溶,反应均可以进行。
例: HCl + NaOH = NaCl + H2O
第2页共2页
4. 非金属氧化物 + 碱 → 盐 + H2O(注:不是复分解反应) 注意:该类反应不属于复分解反应。因此只有盐和水生成的反应不一定是复
分解反应。
反应条件:
① 参加反应的碱必须可溶于水。
② 非金属氧化物通常指 CO2、SO2、SO3、SiO2 等酸性气体。
第1页共2页
例:CO2 + 2NaOH = Na2CO3 + H2O
例:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ AgNO3 + HCl = AgCl↓+ HNO3
CaCl2 + H2CO3 → 不反应 7. 碱 + 盐 → 新碱 + 新盐
反应条件:
① 参加反应的碱和盐都必须可溶于水。
② 反应符合复分解反应发生的条件(若反应物中盐不是铵盐,生成物中一定
反应条件:
2Na + CuSO4 = Na2SO4 + Cu(×)
① 反应物中至少有一种可溶于水。
② 酸常指 H2SO4、HCl、HNO3 等强酸。 例: Na2O + 2HCl = 2NaCl + H2O Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O CuO + H2SO4 = CuSO4 + H2O
有沉淀,若反应物中盐是铵盐,则生成物中可无沉淀)。
例:2NaOH + MgCl2 = Mg(OH)2↓+ 2NaCl
Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH KOH + NH4Cl = KCl + NH3↑+ H2O 8. 盐 + 盐 → 新盐 + 新盐
Cu(OH)2 + MgCl2 → 不反应
