第十七章 杂环化合物 练习及答案

第十七章 杂环化合物
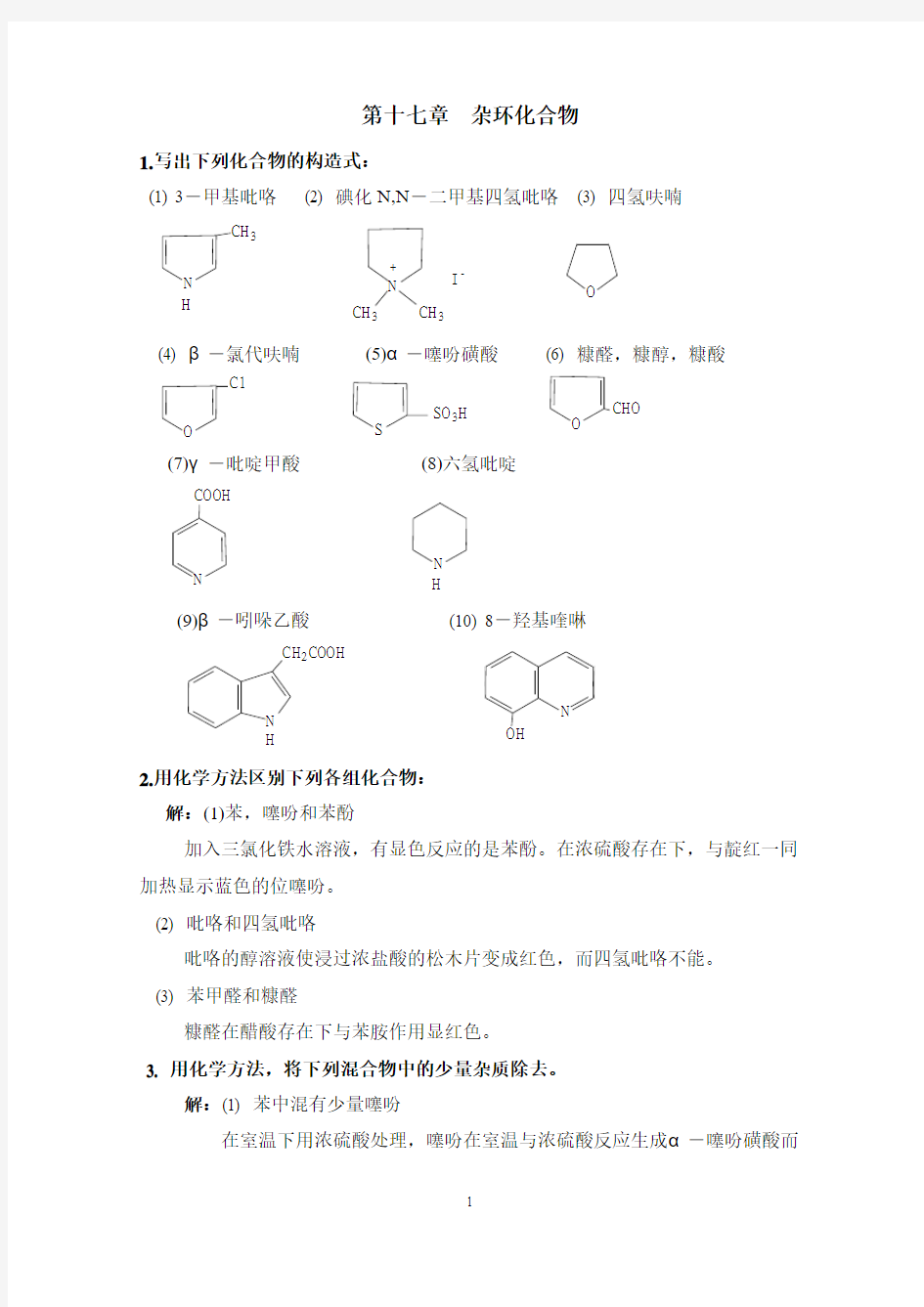
1.写出下列化合物的构造式:
(1) 3-甲基吡咯 (2) 碘化N,N -二甲基四氢吡咯 (3) 四氢呋喃
H
CH 3
N O
N CH 3
CH 3
+
I -
(4) β-氯代呋喃 (5)α-噻吩磺酸 (6) 糠醛,糠醇,糠酸
Cl
O S SO 3H
O
CHO
(7)γ-吡啶甲酸 (8)六氢吡啶
COOH
N
N H
(9)β-吲哚乙酸 (10) 8-羟基喹啉
N H
CH 2COOH
N
OH
2.用化学方法区别下列各组化合物: 解:(1)苯,噻吩和苯酚
加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 (2) 吡咯和四氢吡咯
吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 (3) 苯甲醛和糠醛
糠醛在醋酸存在下与苯胺作用显红色。 3. 用化学方法,将下列混合物中的少量杂质除去。
解:(1) 苯中混有少量噻吩
在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而
溶于浓硫酸,苯不反应。 (2) 甲苯中混有少量吡啶
用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。
(3) 吡啶中有少量六氢吡啶。
六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。
4. 试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反应而吡啶比苯难发生?
解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。
5. 完成下列反应式: 解:
1.
O
O
CHO
+
CH 3CHO
O
CH=CHCHO
2.
O
CHO
O
CH 2OH
+
3.
N
H /Pt
N H
4.
S
C
O C +
O O
AlCl 3
S
C O
HOOC 5.H 2/Pt
O
2HCl
Cl(CH 2)4Cl
2
NaCN
NC(CH 2)4CN
H 2O,H +
-
CH 3
CH 3
H O O
6.用箭头表示下列化合物起反应时的位置。
解:
1.
S
S
2.
S
COOH
3.
N
N CH 3
N CH 3
4.
S
O 2N
CH 3
O 23
5.
NO 2
S
2
6.
S
CH 3
7.
CH 3
OCH
3
CH 3
3
8.
N H
CH
3
H
3
7.将苯胺,苄胺,吡咯,吡啶,氨按其碱性由强至弱的次序排列: 解:苯胺,苄胺,吡咯,吡啶,氨的碱性强度顺序:
CH 2NH 2
NH 3
N
NH 2
N H
>
>
>
>
8.下列化合物那些具有芳香性? 解:具有芳香性的:
s
N N O N
CH 3
CH 3
N N
O
N
H
9.螵呤分子中,四个氮原子那些属于吡啶型?那些属于吡咯型? 解:1,2,3-氮原子属于吡啶型,4-氮原子属于吡咯型。
N
N
N
H
4
1
2
3
10.合成题:
解:(1)糠醛
1,4-丁二醇:
O
CHO +
H 2O
Cat
400
450C
O O
H ,Cat
O
H O,H
+
HOCH 2CH 2CH 2CH 2OH
(2)吡啶 2-羟基吡啶:
N
+
KNH
2
N
NH 2
NaNO ,H SO N
N 2HSO
4
50
%
N
OH
(3
)呋喃 5 -硝基糠酸:
O +
CH 3COCl
SnCl 4
O
COCH 3
Br 2,NaOH
O
COOH
HNO 3
(CH 3CO)2O
O
O 2N
COOH
94)甲苯,甘油 6-甲基喹啉:
CH 3
CH 3
CH 3
NH 2
HNO
H 2SO 4
NO 2
CH 2CH CH 2OH OH
OH
24
CH 3
NH 2
CH 2=CHCHO
CH =CHCHO
N H
CH 3
C H NO N
CH 3
(5)正丙醇,糠醛 α-甲基-β-(2-呋喃)丙烯酸:
O
O CH=CCOOH
CH 3CH 3CH 2CH 2OH
[O]
CH 3CH 2COOH
(CH 3CO)2O
(CH 3CH 2CO)2O CHO
(CH 3CH 2CO)2O
+
KCO
O
CH=CCOOK
CH 3
H 3O
+
O
CH=CCOOH
CH 3
11.杂环化合物C 5H 4O 2经氧化生成羧酸C 5H 4O 3。把此羧酸的钠盐与碱石灰作用,转变为C 4H 4O ,后者与金属钠不起作用,也不具有醛酮性质。原来的C 5H 4O 2的结构是什么?
解:原化合物的结构及各步反应式如下:
O
CHO
O CHO
O
COOH
O
CaO(NaOH)
C5H4O2
C5H4O3C
4
H4O
。
杂环化合物 练习及答案
第十七章杂环化合物 1.写出下列化合物的构造式: (1) 3-甲基吡咯(2) 碘化N,N-二甲基四氢吡咯(3) 四氢呋喃 (4) β-氯代呋喃(5)α-噻吩磺酸(6) 糠醛,糠醇,糠酸 (7)γ-吡啶甲酸(8)六氢吡啶 (9)β-吲哚乙酸(10) 8-羟基喹啉 2.用化学方法区别下列各组化合物: 解:(1)苯,噻吩和苯酚 加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 (2) 吡咯和四氢吡咯 吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 (3) 苯甲醛和糠醛 糠醛在醋酸存在下与苯胺作用显红色。 3. 用化学方法,将下列混合物中的少量杂质除去。 解:(1) 苯中混有少量噻吩 在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而溶于浓硫酸,苯不反应。 (2) 甲苯中混有少量吡啶 用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 (3) 吡啶中有少量六氢吡啶。 六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 4. 试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 5. 完成下列反应式:
解: 6.用箭头表示下列化合物起反应时的位置。 解: 1. 7 8 9 10 ( ( (11.C 5H 4O 2的 O C 5H 4O 3 C 4H 4O 。
备战高考化学易错题专题训练-认识有机化合物练习题附答案
备战高考化学易错题专题训练-认识有机化合物练习题附答案 一、认识有机化合物练习题(含详细答案解析) 1.当1mol某气态烃与2mol Cl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与4mol Cl2进行取代反应后,生成只含C、Cl两种元素的化合物。则该气态烃是( ) A.乙炔B.乙烯C.丁二烯D.丙炔 【答案】D 【解析】 【分析】 【详解】 1mol该气态烃与2molCl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,说明分子中含有2个C=C或1个C≡C键;所得产物再与Cl2发生取代反应时,若将氢原子全部取代,需要4mol Cl2,根据取代反应原理可知,该烃分子中加成产物含有4个H,即原烃中含有H原子为4,只有丙炔符合,故答案为D。 2.由环已烷、乙醇、乙醚组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数为 A.14.2% B.16% C.17.8% D.19.4% 【答案】A 【解析】 【分析】 环己烷的分子式为C6H12可以改写成(CH2)6,乙醇的分子式为C2H6O可以改写成 (CH2)2·H2O,乙醚的分子式为C4H10O,可以改写成(CH2)4·H2O,所以该混合物可以看成CH2与H2O构成的。 【详解】 由于该混合物中C的质量分数为72%,所以CH2的质量分数为: 12 72%=84% 14 ÷,那么 H2O的质量分数为:1-84%=16%,O元素的质量分数为: 16 16%14.2% 18 ?≈,A项正 确; 答案选A。 3.下列有关物质结构或性质的说法不正确的是() A.三联苯与四联苯互为同系物 B.可用燃烧法鉴别环乙烷、苯、CCl4 C.分子式为C5H10的烃存在顺反异构体
配位平衡习题及答案
配合平衡习题及答案 一、判断题: 1. Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 的易溶盐较多。() 2. 金属锌可以与过量的氨水反应生成氢气。() 3. Zn 、Cd 、Hg 的金属活泼性分别比Cu 、Ag 、Au 强。.............. () 4. [ Cu (NH3 )4 ]2+ 的空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。.........................................................................................................................() 5. Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为4 的螯合物。() 二、选择题: 1.下列物质在酸性溶液中可以将Mn2+氧化为MnO4-的是.................()。 (A) PbO;(B) Bi3+;(C) NaClO;(D) (NH4 )2 S2O8。 2. 下列金属中,延展性最好的是........................................................... ()。 (A) 银;(B) 金;(C) 铜;(D) 锌。 3. 下列反应中,配离子作氧化剂的是............................................. ()。 (A) [Cu (OH)4]2- 与甲醛反应;(B)[ Fe (CN)6]4- 与FeCl3 反应; (C) [Co (NH3 )6]2+ 与O2 反应;(D)[ Ag (NH3 )2]+ 与KI 反应。 4. 下列化合物中易溶于水的是............................................................. ()。 (A) Cu2O ;(B) CuCl ;(C) CuCl2 ;(D) CuI 。 5. 下列离子分别与Hg2+ 反应不生成沉淀的是........................ ()。 (A) 少量I- ;(B) OH-;(C) Sn2+;(D) Cl-。 6. 在酸度较大的水溶液中也不溶解的盐是( ) (A) Ag2SO4 (B) Ag3PO4 (C) Ag2CO3 (D) Ag2S 7. 在CuSO4溶液中加入过量的碳酸钠溶液,常形成的产物是( ) (A) Cu(HCO3)2 (B) CuCO3 (C) Cu2(OH)2CO3 (D) Cu(OH)2 8. 组成黄铜合金的两种金属是( ) (A) 铜和锡(B) 铜和锌(C) 铅和锡(D) 铝和铜 9. Cu+的磁矩是( ) (A) 3.88 (B) 5.0 (C) 2.83 (D) 0 10. 下述有关银的性质的正确论述是( ) (A) 从稀盐酸中置换出氢(B) 从浓盐酸中置换出氢 (C) 从氢碘酸中置换出氢(D) 从稀硫酸中置换出氢 11. 要从含有少量Cu2+离子的ZnSO4溶液中除去Cu2+离子最好的试剂是( ) (A) Na2CO3 (B) NaOH (C) HCl (D) Zn 12. 能共存于溶液中的一对离子是( ) (A) Fe3+和I-(B) Pb2+和Sn2+(C) Ag+和PO43-(D) Fe3+和SCN- 13. 欲除去CuSO4酸性溶液中少量Fe3+,加入下列试剂效果最好的是( ) (A) 氨水(B) NaOH (C) H2S水(D) Cu2(OH)2CO3 14. Cu2O 和稀H2SO4反应,最后能生成( ) (A) Cu2SO4+ H2O (B) CuSO4+ H2O (C) CuSO4+ Cu + H2O (D) CuS 15. 五水硫酸铜可溶于浓盐酸,关于所得溶液的下列说法中,正确的是( ) (A) 所得溶液成蓝色; (B) 将溶液煮沸时释放出氯气,留下一种Cu(I) 的配合物溶液; (C) 这种溶液与过量的氢氧化钠溶液反应,不生成沉淀; (D) 此溶液与金属铜一起加热,可被还原为一种Cu(I)的氯配合物。
2020-2021高考化学有机化合物的推断题综合题试题及详细答案
2020-2021高考化学有机化合物的推断题综合题试题及详细答案 一、有机化合物练习题(含详细答案解析) 1.根据下列转化关系,回答有关问题: 已知CH 3CHO 在一定条件下可被氧化为CH 3COOH 。 (1)A 的结构简式为________,C 试剂是________,砖红色沉淀是________(填化学式)。 (2)B 溶液的作用是__________。 (3)④和⑥反应的化学方程式及反应类型分别为: ④_______, _______________。 ⑥________, _________。 (4)由图示转化关系可知淀粉________(填“部分水解”或“完全水解”)。某同学取图中混合液E ,加入碘水,溶液不变蓝色,________(填“能”或“不能”)说明淀粉水解完全,原因是__________。若向淀粉中加入少量硫酸,并加热使之发生水解,为检验淀粉水解的情况所需的试剂是________。(填序号) ①NaOH 溶液 ②新制Cu (OH )2悬浊液 ③BaCl 2溶液 ④碘水 (5)在进行蔗糖的水解实验并检验水解产物中是否含有葡萄糖时,某同学的操作如下:取少量纯蔗糖加水配成溶液,在蔗糖溶液中加入3~5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入新制Cu (OH )2悬浊液,加热,未见砖红色沉淀。其原因是________(填字母)。 a .蔗糖尚未水解 b .蔗糖水解的产物中没有葡萄糖 c .加热时间不够 d .煮沸后的溶液中没有加碱液无法中和稀硫酸 【答案】CH 2OH (CHOH )4CHO 新制Cu (OH )2悬浊液 Cu 2O 中和稀硫酸 2CH 3CH 2OH +O 2Cu 加热 ???→2CH 3CHO +2H 2O 氧化反应 CH 3CH 2OH +CH 3COOH 垐?噲?CH 3COOCH 2CH 3+H 2O 酯化反应 部分水解 不能 I 2与过量的NaOH 溶液反应 ①②④ d 【解析】 【详解】 (1)淀粉在酸性条件下水解的最终产物是葡萄糖,葡萄糖在碱性条件下与新制Cu (OH )2悬浊液反应,所以水解后先加NaOH 溶液中和H 2SO 4后才可与新制Cu (OH )2悬浊液反应生成砖红色沉淀;故答案为: CH 2OH (CHOH )4CHO ;新制Cu (OH )2悬浊液;Cu 2O ; (2)淀粉水解后产物为葡萄糖,葡萄糖与新制Cu (OH )2悬浊液反应需要在碱性条件下,所以水解后先加NaOH 溶液中和H 2SO 4,故答案为:中和稀硫酸;
《配位化合物与配位滴定法》习题答案
《配位化合物与配位滴定法》习题答案 9-1 命名下列配合物,并指出中心离子、配位体、配位原子和中心离子的配位数。 (1)[CoCl 2(H 2O)4]Cl (2)[PtCl 4(en)] (3)[Ni Cl 2(NH 3)2] (4)K 2[Co(SCN)4] (5)Na 2[SiF 6] (6)[Cr(H 2O)2(NH 3)4]2 (SO 4)3 (7)K 3[Fe(C 2O 4)3] (8)(NH 4)3[SbCl 6]·2H 2O 9-2 已知磁矩,根据价键理论指出下列配离子中中心离子的杂化轨道类型和配离子的空间构型。 (1)[Cd(NH 3)4]2+ (μ=0 B M) (2)[PtCl 4]2- (μ=0 B M) (3)[Mn(CN)6]4- (μ=1.73 B M) ( 4 ) [CoF 6]3- (μ=4.9 B M)
(5)[BF 4]- (μ=0 BM) (6)[Ag(CN)2]- (μ=0 B M) 9-3 解释下列名词 (1)配位原子 (2)配离子 (3)配位数 (4)多基(齿)配位体 (5)螯合效应 (6)内轨型和外轨型配合物 (7)高自旋和低自旋配合物 (8)磁矩 答:见教材。 9-4 选择适当试剂,实现下列转化。 Ag →AgNO 3→AgCl ↓→[Ag(NH 3)2]Cl →AgBr ↓→Na 3[Ag(S 2O 3)2]→AgI ↓→K[Ag(CN)2] →Ag 2S ↓ 答:转化路线: ↓?→???→?→?→???→?↓?→????→?↓?→???→?- - - - - ?S Ag ]K[Ag(CN)AgI ])O [Ag(S Na AgBr ]Cl )[Ag(NH AgCl AgNO Ag 22232323NH 32232233 S KCN I O S Br O H Cl HNO 要点:应记忆题给各常见配合物和沉淀物的稳定转化顺序。 9-11 用EDTA 标准溶液滴定金属离子M ,试证明在化学计量点时, (1)() ' 2 1MY pK pMY pM -= (2))(lg 2lg )(lg M c K MY c MY += 证明:
第11章 杂环化合物答案
思考题答案 思考题11-1 命名下列化合物: (1)2-氯呋喃(2)2-乙酰噻吩(3)5-甲基咪唑(4)3-吡啶甲酸(5)5-氨基-2-羟基嘧啶(6)5-羟基吲哚(7)6-甲基-2-羟基嘌呤(9)8-羟基喹啉思考题11-2吡咯、呋喃、噻吩的硝化、磺化反应能否在强酸条件下进行?为什么? 答:不能,因为吡咯、呋喃、噻吩对酸不稳定,容易开环发生聚合反应。 思考题11-3吡咯与乙酸酐反应不形成N-乙酰基吡咯,而形成α-乙酰基吡咯,为什么? 答:吡咯亲电取代反应很容易进行。这是由于环上五个原子共有六个π电子,故π电子出现的几率密度比苯环大。换句话说,吡咯环上的杂原子N有给电子的共轭效应,能使杂环活化。所以,在亲电取代反应中的速度比苯环快的多。 思考题11-4比较苯、吡咯、吡啶环上发生亲电取代反应的活性顺序,并解释之。 答:吡咯>苯>吡啶。因为吡咯亲电取代反应很容易进行。吡咯环上的杂原子N有给电子的共轭效应,能使杂环活化。所以,在亲电取代反应中的速度比苯环快的多。而吡啶亲电取代反应很难进行。这是由于环上六个原子共有六个π电子,吡啶环中氮原子的电负性大于碳原子,使电子云会偏向氮原子,使得环上电子云密度比苯环小,称为缺电子的芳杂环或者少电子的芳杂环。所以吡啶的化学性质比苯更钝化,发生亲电取代反应更困难。 思考题11-5比较下列化合物的碱性强弱顺序: 答:二甲胺> 甲胺> 氨> 苯胺> 吡咯 习题答案 1.命名下列化合物或写出结构式: (1)2-甲基呋喃(2)2,3,4,5-四碘吡咯(3)4-甲基-2-硝基吡咯 (4)3-噻吩磺酸(5)2-呋喃甲醛(糠醛)(6)3-吡啶甲酰胺 (7)N-甲基咪唑(8)8-羟基喹啉(9)2-乙基-4-羟基噻唑 (10)2-甲基-5-氨基嘧啶(11)8-甲基-6-羟基嘌呤(12)3-羟基吲哚 2.将下列化合物按碱性递增的顺序排列: (1)乙胺>氨> 吡啶> 苯胺> 吡咯 (2)六氢吡啶> 吡啶> 嘧啶> 吡咯
有机化合物课后习题答案
有机化合物课后习题答案 第一章 绪论习题答案 1.说明有机化合物的特点。 答案: 有机化合物的特点是:数目繁多,结构复杂; 稳定性差,容易燃烧; 熔点、沸点较低;难溶于水;易溶于有机溶剂;反应速度慢;反应复杂,副产物多。 2.计算C 7H 7O 2N 的不饱和度并写出可能的结构式。 答案: 有机化合物的不饱和度计算公式为 ,代入数字得不饱和度 为5,所以可能的部分结构式分别是: 3.搞清下列各概念并思考各组概念的区别。 ① 均裂、异裂;②离子型反应、游离基反应;③亲电反应、亲核反应; ④键的极性和键的极化度;⑤键长、键角;⑥键能、键的离解能 答案: ①均裂——共价键断裂后,两个成键原子共用的一对电子由两个原子各保留一个。异裂——共价键断裂后,共用电子对只归属原来生成共价键的两个原子中的一个。 ②有离子参加的反应叫离子型反应。有自由基(游离基)参加的反应叫游离基反应。 ③由亲核试剂的进攻而发生的反应叫亲核反应。由亲电试剂的进攻而发生的反应叫亲电反应。 NO 2 NO 2 2 COOH COOH COOH NH 2 NH 2 NH 2 2 n -n -n 13 14+=?
④键的极性是由于成键原子的电负性不同而引起的。当成键原子的电负性不同时,核间的电子云密集区域偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的原子一端则带部分正电荷,键的正电荷重心与负电荷重心不重合,这样的共价键称为极性共价键。如HCl 分子中的H -Cl 键就是极性共价键。 键的极化度是指在外界电场的影响下,共价键的电子云重新分布。无论是非极性分子或极性分子的极化状态都将发生变化,使极性分子的极性增强,非极性分子变为极性分子。 ⑤键长(Bond length ): 指分子中两成键原子核间的平衡距离。 键角(Bond angle ):指分子中同一原子形成的两个化学键之间的夹角。键角是反映分子空间结构的重要因素。 ⑥键能(Bond energy ):在25℃和101.325kPa 压力下,以共价键结合的A 、B 两个原子在气态时使用键断裂,分解为A 和B 两个原子(气态)所消耗的能量叫做键能。 键离解能(Dissociation energy ): 一个共价键断裂所消耗的能量叫做共价键的离解能。 4.指出下列化合物中所含官能团的名称,并说明它们是哪类化合物? 答案: (1) (2) (3) CH 2OH OH CH 3OCH 3 (4)(5)(6)(9)(8) (7) CH 3CH 2C H O CH 3CHCOOH CH 3C OH O 2 NH 2CH 3 SO 3H NO 2 H 3C (1)OH O C H COOH NH 2 SO 3 H NO 2醇(2) OH 酚(3) 醚 (4) O 醛 (5)(6)C O OH 羧酸C 氨基酸 (7)磺酸胺 硝基化合物 (8)NH 2(9)
杂环化合物
第10章杂环化合物 §10.1 杂环化合物的分类和命名 10.1.1 分类 1、按照环的多少分类 ?单杂环:常见的是五元杂环和六元杂环,环上的杂原子有一个或两个。 ?五元杂环: ?六元杂环: ?吡喃没有芳香性,生成盐后则具有芳香性。 ?稠杂环:由苯环与单杂环或两个以上单杂环稠合而成的。 10.1.2 命名 常见的基础杂环多数是具有芳香性的,命名时作为杂环化合物的母核。 1、音译法 中文名称采用音译法,用带口字旁的同音汉字表示。 对于无特定名称的杂环化合物,中国化学会1980年颁布的有机化学命名原则规定: 采用“杂”字作介词,把杂环看作是相应的碳环母核中碳原子被杂原子置换后的衍生物来命名。 ?国外现在采用的Hantzsch-Widman系统,规范了10元以下一般杂环的词尾词干的书写
格式。 ?为了正确表明取代基位置,需将杂环母核编号,编号规则主要有: (1)含一个杂环原子的单杂环,从杂原子开始编号。 有时也使用希腊字母,把靠近杂原子的位置叫做α位,其次是β位,再其次是γ位。 (2)含两个及以上相同杂环原子的单杂环,编号从连有氢原子的杂原子开始,并使另一杂原子所在位次保持最小。 (3)含两个及以上不同杂环原子的单杂环,编号从价数小杂原子开始,价数相同时则从原子序数小的开始。 ?因此,常见杂原子编号优先顺序为O、S、N。 ?一般常见的稠杂环有特定的编号,或是沿用习惯。 §10.2 五元杂环化合物 10.2.1 结构和物理性质 1、结构 这三种杂环上的原子都是sp2杂化,为平面结构。 ?每个碳原子垂直于环平面的p轨道有一个电子,杂原子垂直于环平面的p轨道有二个电子。
14-杂环化合物习题答案
练习14-1:命名下列杂环化合物: (1) (2) (3) (4) (5) (6) 答:略 练习14-2: (1)为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯不能? (2)为什么呋喃、噻吩及吡咯比苯容易进行亲电取代反应? (3)呋喃在溴的甲醇溶液中反应,没有得到溴化产物,而是得2,5-二甲氧基二氢呋喃,请写出相应的反应方程式并解释原因。 答:(1)因为呋喃的芳香性较弱,呋喃及其衍生物可以容易地进行 Diels-Alder 反应,吡咯只能和极活泼亲双烯体发生Diels-Alder 反应,而噻吩则难于发生Diels-Alder 反应。 (2)呋喃、噻吩、吡咯具有芳香的共轭体系,因此可以发生芳香的亲电取代反应,由于这些环上的杂原子有给电子的共轭效应,能使杂环活化,与苯比较,反应较易进行。 (3) 反应过程首先是甲醇与溴反应,生成次溴酸甲酯,次溴酸甲酯很不稳定,形成后立即与具有共轭双烯性质的呋喃进行反应。 练习14-3: 2,5-二甲氧基二氢呋喃经催化氢化后再用酸性水溶液处理,得到什么化合物,请写出相应的反应方程式并标明反应类别。 答:琥珀醛 练习14-4: 2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化,取代主要发生在5位,说明其原因。 答:氨基是强供电子基,使吡啶环上电子云密度提高,所以2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化。5位是氨基的对位和吡啶氮原子的间位,亲电试剂进攻5位时,所产生正电荷能够离域到氨基氮原子上,活化能低。进攻3位的电子效应与5位类似,但存在一定空间效应。所以2-氨基吡啶进行硝化或磺化取代主要发生在5位。 练习14-5:如何理解γ-甲基吡啶的甲基的酸性比β-甲基吡啶的强这一事实? 答:可以从共轭碱的稳定性去解释,γ-甲基吡啶共轭碱的负电荷可以离域到电负性大的氮原子上,而β-甲基吡啶的共轭碱则不能。因此,γ-甲基吡啶甲基上的氢更容易电离,酸性 O CH 2COOH S CH 3O CH 2COOH N H CH 2CH 2OH S N H 3C HOH 2CH 2C N NO 2O +Br 3CH 3OH O H H Br 3O H OCH 3H H 3CO O H OCH 3H H 3CO O H OCH 3H H 3CO H +, H 2O CH 2 H 2CHO CHO
高考化学培优专题复习认识有机化合物练习题含答案
高考化学培优专题复习认识有机化合物练习题含答案 一、认识有机化合物练习题(含详细答案解析) 1.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。它能在酸性溶液中能发生如下反应: (1)有机物(I)在铂催化下与足量的氢气发生加成反应生成物质X,X所含的官能团的名称是 __________;X的结构简式为__________。 (2)有机物(II)的化学式为_______;分子中化学环境不同的氢原子共有_____种。 (3)下列关于MMF说法正确的是__________(选填字母编号)。 a.能溶于水 b.1 mol MMF最多能与3 mol NaOH完全反应 c.能发生取代反应和消去反应 d.镍催化下1 mol MMF最多能与6 mol H2发生加成反应 (4)1 mol的有机物(I)在单质铜和氧气的作用下可以氧化为醛基的—OH有____mol;有机物(II)在加热和浓硫酸的条件下发生消去反应的化学方程式为_________。 【答案】羧基、羟基 C6H13O2N 5 b 1 【解析】 【分析】 (1)有机物(I)在铂催化下与足量的H2发生加成反应生成物质X,和H2发生加成反应的是苯环和碳碳双键,根据有机物(Ⅰ)结构判断X的结构,根据X的结构判断含有的官能团。 (2)根据断键方式和原子守恒判断有机物(Ⅱ)的化学式,断键物质为酯基,根据氢原子的物质判断其种类。 (3)根据MMF的结构判断其性质,MMF中含有的官能团是酚羟基、碳碳双键、酯基,可能具有酚、酯和烯烃的性质。 (4)连有醇羟基的碳原子上有2个氢原子时,醇羟基才能发生催化氧化生成醛;醇若能发生消去反应,消去反应后生成物含有碳碳双键。 【详解】 (1)有机物(Ⅰ)在铂催化下与足量的H2发生加成反应生成物质X,能和H2发生加成反应的是
第6章 配位滴定法(课后习题及答案)
第六章 配位滴定法 思考题与习题 1.简答题: (1)何谓配位滴定法?配位滴定法对滴定反应有何要求? 答:以配位反应为基础的地点分析方法称为配位滴定法。配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。 (2)EDTA 与其金属离子配合物的特点是什么? 答:EDTA 具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;EDTA 与金属离子形成配位化合物的配位比几乎均为1:1;EDTA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。 (3)配位滴定可行性的判断条件是什么? 答:MY M K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利? 答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。配合物与氢离子、氢氧根离子的副反应对滴定分析有利。 (5)何谓指示剂的封闭现象?怎样消除封闭? 答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。可加掩蔽剂消除指示剂的封闭现象。 (6)提高配位滴定选择性的条件与措施有哪些? 答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法掩蔽干扰离子;3)分离干扰离子。 2.名词解释 (1)酸效应
答:由于H+的存在使配位剂参加主反应能力降低的现象。 (2)酸效应系数 答:定量表示酸效应进行的程度的系数称为酸效应系数。 (3) 配位效应 答:由于存在其他配位剂L 与金属离子M 配位使金属离子参加主反应能力降低的现象。 (4)配位效应系数 答:定量表示配位效应进行的程度的系数称为配位效应系数。 (5)金属指示剂的变色点 答:]n I []MIn ['=当点。变,此即指示剂的变色时,指示剂发生颜色突 3.计算题: (1)用EDTA 滴定法检验血清中的钙。取血清100μl ,加KOH 溶液2滴和钙红指示剂1~2滴,用0.001042mol/LEDTA 滴定至终点,用去0.2502ml 。计算此检品中Ca 2+含量(Ca 2+mg/100ml )。若健康成人血清中Ca 2+含量指标为 9~11mg/100ml ,此检品中Ca 2+含量是否正常?(尿中钙的测定与此相似,只是要用柠檬酸掩蔽Mg 2+) 解: E D T A C a S Ca ()100Ca%(0.0010420.2502)40.0810010.45(mg /100ml)(40.08g/mol)0.1 cV M V M ??=???=== (2)精密称取葡萄糖酸钙(C 12H 22O 14Ca·H 2O )0.5403g ,溶于水中,加入适量钙指示剂,用0.05000mol/LEDTA 滴定至终点,用去23.92ml 。计算此样品中葡萄糖酸钙含量。(1222142C H O Ca H O M =448.7) 解:
11 配位化合物及配位平衡习题解答
11配位化合物及配位平衡习题 (p368-369)参考解答 1.解答: 序号 粒子 命名 中心离子 配体 配位原子 配位数 1 [CoOH (NH 3)4(H 2O)]2+一羟基.四氨. 一水合钴(III) 离子 Co(III)OH - 、NH 3、H 2O O 、N 、O 6 2 [Co(NO 2)3(NH 3)3] 三硝氨和钴 (III) Co(III)NO 2-、NH 3 N 、N 6 Pt(II)NH 3N 4 3 [Pt(NH 3)4][PtCl 6]六氯合铂(II) 酸四氨合铂 (IV) Pt(IV)Cl -Cl 6 4 Ag 2[HgI 4] 四碘合汞(II) 酸银 Hg(II)I -I 4 5 [Co(en)3]Cl 3 氯化三乙二 胺和钴(III) Co(III)en N 6 6 [Fe(CN)5(Py)] 3-五氰.一吡啶合铁(II)离子 Fe(II)CN -、Py C 、N 6 7 Cu[SiF 6] 六氟合硅(IV) 酸铜 Si(IV)F - F 6 8 [CoBr(NH 3)5]SO 4 硫酸一溴.五 氨合钴(III) Co(III) Br -、NH 3 Br 、N 6 2.解答:(1) [Ni(CN)4]2- (2) K[PtCl 5(NH 3)] (3) [Cu(en)2]Cl 2 (4) [CoCl 2(NH 3)4]Cl (5) [PtCl 2(NH 3)2] 3.解答: 4.解答: 粒子 自旋状态
(1)Fe(en)22 + 高自旋 外轨型 (2)Mn(CN)64- 低自旋 内轨型 (3)K 3[Fe(CN)6] 低自旋 内轨型 (4)Pt(CN)42 - 低自旋 内轨型 5.解答:[Fe(H 2O)6]2 +:高自旋,2g 和e g 电子排布为: 磁矩:μ= B.M 9.4 [Fe(CN)6]2 -:低自旋, t 2g 和e g 电子排布为: 磁矩为:μ= B.M 06.解答: [Ag + ]= 4.0×10-7mol·L -17.解答:无AgI 沉淀生成。 8.解答: K θf =3.5×1012 9.解答: E θ (AuCl 4- /Au)= -1.04V 10.解答:; 117 3L mol 10 8.2]Al [??+?×=13-4L mol 104.1]AlF [???×=13-25L mol 101.7]AlF [???×=; 13-36L mol 104.1]AlF [???×=11.解答:(1) [Mg 2+]=6.2×10-5 mol ?L ?1; (2) [Mg 2+]=3.8×10-8mol ?L ?1 12.解答: L mol 107.3 [Y] -1-11?×=13.解答:lg c =7.75>6,可以标定。 θ/ ZnY K 14.解答:lg c =9.21>6,可以滴定。 θ/ZnY K 15.解答:=7.73>6,可以准确滴定。 θ/ CuY lg cK 16.解答:pH=6.00时不能直接滴定Mg 2+;pH min =9.66(此时基本不生成沉淀) 17.解答:(1)可进行分别滴定。(2)滴定Zn 2+适宜的pH 范围(3.97,6.38)。 18解答:(1)lg αZn =5.10; (2)lg K Zn'Y'= 10.95; (3) mol ?L ?1 ; [Zn 2+]=6.4×10080.0][Zn /=-7mol ?L ?1 19.解答:(1)总硬度(CaCO 3)= 1 L mg 1.332??(2)Ca 含量(CaCO 3)= 1L mg 7.203??Mg 含量(MgCO 3)= 1L mg 2.97??20.解答: 结构组成 AgCl 沉淀质量 [CrCl 2(H 2O)4]Cl·2H 2O 53.83g [CrCl(H 2O)5]Cl 2·H 2O 107.7g [Cr(H 2O)6]Cl 3 161.5g 21.解答:(1) [Fe(OH)(H 2O)5]2+ no isomers (2) [RuBr 2(NH 3)4]+ have 2
七元杂环化合物的合成学生讲义
七 一、二、心血反应三、1.所球形瓶 2.3. 薄用验 七元杂环化实验目的1、了解并2、了解七3、掌握薄4、掌握低5、理解通 实验原理苯并二氮血管和抗病应合成该类仪器与试所需仪器:形冷凝管,所需试剂:苯薄层色谱所验钞机替代化合物2,4 并掌握羟醛七元含氮杂薄层色谱板低熔点固体通过薄层色理 氮杂类化合毒药物。本类化合物。反 O Ph 试剂 三口圆底烧温度计,温苯甲醛,苯所需仪器:硅代);溶剂需4-二苯基-2醛缩合反应;杂环化合物的板(TLC )监体化合物的重色谱法和红外合物是一类本实验由苯反应式如下+Ph O +烧瓶(100 m 温度计套管苯乙酮,氢氧硅胶板一大需要甲醇、乙实验十一2,3-二氢 的合成; 监测反应的重结晶方法外光谱法分类重要的七甲醛和苯乙下: NH 2NH 2E mL& 250mL 管,电磁搅拌氧化钠,邻大块;展缸两乙酸乙酯、一 -1H -1,5-苯的原理及操作法 分析有机反应元杂环化合乙酮首先合成Ph EtOH L ),单口圆拌(或机械邻苯二胺、两个;点样二氯甲烷和 苯并二氮杂作; 应及反应机合物,常被成查尔酮,Ph O N H N Ph Ph 底烧瓶,恒械搅拌),布哌啶、乙醇管一盒;紫和石油醚。杂的合成机理的方法 被用作镇静剂再与邻苯二 恒压滴液漏斗布氏漏斗,抽醇 紫外灯一台 成 剂、二胺斗,抽滤(可
四、1)醛、温度半时至1向体重结2)3.54回流晶体洗脱六、实验步骤查尔酮的合在装有滴6.0 g(50 m 度在5±2o 时,体系开15-20 o C ,并体系中加入结晶,得到 2,4-二苯基在装有回4g(17 mmol 流4 h 后,得体, 过滤,滤脱)分离纯 注意事项1. 液体化称量,2. 制备查3. 查尔酮能够实4. 查尔酮和抽滤5. 做好实等均需6. 使用薄洗。 骤 合成 滴液漏斗和温mmol)苯乙酮C ,用滴液漏开始出现浑浊并继续搅拌入50mL 冷水浅黄色晶体基-2,3-二氢-1流冷凝管的l)查尔酮和得深红色溶滤饼用无水纯化, 得黄色项 化合物,通注意不要查尔酮的反酮熔点较低实现重结晶酮重结晶时滤瓶必须洗实验记录,如需及时记录薄层色谱板温度计的10酮和25mL 漏斗滴加1浊,然后浅拌反应0.5h 后水再过滤),体8.0~8.4 g 1H -1,5-苯并的100 mL 三和25mL 无水溶液,将反应水乙醇重结晶色晶体2.5g,通过量筒量取要溅洒样品。反应温度不宜低,重结晶时晶。冷却后,时,如果体系洗干净,贴滤如重结晶时录。 板时,不要蘸00 mL 三口乙醇,电磁12.5 mL 的浅黄色固体逐后,出现大,并用水洗g, 产率77~并二氮杂三口烧瓶中水乙醇,电磁应混合物浓晶或硅胶柱, 熔点128取体积来计 宜过高,过时易呈现熔若加入晶系比较浑浊滤纸时,需时该加入多蘸水;放展口烧瓶中,加磁搅拌,用10%NaOH 逐渐增多),大量浅黄色固洗涤至中性,~81%,熔点的合成 中,加入1.8磁搅拌,再浓缩至约20柱层析(乙酸-129℃, 产计算体积;固过高易生成副熔融状态,必晶种,会加速浊,则需要过需用水润湿才少溶剂等,展开剂(流动加入5.2 g(冰水浴冷却H 水溶液(,滴加完毕固体。过滤,得到的固点54-55℃84g(17 mm 再加入0.2 m 0 mL ,放入酸乙酯和石产率49%。固体化合物副产物。 必须加入溶速结晶的形过滤。过滤才能贴紧。每次TLC 动相)的展(50 mmol)苯 却至5o C ,控(当加入大约毕后,恢复温生成的固体固体用无水乙℃。 mol)邻苯二胺mL 哌啶,加入冰箱析出黄石油醚混合溶 物,则通过天溶剂到呈均相形成。 滤时,布氏漏 板的具体情展缸也不要用苯甲控制约一温度 体(可乙醇胺、 加热黄色溶剂天平相才漏斗情况用水
14杂环化合物习题答案
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 14杂环化合物习题答案 练习 14-1: 命名下列杂环化合物: (1)(2)(3)(4)(5)(6)答:略练习 14-2: (1)为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯不能?(2)为什么呋喃、噻吩及吡咯比苯容易进行亲电取代反应?(3)呋喃在溴的甲醇溶液中反应,没有得到溴化产物,而是得 2,5-二甲氧基二氢呋喃,请写出相应的反应方程式并解释原因。 答: (1)因为呋喃的芳香性较弱,呋喃及其衍生物可以容易地进行Diels-Alder 反应,吡咯只能和极活泼亲双烯体发生 Diels-Alder 反应,而噻吩则难于发生 Diels-Alder 反应。 (2)呋喃、噻吩、吡咯具有芳香的共轭体系,因此可以发生芳香的亲电取代反应,由于这些环上的杂原子有给电子的共轭效应,能使杂环活化,与苯比较,反应较易进行。 (3)反应过程首先是甲醇与溴反应,生成次溴酸甲酯,次溴酸甲酯很不稳定,形成后立即与具有共轭双烯性质的呋喃进行反应。 练习 14-3: 1 / 7
2,5-二甲氧基二氢呋喃经催化氢化后再用酸性水溶液处理,得到什么化合物,请写出相应的反应方程式并标明反应类别。 答: 琥珀醛练习 14-4: 2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化,取代主要发生在 5 位,说明其原因。 答: 氨基是强供电子基,使吡啶环上电子云密度提高,所以 2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化。 5 位是氨基的对位和吡啶氮原子的间位,亲电试剂进攻 5 位时,所产生正电荷能够离域到氨基氮原子上,活化能低。 进攻 3 位的电子效应与 5 位类似,但存在一定空间效应。 所以 2-氨基吡啶进行硝化或磺化取代主要发生在 5 位。 练习 14-5: 如何理解-甲基吡啶的甲基的酸性比-甲基吡啶的强这一事实?答: 可以从共轭碱的稳定性去解释,-甲基吡啶共轭碱的负电荷可以离域到电负性大的氮原子上,而-甲基吡啶的共轭碱则不能。 因此,-甲基吡啶甲基上的氢更容易电离,酸性OCH 2 COOHS CH 3OCH 2 COOHNHCH 2 CH 2 OHSNH 3 CHOH 2 CH 2 CNNO 2O+ Br 2CH 3 COOKCH 3 OHOHBrHBrCH 3 OHOHOCH 3HH 3 COOHOCH 3HH 3 CO催化加氢OHOCH 3HH 3 COH + , H 2 OCH 2 H 2 CCHOCHO更强。
最简单的有机化合物——甲烷习题及答案
最简单的有机化合物——甲烷习题及答案 可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 C:12 O:16 S:32 Cl:35.5 一、选择题(本题包括15小题,每小题只有一个正确答案) 1.下列有关甲烷的说法中错误的是( ) A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的 B.天然气的主要成分是甲烷 C.甲烷是没有颜色、没有气味的气体,极易溶于水 D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂 2.下列关于甲烷性质的说法中,错误的是()A.甲烷是一种非极性分子 B.甲烷分子具有正四面体结构 C.甲烷分子具有极性键 D.甲烷分子中H-C—H的键角为90℃ 3.下列物质在一定条件下可与CH4发生化学反应的是()A.氯水B.溴水C.氧气D.酸性KMnO4溶液 4.将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是() A.CH3Cl B.CH2Cl2C.CCl4D.HCl 5.下列气体在氧气中充分燃烧后,其产物既可使无水硫酸铜变蓝,又可使澄清石灰水变浑浊的是() A.SO2B.CH4C.H2D.CO 6.下列有机物常温下呈液态的是()A.CH3(CH2)2CH3B.CH3(CH2)15CH3 C.CHCl3D.CH3Cl 7.正己烷的碳链是()A.直线形B.正四面体形C.锯齿形D.有支链的直线形 8.下列数据是有机物的式量,其中可能互为同系物的一组是()A.16、30、58、72 B.16、28、40、52 C.16、32、48、54 D.16、30、42、56 9.在同系物中所有同系物都是()A.有相同的分子量 B.有不同的通式 C.有相同的物理性质 D.有相似的化学性质 10.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是
(完整版)配位化合物习题及解析
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
有机化学课后答案第十七章 杂环化合物
第十七章杂环化合物 一、写出下列化合物的构造式: 1,3-甲基吡咯 2,碘化N,N-二甲基四氢吡咯 3,四氢呋喃 4,β-氯代呋喃 5,α-噻吩磺酸 6,糠醛,糠醇,糠酸 7,γ-吡啶甲酸 8,六氢吡啶 9,β-吲哚乙酸 10,8-羟基喹啉 二、用化学方法区别下列各组化合物: 1,苯,噻吩和苯酚 解:加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 2,吡咯和四氢吡咯 解:吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 3,苯甲醛和糠醛 解:糠醛在醋酸存在下与苯胺作用显红色。 三、用化学方法,将下列混合物中的少量杂质除去。 1,苯中混有少量噻吩 解:在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而溶于浓硫酸,苯不反应。 2,甲苯中混有少量吡啶 解:用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 3,吡啶中有少量六氢吡啶。 解:六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 四、试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反
应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 五、完成下列反应式: 六、用箭头表示下列化合物起反应时的位置。 过量CH 3I 溴化 浓 稀 己二酸 己二胺
七、将苯胺,苄胺,吡咯,吡啶,氨按其碱性由强至弱的次序排列:解:苯胺,苄胺,吡咯,吡啶,氨的碱性强度顺序: 八、下列化合物那些具有芳香性? 的溴化的碘化的硝化的溴化的硝化的硝化的硝化
