第五章玻璃的着色与脱色
《玻璃工艺学》教学大纲

《玻璃工艺学》课程教学大纲英文名称: Glasses Technology课程编码:E014404课内教学时数:80学时,其中课堂授课64学时,实验16学时。
学分:5学分;适用专业:无机非金属材料工程本科开课单位:应用化学与环境工程系撰写人:王秋芹审核人:制定(或修订)时间:2014年8月一、课程的性质和任务玻璃工艺学是无机非金属材料专业的主要专业选修课程之一。
本课程旨在使学生掌握玻璃工艺的同时,培养学生实践能力,培养自学、讲解、协作和分析的综合能力。
要求学习本课程前应修完普通物理、材料物理、普通化学、材料科学基础、材料制备技术、无机材料化学、玻璃与非晶态材料等课程。
开设这门课的目的是让学生了解玻璃的种类、结构特点、基本性能、原料组成和制备工艺,了解玻璃在各个领域的应用现状和发展趋势.通过这门课的学习使学生对玻璃的性能和生产工艺过程有一个初步的掌握。
二、课程教学内容的基本要求、重点和难点第一单元玻璃的定义与结构㈠基本要求了解玻璃的发展历史,玻璃的发展前景,玻璃的通性,玻璃的结构理论,掌握玻璃组成、结构与性能之间的关系。
了解玻璃结构的研究方法.㈡教学重点玻璃的结构理论㈢教学难点玻璃组成、结构与性能之间的关系㈣教学内容1、玻璃的定义2、玻璃的通性3、玻璃的结构(1)玻璃的结构理论(2)传统玻璃结构(3)重金属玻璃结构(4)非氧化物玻璃的结构(5)金属玻璃的结构(6)有机玻璃的结构。
4、玻璃组成、结构与性能之间的关系(1)玻璃的阳离子分类(2)玻璃组成对结构的影响(3)结构对性质的影响。
5、玻璃结构的研究方法第二单元玻璃的形成与规律㈠基本要求通过本章的教学使学生了解玻璃形成方法,初步了解各种氧化物在玻璃熔体中的作用,理解玻璃的类型及结构学说,掌握玻璃的生成规律及玻璃成分、结构和性能之间的关系,领会玻璃的生成规律。
㈡教学重点玻璃的类型及结构学说。
㈢教学难点玻璃形成的动力学,热力学。
㈣教学内容1、玻璃形成物资(1)结晶化学理论(2)氧化物在玻璃中的作用2、玻璃形成方法(1)熔体冷却法(2)气相制备技术(3)液相制备技术(4)固相制备技术。
玻璃工艺学复习资料

玻璃⼯艺学复习资料第⼀章玻璃的定义与结构1、解释转变温度、桥氧、硼反常现象和混合碱效应。
转变温度:使⾮晶态材料发⽣明显结构变化,导致热膨胀系数、⽐热容等性质发⽣突变的温度范围。
⾮桥氧:仅与⼀个成⽹离⼦相键连,⽽不被两个成⽹多⾯体所共的氧离⼦则为⾮桥氧。
桥氧:玻璃⽹络中作为两个成⽹多⾯体所共有顶⾓的氧离⼦,即起“桥梁”作⽤的氧离⼦。
硼反常性:在钠硅酸盐玻璃中加⼊氧化硼时,往往在性质变化曲线中产⽣极⼤值和极⼩值,这现象也称为硼反常性。
混合碱效应:在⼆元碱玻璃中,当玻璃中碱⾦属氧化物的总含量不变,⽤⼀种碱⾦属氧化物逐步取代另⼀种时,玻璃的性质不是呈直线变化,⽽是出现明显的极值。
这⼀效应叫做混合碱效应。
2、玻璃的通性有哪些?各向同性;⽆固定熔点;介稳性;渐变性和可逆性;①.各向同性玻璃态物质的质点总的来说都是⽆规则的,是统计均匀的,因此,它的物理化学性质在任何⽅向都是相同的。
这⼀点与液体类似,液体内部质点排列也是⽆序的,不会在某⼀⽅向上发现与其它⽅向不同的性质。
从这个⾓度来说,玻璃可以近似地看作过冷液。
②.⽆固定熔点玻璃态物质由熔体转变成固体是在⼀定温度区域(软化温度范围)内进⾏的,(从固态到熔融态的转变常常需要经历⼏百度的温度范围),它与结晶态物质不同,没有固定的熔点。
③.介稳性玻璃态物质⼀般是由熔融体过冷⽽得到。
在冷却过程中粘度过急剧增⼤,质点来不及作有规则排列⽽形成晶体,因⽽系统内能尚未处于最低值⽽⽐相应的结晶态物质含有较⾼的能量。
还有⾃发放热转化为内能较低的晶体的倾向。
④.性质变化的渐变性和可逆性玻璃态物质从熔融状态到固体状态的过程是渐变的,其物理、化学性质变化是连续的和可逆的,其中有⼀段温度区域呈塑性,称“转变”或“反常”区域。
3、分别阐述玻璃结构的晶⼦学说和⽆规则⽹络学说内容。
答:(1)玻璃的晶⼦学说揭⽰了玻璃中存在有规则排列区域,即有⼀定的有序区域,这对于玻璃的分相、晶化等本质的理解有重要价值,但初期的晶⼦学说机械地把这些有序区域当作微⼩晶体,并未指出相互之间的联系,因⽽对玻璃结构的理解是初级和不完善的。
玻璃工艺玻璃的着色和脱色

(2)亮度brightness 垂直观察物的每单位投射面积上的光强。
(3)色调hue 色调主波长 指透过率最大的波长。
(4)色饱和度(纯度P)saturation 主波长在消色混合中所占的比例。 (2)(3)(4)是用于区别彩色的。 2. X-Y颜色图(自学)
?色品图中哪个区域的颜色饱和度最高?
3. 着色玻璃的分类 (1)光吸收型着色玻璃 离子着色 高能辐射着色
1802年生理学家汤麦斯·杨根据人眼的视觉生理特征提出了 新的三原色理论。他认为色光的三原色并非红、黄、蓝,而是 红、绿、紫。这种理论又被物理学家马克思韦尔证实。他通过 物理试验,将红光和绿光混合,这时出现黄光,然后掺入一定 比例的紫光,结果出现了白光。此后,人们才开始认识到色光 和颜料的原色及其混合规律是有区别的。
(8)铜
Cu0 红色、金星。 Cu+ 3d全充满,无 色。Cu2+天蓝色,与铬共用可制绿色 信号玻璃。
在钠硼玻璃中随钠的增多 绿→青绿→蓝
稀土金属 主要为f-f 跃迁,着色稳定。 (9)铈 Ce4+ 强烈吸收紫外线,可见光透过率高。
紫外吸收带进入可见光区产生淡黄色。
铈钛黄 不同基玻璃、比例可得黄、金黄、棕、蓝等 色。
反应平衡受到温度、气氛、时间等的影响。
·温度升高,利于高价离子分解 ·气氛 还原气氛利于高价离子降价 ·时间 时间延长,利于高价离子降价 d. 光照和热处理 ②非着色离子的影响 a. 阳离子场强
氧离子的有效电场q是可变的,受阳离子场强的作 用改变。高场强阳离子对氧的极化作用强,使q减小。 ∵Δ∝q,∴吸收光波长向长波方向移动。
把两种或多种色并置于一个圆盘上,通过动力令其快速 旋转,而看到的新的色彩。颜色旋转混合效果在色相方面与 加法混合的规律相似,但在明度上却是相混各色的平均值。 B:空间混合:
(玻璃工艺学) 教学大纲06年3月11日

《玻璃工艺学》教学大纲课程编号:083077课程名称:玻璃工艺学英语名称:课程类型:专业限选课总学时:48 讲课学时:44 实验学时:4学分:3适用对象:材料科学与工程无机材料专业方向先修课程:材料科学、材料工程、热工工程和设备、工业窑炉一、课程性质、目的和任务玻璃工艺学是无机非金属材料专业的主要专业课。
主要讲授玻璃组成结构物理化学性能、生产工艺过程及设备及各种制品的生产工艺和玻璃加工。
目的是使学生掌握玻璃生产制备的基本原理、工艺过程和设备,使之胜任玻璃生产工艺工程师的基本技术要求。
教学基本要求玻璃工艺学课程教学主要包括生产实习、课堂教学和实验教学三部分内容。
生产实验内容主要是分解掌握玻璃生产工艺过程,从原料选择配合料制备、玻璃熔制和熔制设备、玻璃成型工艺和成型设备、玻璃退火工艺和退火设备、动力、运输和总图布置以及玻璃加工工艺过程及设备。
生产实习在玻璃生产厂家现场实施。
二、教学内容及要求课程教学内容主要以西北轻工业学院主编的《玻璃工艺学》和武工大出版社龙逸主编《玻璃加工》为主要教学参考书,主要讲授玻璃组成、结构、物理化学性能、生产工艺原理及过程设备、各种玻璃制品的生产工艺和玻璃加工工艺过程及设备。
§ 1.绪论:玻璃品种、特性、应用及行业概况§ 2.玻璃物理化学特性2.1玻璃组成、结构2.2玻璃生成规律2.3玻璃体和熔体相变2.4玻璃的粘度2.5玻璃的表面特性和化学稳定性2.6玻璃机械和热学性能2.7玻璃的光学性能2.8玻璃着色和脱色2.9玻璃性能测试技术和设备§ 3.玻璃工艺学基础3.1玻璃原料、配合料制备过程及设施3.2玻璃的熔制过程工艺和玻璃体缺陷3.3玻璃熔制设备3.4玻璃的成型工艺和成型设备3.5玻璃的退火及淬火工艺§ 4.玻璃制品生产工艺4.1平板和浮法玻璃生产工艺及设备4.2瓶罐和器皿生产工艺及设备4.3药用和仪器玻璃生产工艺及设备4.4光学和颜色玻璃生产工艺4.5微晶玻璃和搪瓷玻璃生产工艺4.6光源和电真空玻璃生产工艺4.7玻璃纤维和光导纤维生产工艺§ 5.加工玻璃的品种、应用、工艺过程和经济分析5. 1镀膜玻璃和玻璃镜5. 2夹层玻璃5. 3钢化玻璃5.4中空玻璃5.5釉面彩饰玻璃5.6玻璃加工预前处理过程四、实践环节生产实习(生产现场工艺过程设备)工艺设计(设计、规划、技术经济分析)实验教学(综合实验和课程实验)五、课外习题及课程讨论玻璃品种成份设计、性能计算、料方计算玻璃新品种的应用和工艺的新进展六、教学方法与手段1.课堂讲授、专题讨论2.生产实习、工艺实验、综合实验3.工艺设计、窑炉设计八、考核方式考核考查结合,课程部分闭卷或开卷考试,习题、讨论、实习、设计、实验、考查评定。
玻璃化学知识点总结

玻璃化学知识点总结玻璃化学第一章1玻璃的定义:玻璃是一种具有无规则结构的非晶态固体,其原子不像晶体那样在空间作长程有序的排列,而近似于液体那样具有短程有序。
2玻璃的特性:①各向同性: 玻璃体在任何方向都具有相同的物理化学性质。
就是说,玻璃态物质各个方向的硬度、弹性模量、热膨胀系数、热传导系数、折射率、导电率等都是相同的,而非等轴晶系的晶体具有各向异性。
②介稳性玻璃处于介稳状态,就是说,玻璃态物质是由熔融体过冷却或其它方法形成玻璃时,系统所含有的内能并不处于最低值③性质的可变性玻璃的成分在一定的范围内可以连续变化,与此相应玻璃的性质也随之发生连续的变化。
④性质变化的可逆性:玻璃在固态和熔融态间可逆转化时,其物理化学性质的变化是连续的和渐变的,而且是可逆的。
3玻璃的转变:在Tg~T温度范围内及其附近的结构变化情况,可以从三个温度范围来说明:①在Tf以上:由于此时温度较高,玻璃粘度相应较小,质点的流动和扩散较快,结构的改变能立即适应温度的变化,因而结构变化几乎是瞬时的,经常保持其平衡状态。
因而在这温度范围内,温度变化快慢对玻璃的结构及其相应的性能影响不大。
②在Tg以下:玻璃基本上已转变为具有弹性和脆性特点的固体物质,温度变化的快慢,对结构、性能的影响也相当小。
这个温度间距一般称为退火温度。
低于这一温度范围,玻璃结构实际上可以认为已被“固定”,即不随加热及冷却的快慢而改变。
③在Tg一Tf范围内:玻璃的粘度介于上述两种情况之间,质点可以适当移动,结构状态趋向平衡所需的时较短。
因此玻璃的结构状态以及玻璃的一些结构灵敏的性能,由Tg一Tf区间内保持的温度所决定。
4氧化物形成玻璃条件:①氧离子最多同两个阳离子相连接;②围绕阳离子的氧离子数目不应过多(一般为3或4);③网络中这些样多面体以顶角相连,不能以多面体的边或面相连;④每个多面体至少有三个氧离子与相邻的多面体相连形成三度空间发展的无规则网络。
5无规则网络学说:强调了玻璃中多面体相互间排列的连续性、均匀性和无序性方面。
着色玻璃——精选推荐

着色玻璃2001年第1期中国玻璃善色玻璃玻璃着色剂的种类很多,太部分是过渡元素离子.许多着色剂产生与盐和溶液颜色相同的色彩,其它颜色可以通过胶体形成得到,其中有一,二种被视为克分子溶液.在所有场合,重要的是要了解玻璃的组成及诸如氧化还原状态等其它一些因素或其它着色剂对由一种着色剂产生的颜色会有多大的影响.氧化铁着色铁对玻璃的着色格外引入注目,一是其使用广泛,二是它为化学氧化还原现象及玻璃组成的影响提供了一个范例.氧化铁(FeO)和三氧化二铁(Fe~O3)各自通过位于被4,5或6个氧离子环绕的部位中的Fe和Fe”隔离离子进行着色的.Fe’会产生一个约为lOOOnm的固定吸收带,它不仅吸收红外线,而且吸收红色光和黄色光.含有呈亚铁态铁的玻璃具蓝色.可以说,这样的玻璃是一种”还原玻璃”,因为制诹这样的玻璃要使用一种象焦炭或有机物质这样的还原剂(电子给予体).F3’在约为38Ohm的渡带中吸收很少,从而导致产生一种淡黄色.在无特殊添加荆制备的玻璃中有’/一/,的铁呈亚铁态,由此产生淡绿色,根据原料的纯度,这种颜色会有深浅变化.我们的先辈,根据经验发现某些组分如山毛榉能大大缓解着色性.这是一种氧化锰载体,Mn(h通过下述氧化还原”反应将二价铁转变为三价铁: M++4Fe+甘Mn’+4F这种方向明显向右的平衡反应表明:M离子没有Fe”离子稳定,换言之,其电子亲和力更强.这种”化学脱色”技术在过去广为使用.有时在古老的窗户上可以看到谈紫色的窗玻璃,这是因在原始玻璃中使用锰, 随后玻璃长年累月地暴露在太阳的紫外辐射下(暴晒现象),Mn’氧化为Mn”态造成的.长期以来,使用氧化砷,氧化锑或氧化铈各自的”氧化还原偶”As”/AP,Sb”/Sb3或Ce”/Ce”进行化学脱色来制取”特白”的杯和瓶.在所有场合,出现的少量的铁几乎全部呈Fe”态,它可能使特厚玻璃产生一种黄色.为使之避免,少量加进两种经合适计量的着色剂氧化钴(蓝色)和氧化硒(玫红色)],从而在总体上形成一种互补色.这种颜色的补偿叫做”物理脱色”.变价离子着色还有其它一些离子着色剂,其化合价和吸收带髓玻璃的氧化还原状态变化.表1中, 用于着色和脱色的氧化还原偶以对氧化类电子亲和力的降序排列,换言之,按还原类电子稳定性的降序排列,或按氧化类电子稳定性的升序排列.氧化态§还原态(2550,370nm)黄色cr6§Cr3绿色中国玻璃2001年第1期(6.4,450am和5.9,950rma)(4,490nm)紫色MnMn淡黄色(0.04,430nm)(700,240rim)(紫外)Ce”Ce(紫外)(100.314rma)黄一粟色V”,r3绿色(3,780nm)蓝色Cu2§Cu无色无色As”As”无色无色Ssb”无色(1.3,380nm)黄色Fe”Fe蓝色(9.1,1050rim)无色Sn”Sn”无色括号内数据表示在吸收带最大值下(Bamford数据)由1%(重量)氧化物导致的lem厚玻璃的光密度和波长.光密度:一logl0(传递能量的分数).该谱系具有重要的实用结果6首先,它是脱色本身的基础:高偶的存在促进了低偶的氧化态.该原理同样适用于着色.例如,经验表明,加人微量的铬和MnO:较易从Mn”中获得一种紫色.同样,低偶的存在有助于高偶的还原态.例如,要获得cI’,就需使用氧化铁含量较低的原料.该谱系的第二个结果是,不能将由一种氧化类导致的颜色和一种由低序列的还原类导致的颜色混合.因此.不能期待用产生的蓝色来增强Cu产生的蓝色.不变价离子着色有两种大家熟悉的其作用与氧化状态无关的离子着色剂:钴和镍.在所有由简单离子在可见光谱中产生的吸收带中,co2产生的吸收带最为强烈(47.7,59Ohm).因此,通常用其来制造蓝玻.N在钠钙玻璃中产生的茶色同样较强(14.8,45Ohm).其特点是对碱离子的类型特别敏感.用钾代替钠,可转换为紫色,而用锂代替则产生黄色.这些颜色的变换与Ni离子的配位数变化有关:环绕有6个氧离子,K则环绕有4个氧离子.在co场合,要产生相同的配位数变化,需用无碱硼酸盐玻璃来代替钠钙玻璃,这时Cd的配位数将为6,颜色则呈玫红色.稀土金属着色至此为止,所有着色都产生自跃迁的金属离子.然而,同样还存在能对玻璃着色的稀土金属离子.钕(Nd”),镨(P一)和铒(E)分别产生蓝一紫色,绿色和玫红色.所有吸收带具有三个特征:窄带,很少受玻璃组成影响,强度较低(Nd导致的光密度仅为c0光密度的l/50).使用稀土金属作为着色剂的主要缺点是其吸收率低,成本高.化合物或离子配位化合物着色在窗玻璃,甚至在浇注玻璃,包装玻璃中,最古老的一种着色是琥珀色.无疑,在经过一段很长的时阃才明白琥珀色必须在硫和铁同时存在的情况下才能形成.因为这两种元素作为添加荆或杂质总是在玻璃中存在. 因此.只要简单地向玻璃混合料中引人任何还原剂(煤,金属,有机物质)就能获得这种颜色.一旦关联性建立,就可对硫化物(硫的还原形式)的主要作用作出评估.令人惊异的是实验表明,铁的活性类是Fe(在还原性玻璃中仅呈很小的浓度)而不是F.从而推出了一个由3个氧离子和1个s离子进行四面体配位的Fe”组成的生色团.颜色有可能产生于含有这两种离子的配位化合物,但同样有可能Fe的作用是氧化s2一和形成可能是生色团的”过硫化物”s2离子:2S2一+3Fe~oS2+3Fe在所有场台.琥珀色是由通过平衡反应2001年第1期中国玻璃41生成的化合物造成的概念与大家熟悉的其特征之一完全吻合:即:快速冷却(钢化)的琥珀色玻璃比相同的退火玻璃颜色要浅.因此可以认为,温度降低时,平衡右移,而这是在同样降低的速度下进行的.与缓慢冷却相比,快速冷却将平衡”冻结”在更靠左侧.在建筑平板玻璃和某些汽车玻璃中看到的茶色是添加硒获得的,其色彩同样取决于含铁量,与氧化还原状态也少有关系.因此可以认为茶色是用硒代替硫的相似琥珀色.但Schreiber提出,这种场合的生色团是一种聚硒化物Se.z一,是用Fe还原se产生的:2Fb+xSe苗Sex一+2Fx是聚硒化物链中的原子数.此外,还存在另一种”硫一三价铁”相似琥珀色.这种琥珀色稍星桔黄色,是用钼代替铁获得的.鉴于其成本高昂,收益性也就不明显了.还有一些组合有两种不同阳离子的离子着色配位化合物.例如用铈和钛化合物可制取非常有效的抗紫外玻璃.但这种玻璃带有轻微的黄色.用铁和钛可以获得与传统琥珀色相似的强烈着色.此外,还有产生青绿色的铈一铜配位化合物和产生粟色的铈一铅配位化台物.克分子和胶体溶液着色前面涉及的物理脱色中,提到用硒进行玫红着色.事实上,往低铁含量但非还原性的玻璃(特白玻璃的情况)中加人元素硒可在钠钙玻璃中获得一种玫红色.确切地讲玫红一桔黄色.这种颜色用于制杯业,以及用于制镜的浮法玻璃上.前面谈到了玫红色,淡紫色,紫红色,没有谈到红色和宝石红.所有可见光谱(红色端除外)中的吸收类型是由一种金属或一种半导体微粒子的胶态悬浮产生的.被吸收的能的极限值,亦即颜色,根据目前业已成熟的理论,取决于粒子的尺寸和传导率.幸好我们的祖先没有等待,他们首先发现了铜红(罗马彩绘玻璃时代).金红的发现则是更近的事了,它是1680年左右,两个炼金术士工作的成果.一个叫Cassius,他从氯化金和氯化锡中获得一种紫红色,提出将其混合在玻璃中.第二个叫KunckeI,他通过加人两种金属的化舍物获得了宝石红,同时又术得不加人还原物质保证锡以Sn:态存在.这两种红宝石玻璃的一个特性是在600~C左右时开始显色,也就是说,成形后在使用金的场合,还原和沉淀反应可写成下式:Au¨+Sn¨—fAu.)n+SIl4这样在不使用锔的情况下就能获得一种铜红,但有sn存在更为有益,因此通常都采用(其作用可通过下述事实表示:只要将浮法玻璃的锡面与铜盐甚至气态铜盐接触,就能看到宝石红显色).不过,对导致铜红的粒子是否是金属铜还不能确定,它可能是一种低氧化物cu扣.通过半导体(硒化镉)粒子的胶质沉淀可获得一种发亮的无色彩差异的红色.同祥,采用硫化镉会产生一种黄色.这两种颜色是借助于金属锌形成的.金属锌在这里起着保证硫或硒以s2一或Se一形式出现的还原剂,可以写为:nCd+nSe+nZn-*(CdSe)n+nZn在红宝石玻璃中,显色更为容易.看来,zl1”对离子s一和Sen的活性度同样起着缓冲作用c事实上,已经知道zn2对s’有亲合性,下述事实也揭示了这一点,即传统的琥珀色比古有百分之几ZnO的玻璃中的颜色要浅得多).黑色玻璃黑色玻璃是一种简单通过着色剂组合的不透明玻璃,其吸收带位于整个可见光谱范42中国玻璃2001年第1期围p壬例如使用铬—锰或钴—镍—铬系着色剂.同样可以制取完全不透明的Fe_.s”琥珀色玻璃.乳白色玻璃在某些杯,瓶甚至有时在平板玻璃中看到的乳色通常是氧化钙和氧化钠微晶体沉淀而成的.为使玻璃中引人大约5%的氟化物. 往钠钙玻璃混合料中加入萤石,一旦组成改变,在成形冷却过程中就会产生沉淀.过滤功能玻璃不改变玻璃的透射光谱只是为了获得同样具有功能目的的颜色,上面提到了在镜片中加入钕和在车灯中加入硫化辐(其防眩作用仍值得怀疑).通常,追求的是对紫外或近红外辐射进行或多或少的吸收.长期以来,镜片和包装玻璃业已开发出用不吸收可见光的ce4和Ce3来对紫外光线进行强劲的吸收现在问题是要将其用于汽车玻璃中,至少在专年I】上已经谈及.通常,一种可以采纳的广泛用作肪紫外保护工具的着色是由Fe—s琥珀生色团提供的着色.实际上只有Fe2才能吸收红外辐射,此类离子在lO00nm左右吸收非常有效.但超出红外,对可见光谱的吸收导致产生一种蓝色.问题的关键是要最大限度地吸收太阳辐射的能量并保证有”足够.的可见光透射.就建筑玻璃而言,建筑师可对这种自然光的级别进行选择.但对汽车玻璃则需要调整.在这两种场合,一旦玻璃的透明度得以确定. “选择性”则取决于Fe”/Fe”的比.就这一观点讲,向玻璃混合料中引入一种还原剂来提高该比,制取蓝色而不是绿色的玻璃是有益的.然而,不能使这种还原过度,其理由是:第一,超过约为0.5%的FeO/(Fe20,4- FeO)比,玻璃渡中存在的硫酸盐将还原为硫态,在玻璃中产生我们所看到的琥珀色;第二,硫酸盐的损耗减慢了氧化硅的溶解,并使传统浮法熔窑的熔化制度紊乱.在滤热功能方面,如在放映机里为保护膜片免受灯热的影响.使用磷酸盐玻璃来解决这个问题.实际上,这种环境的变换使吸收光谱向低频移动,遗憾的是这种方法不能搬迁到汽车和建筑玻璃上来.陈金生译自法国(j瘦璃)2000年第3期(上接34页)产,需要更换的调节闸板则可从容地换下,而不需要闸下安全闸板截断玻璃液.从而避免了严重影响浮法玻璃生产厂的产量而造成较大的经济损失.5.主要技术参数调节闸板的调节范围:以流槽底平面为设计基准,调节闸板可上调600ram,下调50mm.升降速度分为两档:快速:1.2mm/s,慢速0.6ram/s6.结束语本设备通过针对性的改进设计以后.取得了良好的使用效果.已成功用于洛阳一线和浙玻二线.。
玻璃是如何脱色?

玻璃中的少量着色氧化物能促使出现可见的颜色,而且当产品的壁厚较大时更为明显。
根据技术文献的数据,在氧化条件下熔炼时,玻璃中不出现可见颜色时所允许存在的氧化物最高含量如下(96),CoO——0.0005NiO一0.0005ChO:-0.001CuO——0.01Fe20。
上述着色杂质中最重要的是氧化铁,它在优质无色晶质玻璃中的含量可能达到0.03—0.5%。
这种杂质是由砂子和石灰石带入玻璃液的。
由于Fe:Os含量平均为2—3%的坩埚的溶解,以及由于被成型设备和玻璃吹管的铁所污染的碎玻璃的使用,也会使大量的铁进入玻璃。
在使用纯原料的情况下,玻璃中的铁的总含量为原料带入杂质总含量的1/6.在/E产晶质玻璃时,这一点应当格外注意。
在熔制无澄清剂的玻璃时,色调将取决于熔炼条件。
与二价和三价铁共存所引起的黄一绿色相比,二价铁所引起的蓝一绿色着色更难被互补色补偿。
因此必须用添加诸如Ce0。
,As。
O。
,Sb。
O。
和Mn02之类氧化剂的方法,使玻璃中所含的绝大多数的铁变成三价态,这些氧化剂引起的脱色叫做化学脱色。
能与铁离子生成络合物的物质也属于化学脱色剂。
它们的着色能力与铁离子本身比起来要低得多。
氟化物和能与铁生成无色络合物的磷酸盐,及与砷和铁化合时也能生成无色络合物,并起活化作用的镧亦属此类。
但这种络合物在光的作用下要发生分解,从而使玻璃产生褐色着色(辐照变暗)。
用硒酸盐也可以脱色,但属于部分化学脱色,因为硒酸盐能把2价铁氧化成三价铁,而本身则变成了金属硒。
硒能形成附加的红色,以补偿铁离子引起的黄一绿色着色。
采用化学脱色方法可成功地降低玻璃颜色的强度,但要完全消除颜色是不可能的,因为生成的三价铁离子会产生黄一绿色色调。
为了消除这种色调,就要添加在玻璃中能对浅黄一绿色色调产生互补色的着色物质,也就是说添加能把玻璃着成红色或紫色的物质。
这种脱色方法称为物理脱色一,化学脱色为了进行化学脱色,在理论上要使用这样的氧化物,即在玻璃中能以几种氧化价态存在并能把二价铁氧化成三价铁。
6-玻璃的着色与脱色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
3 原因 玻璃对光的吸收是由于原子中的电子在接受光照 射后由较低的能级(E1)跃迁到较高的能级(E2)。 当E2-E1=可见光的能量时,就呈颜色。能量差 愈小、吸收光的波长愈长,呈现的颜色愈深。 颜色还同时采用亮度(透射或反射光的强度),是 颜色在“量”方面的特征。色调(是色玻璃透过的透 光中最显著的波长),是颜色质方面的特征。饱和度 (主波长在与白光混合中所占的百分数)。色调和饱 和度称为“色品” 。
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
配位数间的平衡
即与周围氧离子的配位数有关
[Fe3+O6] (淡红色) [Fe3+O4] (黄褐色) [Co2+O6] (粉红色) 着色离子浓度 [Co2+O4] (青色]
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
6.4.3 硫碳着色
1 硫碳在玻璃中的着色(掌握) “硫碳”着色玻璃,颜色棕而透红,色 似琥珀,广泛用于瓶罐玻璃和器皿玻璃。 碳的作用:还原剂作用,并不参加着色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
¨³ ² ¤£ ¨Ä É Ã ×£ ©
气泡 与硫化物和硫酸盐比值有关。
•还原条件下,硫酸盐分解成O2或SO2成气泡 。 •氧化条件下,S2-转成S0蒸气,成凹气泡,内 有少量黄色沉淀(S0)
•水的影响:水以(OH) -形式进入玻璃 [—Si—O—Si—]+H2O→2[—Si—OH] 玻璃中SiO2量越多 ,网络外阳离子极化 力越大,进入的H2O越多,易析出成气泡。
硒:在中性条件下成淡紫红色,氧化条 件紫色更纯更美,氧化过分无色(硒酸 盐)。还原条件会生成无色碱硒化物和 棕色硒化铁。
硫硒混合:棕红色
(2)硫碳着色
颜色:棕红,琥珀色 ①着色机理 3+ 2Fe 为中心原子,被三个氧离子(O ) 2和一个硫离子(S )包围,成四面体结构。 3+ 着色中心含有一个氧化物(Fe )一个 2还原物(S ) 2+ 3+ 22Fe /Fe 和S /SO4 有重要作用 23+ 色心浓度=[Fe ][S ] 色心浓度越大,颜色越深。
2. 金属胶体着色 (1)着色机理 金属(Au Ag Cu)以单质形式存在于玻璃中, 形成晶体并聚集而成胶粒,对光产生选择性吸收, 使玻璃着色。 (2)工艺过程 ①金属离子的溶解(前提) ②金属离子的还原 热还原法(预先加入多价元素) 2Au+ + Sn2+ → 2Au0 + Sn4+ 2Ag+ + Sn2+ → 2Ag0 + Sn4+ 2Cu+ + Sn2+ → 2Cu0 + Sn4+
例:见右图。
5 4 3 2 1
•以Li2O取代Na2O, 2Li2O极化力大,S 量↓。 •以K2O取代Na2O,由于 K-O给氧能力大,也使 2S 含量↓,从而影响色 心浓度。
K2O Li2O
0 1 2 3 4 5
Na20Ò Æ È ¥ Ö Ø Á ¿ %
③常见缺陷 颜色不纯
硫碳着色玻璃的光谱特性 见下图
这一类离子中的电子自旋总和等于零,稳定,跃迁 需高能量,通常不产生选择性吸收,故无色、不 吸收紫外线。
(2)18或18+2电子壳阳离子
结构:这类离子每个轨道上也都有两个电 子,相对较稳定,但不及惰性气体型离子。 特点:极化率大,易变形,有变价,吸收 紫外线。
本身无色,易被还原为金属态。与阴 离子结合可有色。
© ¥ £ ¨£ Ê £ ý  ¸ ¹ Í
70 60 50 40 30 20 10 0
400 450 500 550 600 650 700
•色泽的纯度和亮度取决于: 550nm波长的透光率。 •硫、铁、碳含量高,色暗。 •硫、铁、碳总量一定,S 3+ 24+ /Fe 、S /C 越大越好。 •Fe多易成硫化铁,色暗。原 料含铁量要严格控制。 •还原气氛有利
钕 •Nd3+:紫红色,有双色效应 •吸收峰复杂且稳定,可做校正分光光度计的标准玻璃。 •固体激光材料。 (6)混合着色 可从透光曲线迭加推测混合色
•铈+钛:金黄色ห้องสมุดไป่ตู้不同基础玻璃、比例可得黄、金 黄、棕、蓝等色。
•锰+钴 紫到蓝间颜色,锰调节色调。、
•钴+铜
钴消除铜绿,铜消除钴红,得浅蓝→淡青
(3)硫化镉和硒化镉着色
①概述 着色物质 胶态的硫化镉(CdS)、硫硒化镉(CdS、 CdSe)、硫碲化镉(CdS、CdTe)、硫化锑( Sb2S3)、硒化锑(Sb2Se3)等 着色取决于CdS/CdSe ②光谱特性
在可见光区无吸收峰,而是出现连续吸收区
在可见光区有吸收极限
90
CdO 无色 CdO CdS 淡黄 300 400 CdS 黄 CdS CdSe 橙 CdSe 深红 CdTe 黑
铬
•Cr3+:绿色,着色能力强,高温较稳定,强 还原条件可能全以3价存在 •Cr6+:黄色 低温有利于其存在。
•铬在硅酸盐中溶解度较小,可用于制铬金星 玻璃。 锰 •Mn2+ : 3d轨道半空,着色弱,近于无色 •Mn3+:紫色 ,氧化越强着色越深。 •钠硼酸盐中为棕色,铅硅酸盐中为棕红色。
铁 •Fe2+:蓝绿色 •Fe3+: 3d轨道半充满,着色弱,浅黄绿色或黄色 •通常两种价态同时存在,比例不同而显不同颜色。 •在磷酸盐玻璃还原条件可能全为2价,在红外有吸 收峰,吸热好,透可见光好,可做吸热玻璃。 •两价态均强烈吸收紫外线,用于太阳镜和电焊片。 钴 •常以Co2+存在,着色稳定。 •[CoO6]偏紫色,低碱硼酸盐、磷酸盐中 •[CoO4]偏蓝色,硅酸盐中较多 •0.01% Co2O3即可使玻璃呈深蓝色。
⑤显色
需要使CdS、CdSe长大成微晶体(胶体)实现着色, 因此需要热处理,即显色。
•一次显色(无须热处理):制品成形后就产生颜色。
工序简单,光谱特性要求不高。
•二次显色:成形后,无色,热处理后显色。
适用于光谱特性要求高的玻璃
温度:提高显色温度利于混晶中CdSe比例增大。
温度升高10C吸收限向长波移动5nm
•铜+铬 以CuO:Cr2O3=1.5:1为中心(绿)得黄绿→蓝 绿,铜多偏蓝,铬多偏黄。
不可从透光曲线迭加推测混合色
•铬+锰:少量K2Cr2O7使紫色增强,再多则变 灰色。 可制黑色和黑色透红外玻璃。 •铁+锰:褐紫色和黄棕色,色调无规律。 •铁+钴:灰色,比例不同颜色深度不同。 •钴+镍:比例不同,可得蓝色~紫色系列。 •铁+铬+铜+镍:黑色,几乎将红外、可见、 紫外光全吸收,仅少量透过。
④胶态硫硒化镉的形成
•主要由于熔体冷却时发生分相。由于硫化物
溶解度小,冷却时硫化物析出形成第二相并 长大成微晶体
•一般在含锌硅酸盐中加入硫化镉和硒粉熔制
而成 首先析出硫化锌,进一步降温,反应移 向硫化镉方向,硫化镉长大成为胶态颗粒, 产生黄色——镉黄玻璃 ZnS+CdO→ZnO+CdS
•热处理时硒离子进入CdS晶格,形成CdSCdSe混晶而成红色——硒红玻璃
二次显色温度一般略高于退火温度(600℃~800℃) 时间:保温时间延长颜色加深。
4. 其它着色方法 曝晒着色 在太阳光的紫外线照射下,玻璃结 构中或变价离子中的电子被激发引起。 被激电子被玻璃结构中某处捕获, 形成新的电子结构,即色心。 最常见的杂质铁,易产生曝光着色。
锡在金属胶体着色中起“保护胶”的作用
(3)影响胶体着色颜色的因素
胶粒大小 太小对光不散射,太大发生乳浊。
金胶粒大小(nm) 颜色 <20 20~50 50~100 弱黄 红 紫红→ 蓝 100~150 透射:蓝 反射:棕
胶粒浓度 影响色饱和度 着色剂种类
3. 硫、硒及化合物着色 (1)单质硫、硒着色 硫:只在硼很高的玻璃中存在(蓝色), 不实用。
50 10
500
600
700
800波长(nm)
CdO、CdS、CdSe、CdTe玻璃的透光率曲线
③着色机理
颜色与胶体大小无关,与CdS/CdSe有关 CdS含量% CdSe含量% 100 75 40 10 0 25 60 90 黄 橙黄 鲜红 深红 随CdS/CdSe↓,吸收极限向长波方向移动
结构因素 2+ 3+ 结构因素对Fe /Fe 影响小。 24+ S 大多处于两个Si 之间, 似桥氧。 24+ 2S -Si 稳定性取决于阳离子对S 的极化作用 2网络外阳离子场强越大(极化作用越大)→S 4+ 2-Si 稳定性差→S 含量↓→色心浓度↓。
È S/SO4 Ó ± Ö × Ë · ¿
(1)惰性气体型阳离子 其电子层结构与周期表中邻近的惰性气体相似。
电子层结构 1s2 1s22s22p6 1s22s22p63s23p6 1s22s22p63s23p63d104s24p6 1s22s22p63s23p63d104s24p64d105s25p6 惰性 He(氦 Ne) (氖 Ar) (氩 Kr) (氪 Xe) (氙 ) 阳离子 Li+,Be2+,B3+,C4+ Na+,Mg2+,Al3+,Si4+ K+,Ca2+,Sc3+,Ti4+ Rb+,Sr2+,Y3+,Zr4+ Cs+,Ba2+,La3+
Cu+、Zn2+、Ga3+、Ge4+、As5+、 As3+、 Ag+、Cd2+、In3+、Sn4+、Sb5+、Au+、Hg2+、 Tl3+、Pb4+、 Pb2+、Bi5+、Bi3+
(3)不饱和电子壳阳离子
结构:d(过渡金属)和f(镧系元素)亚层有不 饱和电子,很不稳定。电子跃迁所需要的能量Eg 较小,可见光谱范围内的能量足够,故显色。 特点:有色、变价、吸收紫外线等。 (4)离子着色一般规律 电外层(或次外层)含未配对电子或“轨道”部分 填充者:有色 电外层(或次外层)的电子已配对(全充满、全空 )或半充满者:无色或色弱 变价阳离子:紫外或近紫外区有强烈吸收
叶 巧 明 教 授
玻 璃 工 艺 学
第五章 玻璃的着色与脱色
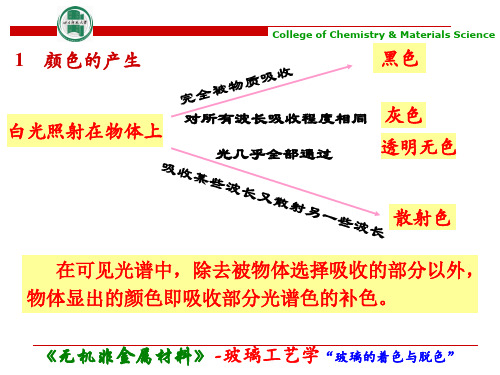
(一)玻璃颜色的表征方法 物质呈色主要为光吸收和光散射,而以吸 收更常见。
(1)颜色 三要素 色相(主波长):颜色的相貌,即颜色的 种类,取决于透过或反射的主波长。 明度(总透过率):颜色的明暗程度,可 表明颜色深浅的差别。 饱和度(色纯度):色彩的浓淡程度和鲜 艳程度。
