牺牲阳极
牺牲阳极简介

牺牲阳极简介牺牲阳极是指电解池理论金属做阳极情况下,阳极(金属)随着流出的电流而逐渐消耗,故称为牺牲阳极。
牺牲阳极通常仅经济地应用在保护电流需要量小的构筑物上和低土壤电阻率环境中。
锌阳极铝阳极镁阳极牺牲阳极工作原理根据电化学原理,把不同电极电位的两种金属置于电解质体系内,当有导线连接时就有电流流动,这时,电极电位较负的金属为阳极、利用两金属的电极电位差作阴极保护的电流源。
这就是牺牲阳极法的基本原理。
牺牲阳极材料的要求:1、要有足够负的稳定电位;2、自腐蚀速率小且腐蚀均匀,要有高而稳定的电流效率;3、阳极材料的电容量要大;4、必须有高的电流效率;5、工作中阳极极化要小,溶解均匀,产物易脱落;6、腐蚀产物不污染环境,无公害;7、材料来源广,加工容易,价格低廉。
牺牲阳极材料分类常用的牺牲阳极材料主要有镁和镁合金、锌和锌合金、铝合金三大类。
在个别工程项目中,由于情况特殊而采用了铁阳极或锰阳极作为牺牲阳极进行阴极保护。
1.铝合金牺牲阳极:多用于海洋或容器(储罐)内阴极保护。
钢桩码头安装铝阳极2.锌合金牺牲阳极:用于海水或低电阻率的土壤中,应用条件土壤电阻率≤15Ω·m。
3.镁合金牺牲阳极:多用于土壤环境,应用条件土壤电阻率≥15Ω·m。
由这三种金属材料又生产出多种形状、类型的不同的牺牲阳极。
我们立博防腐工程有限公司生产的种类繁多,其中包括:锌带、船体常用锌合金牺牲阳极、压载水舱常用锌合金牺牲阳极、海洋工程常用锌合金牺牲阳极、储罐内常用锌合金牺牲阳极、储罐内常用铝合金阳极、港工设施铝合金牺牲阳极、镯式铝合金牺牲阳极、高电位镁合金牺牲阳极、镯式镁合金牺牲阳极、镁带等多种环境适用型号。
牺牲阳极的优缺点优点:1.不需要外部电源,容易安装;2.一次性投资费用低,在运行过程中很少维护;3.无杂散电流干扰,适用于厂区和无电源的长输管道,以及小规模的分散管道保护;4.保护电流的利用率较高,不会产生过保护;5.多数情况下易于增加阳极;6.提供均匀的电流分配;缺点:1.较低的驱动电压/电流,保护范围小;2.对于劣质涂层的结构物需要较多的阳极;3.在高电阻的土壤环境下受限制,即土壤电阻率大于50Ω.m时,一般不宜选用牺牲阳极保护法;5.有效阴极保护年限受牺牲阳极寿命的限制,需要定期更换;。
阴极保护中各类牺牲阳极种类及其特点

阴极保护中各类牺牲阳极种类及其特点工程中常用的牺牲阳极材料主要有镁和镁合金、锌和锌合金、铝合金三大类。
在个别工程项目中,由于情况特殊而采用了铁阳极或锰阳极作为牺牲阳极进行阴极保护。
镁基牺牲阳极因具有很负的开路电位和很大的驱动电压等性能而广泛的应用于土壤、海水、海泥及工业水中对金属结构物进行阴极保护。
但它的电流效率低,是一大缺点。
锌基牺牲阳极的开路电位不如镁基阳极那么负,驱动电压不大,但它仍能在低电阻率土壤、海水、海泥环境中广泛用于牺牲阳极保护。
铝基牺牲阳极的开路电位比锌基阳极略负,它的理论电容量远高于锌基和镁基阳极,具有独特的性能。
但是它是易于钝化的金属材料,在其表面容易产生致密、附着性好的连续氧化膜,甚至产生一层高电阻硬壳,阻碍金属的活化溶解。
目前铝基阳极广泛应用于海水中保护船舶、平台、码头等海洋结构物,在海泥(海底管道)、盐水系统也获得了成功的应用,但尚不能应用于土壤环境中。
镁是典型的轻金属,原子序数12,相对原子质量24.31,密度1.74g/cm,化合价2,熔点651℃.镁的标准电极电位-2.37(SHE)。
镁的特点是:密度小具有较高的化学活泼性;电极电位很负;极化率低;驱动电位大,对铁的驱动电位可达0.6V以上;理论电容量大。
在镁阳极表面不易形成屏蔽性保护膜。
镁和镁合金系列牺牲阳极,电流效率很低一般只有50%左右。
在镁表面易形成较为强烈的腐蚀原电池作用,导致自溶解速率较大。
此外,这种材料如遇碰撞易产生火花等特点,也限制了它在高安全区性能区域的应用,例如:油轮、敏感的易燃易爆区等特定场所。
锌是一种普通的重金属,原子序数30,相对原子质量65.37,密度7.14g/cm,化合价2,熔点420℃。
锌的标准电极电位为-0.76V(SHE),高纯锌在海水中的稳定电位为-0.82V (SHE)。
这是一种较活泼的金属,相对于钢铁及常用的金属结构材料而言是负电性的。
锌阳极在高电阻的土壤中或淡水中不太适用,通常多用于海水,、某些化学介质和低电阻率的土壤或滩涂地。
牺牲阳极的定义

中级定义
定义4:由于该金属的腐蚀对原有腐蚀电池提供保护,加快了自身的腐蚀,因此称为牺牲阳极.牺牲阳极材料应能满足下列要求:(l)要有足够的负电位,而且很稳定。 定义5:牺牲阳极法牺牲阳极(:sacrificialanode)由电位较负的金祸材料制成,当它与被保护的管道连接时,自身发生优先离解,从而抑制了管道的腐蚀,故称为牺牲阳极.牺牲阳极应有足够负的稳定电位,以保持足够大的驱动电压:同时有较大的理论发生电量,还要有高而稳 牺牲阳极
高级定义
定义8:该电位较负的电极称为牺牲阳极,因为随着电流的不断流动,阳极材料不断消耗掉.作为牺牲阳极材料,金属或合金必须满足以下条件[1]:(1)电位足够负,可供应充分的电子使被保护金属设备发生阴极极化
应用
例如:钢闸门的保护,有的就应用这种方法。它是用一种更为活泼的金属,如锌等,连接在钢闸门上。这样,当发生电化学腐蚀时,被腐蚀的就是那种比铁更活泼的金属,而铁被保护了。通常在轮船的尾部和在船壳的水线以下部分,装上一定数量的锌块,来防止船壳等的腐蚀,就是应用的这种方法。 目前,电化学保护法的应用除海水或河道中钢铁设备的保护外,还应用于防止电缆、石油管道、地下设备和化工设备等的腐蚀。
牺牲阳极
初级定义
定义1:阳极随着流出的电流而逐渐消耗,所以,称为牺牲阳极,这种阳极消耗快,安设位置及方法必须便于更换.低电位金属材料有镁、镁合金、纯锌、锌合金、铝合金等。 定义2:这种方法称牺牲阳极法阴极保护这类活泼金属或合金则称为牺牲阳极.牺牲阳极法阴极保护是应用最早的一种电化学保护技术。 牺牲阳极
牺牲阳极的工作原理

牺牲阳极的工作原理牺牲阳极,也称为非铂类阳极(Non-platinum anode, NPA),是指在金属腐蚀保护领域中,一种通过牺牲自身来延缓金属腐蚀速度的电化学保护方法。
它是利用一种与被保护金属失效电位更负的金属制成的阳极,在外加电流的作用下牺牲自身来保护被保护金属。
牺牲阳极的工作原理是基于电化学原理,主要包括两个方面:电势差和阳极溶解。
首先,电势差是牺牲阳极的存在和有效工作的前提条件。
在自然环境中或工业过程中,当两种不同金属接触时,会因为两种金属的化学性质和晶体结构的不同而产生一定的电位差。
在这种接触状态下,一种金属的电位相对于另一种金属是失效电位。
牺牲阳极的作用就是使被保护金属的电位相对于牺牲阳极更正电位,从而使被保护金属从活动状态转为失效状态,从而达到减缓腐蚀的目的。
其次,阳极溶解是牺牲阳极工作的主要过程。
当牺牲阳极与被保护金属接触并受到外加电流的作用时,它会开始溶解,并释放金属离子(阳离子)到电解质中。
这些金属离子随着电解质的流动,经过一系列的电化学反应,重新组合成金属离子,并与电解质中的阴离子结合形成相应的金属化合物。
牺牲阳极溶解的速度与腐蚀速度成正比。
这是因为牺牲阳极所含金属与被保护金属的电位差决定了牺牲阳极牺牲的程度,即牺牲阳极的失效程度。
电位差越大,牺牲阳极的失效程度越高,溶解速度也越快。
因此,通过选择合适的牺牲阳极材料,可以控制腐蚀速度。
牺牲阳极的选择要根据被保护金属的腐蚀、电位差和环境条件来确定。
一般来说,牺牲阳极应具备以下特点:与被保护金属之间差异较大的电位差,较低的自蚀速率,足够的机械强度和可加工性,以及易获取和低成本等。
牺牲阳极的工作原理在许多领域得到了广泛应用。
其中最常见的就是钢铁结构的防腐蚀措施。
在海洋环境中,以铝或锌制成的牺牲阳极被广泛用于船舶、海洋平台等大型钢结构的防腐蚀。
在石油、化工、电力等行业,以铝或镁制成的牺牲阳极也被广泛应用于储罐、管道、锅炉等设备的防腐蚀。
牺牲阳极的阴极保护原理

牺牲阳极的阴极保护原理在阴极保护技术中,牺牲阳极是一种常见的阴极保护原理。
牺牲阳极阴极保护是利用一种更容易腐蚀的金属来代替受保护金属作为阳极,从而保护受保护金属不受腐蚀。
在这种原理下,受保护金属成为阴极,而牺牲阳极则成为阳极,通过电化学反应来保护受保护金属。
牺牲阳极阴极保护原理的关键在于牺牲阳极材料的选择。
通常情况下,牺牲阳极材料应该具有更负的标准电极电势,以便能够更容易地被氧化。
常用的牺牲阳极材料包括锌、铝、镁等。
这些金属在自然环境中更容易被氧化,因此可以更好地保护受保护金属。
牺牲阳极阴极保护原理的工作原理是通过在受保护金属表面形成一个保护性的氧化膜,阻止了金属的继续腐蚀。
当牺牲阳极被氧化时,产生的电子通过外部电路流向受保护金属,使其成为阴极,从而减缓受保护金属的腐蚀速度。
这样,牺牲阳极不断被腐蚀,而受保护金属得到保护。
牺牲阳极阴极保护原理的应用非常广泛,特别是在海洋工程、管道、船舶和钢结构等领域。
在海洋工程中,海水中的氯离子容易引起金属腐蚀,而牺牲阳极可以有效地保护海洋结构。
在管道和船舶中,牺牲阳极也可以延长金属的使用寿命,减少维护成本。
然而,牺牲阳极阴极保护原理也存在一些问题。
首先,牺牲阳极需要定期更换,这会增加维护成本。
其次,牺牲阳极的性能受环境因素的影响较大,需要根据具体情况进行设计和选择。
最后,牺牲阳极的保护效果受到电流分布的影响,需要合理布置阳极以确保保护效果。
综上所述,牺牲阳极阴极保护原理是一种有效的防腐蚀技术,通过选择合适的牺牲阳极材料,可以有效地保护受保护金属不受腐蚀。
然而,在实际应用中需要注意材料选择、维护更换和电流分布等因素,以确保牺牲阳极阴极保护技术的有效性和可靠性。
牺牲阳极防腐原理

牺牲阳极防腐的基本原理牺牲阳极防腐是一种常用的金属防腐方法,它利用电化学原理,在金属结构表面形成一层保护膜,从而防止金属的腐蚀。
其基本原理涉及到电化学反应、阳极和阴极的作用以及电流的流动。
电化学反应电化学反应是指在电解质溶液中,由于电流的作用,阳极和阴极上发生的化学反应。
在牺牲阳极防腐中,电化学反应主要涉及金属的氧化和还原反应。
以铁为例,当金属表面暴露在含有氧气和水的环境中时,会发生以下反应:1.阳极反应:Fe → Fe2+ + 2e-在阳极上,铁原子失去电子,转化为二价铁离子。
2.阴极反应:O2 + 2H2O + 4e- → 4OH-在阴极上,氧气和水与电子结合,生成氢氧根离子。
阳极和阴极的作用在牺牲阳极防腐中,阳极和阴极起到了不同的作用。
1.阳极:牺牲阳极牺牲阳极是一种较为活泼的金属,如锌、铝等,它们具有较低的电极电位。
当牺牲阳极与金属结构接触时,牺牲阳极会优先发生氧化反应,将电子释放给金属结构,从而保护金属结构不被腐蚀。
以锌为例,当锌作为牺牲阳极与铁结构接触时,发生如下反应:锌阴极反应:Zn → Zn2+ + 2e-铁阳极反应:Fe → Fe2+ + 2e-可以看出,锌的电极电位较铁低,因此锌更容易氧化,而铁则相对稳定。
2.阴极:金属结构金属结构是被保护的对象,它充当了阴极的角色。
在阴极上发生的还原反应消耗了来自阳极的电子,从而减缓了金属的氧化速度。
阴极上的还原反应可以通过以下反应来表示:Fe2+ + 2e- → FeOH- → 1/2H2O + 1/2O2 + 2e-这些反应将阴极上的电子消耗掉,并使金属结构得到保护。
电流的流动在牺牲阳极防腐过程中,电流的流动起到了至关重要的作用。
电流的流动是通过电解质溶液中的离子完成的,其中阳极离子向阴极流动。
在牺牲阳极防腐中,锌或其他牺牲阳极的金属通过电流的流动,将电子释放给金属结构,从而发生氧化反应。
同时,金属结构上的阴极反应消耗了来自阳极的电子,实现了金属结构的保护。
牺牲阳极安装图纸
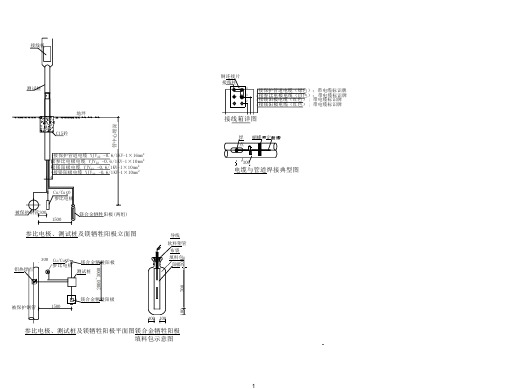
测试桩
地坪 C15砼
1接保护管道电缆 YJV22 -0.6/1KV-1×16mm2 接2 参比电极电缆 YJV22 -0.6/1KV-1×10mm2
接3 镁阳极电缆 YJV22 -0.6/1KV-1×10mm2
4接镁阳极电缆 YJV22 -0.6/1KV-1×10mm2 14
Cu/Cu O 参比电极
被保护钢管300 1500
镁合金牺牲阳极(两组)
参比电极、测试桩及镁牺牲阳极立面图
铝热焊点
300 Cu/Cu O 镁合金牺牲阳极 参比电极 测试桩
导线
软料塑管 布袋 填料包 阳极
被 100
参比电极、测试桩及镁牺牲阳极平面图镁合金牺牲阳极 填料包示意图
铜连接片
接线柱
1
4
3 2
1接保护管道电缆(绿色); 带电缆标识牌 2 接参比电极电缆(白色); 带电缆标识牌 3 接镁阳极电缆(红色) ; 带电缆标识牌 4 接镁阳极电缆(红色) ; 带电缆标识牌
接线箱详图
焊 蝴蝶 定 点
30 300
电缆与管道焊接典型图
1
管道牺牲阳极保护的是什么

管道牺牲阳极保护的是什么
牺牲阳极是一种阴极保护技术,通过将被保护金属(如管道)与一种电位更负的金属或合金(即牺牲阳极)相连接,利用牺牲阳极的优先腐蚀来保护被保护金属免受腐蚀。
在这种保护系统中,牺牲阳极作为电子供体,会自发的发生腐蚀反应,从而消耗自身,以此来保护被保护的管道金属。
这种保护技术通常应用于土壤、海水等潮湿、腐蚀性环境中,以防止管道金属因电化学腐蚀而损坏。
牺牲阳极材料的选择主要依据环境条件和管道金属的材质,常用的牺牲阳极材料包括镁、锌、铝等。
值得注意的是,管道牺牲阳极保护系统需要定期检查和维护,以确保其有效运行。
此外,为了充分发挥牺牲阳极的保护效果,还需要合理设计阳极的数量和位置,以及优化阳极与管道的连接方式。
牺牲阳极是一种经济、有效的防腐措施,能够延长管道的使用寿命,确保管道的安全运行。
镁合金牺牲阳极的使用寿命会受到多种因素的影响,因此很难给出一个确切的数值。
其寿命主要取决于镁合金的腐蚀情况,以及所处环境的温度、湿度、溶液的pH值、溶液的性质、合金的成分等因素。
在一些恶劣的环境下,阳极的消耗会加速,因此需要及时更换或添加阳极保护剂。
而为了提高镁阳极材料的使用寿命,可以选择提高镁阳极的耐腐蚀性能,例如通过优化合金元素、杂质元素、相组成和微结构等方法来实现。
同时,镁阳极表面处理技术的研究也为提升镁阳极的耐腐蚀性提供了一定的帮助。
另外,需要注意的是,虽然镁合金牺牲阳极本身有一定的寿命,但在使用它进行阴极保护时,整个保护系统的使用寿命可能会受到其他因素的影响,如阳极的安装位置、数量、与被保护物体的连接方式等。
因此,为了确保保护效果和系
统稳定性,需要定期检查和维护阴极保护系统。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
腐蚀电极反应
• 任何一种按电化学机理进行的腐蚀反应至少包含一个阳极反应和一个阴极反应,并伴 随有金属内部的电子流动和介质中离子的定向迁移。 • 阳极反应:Fe→Fe+2+2e • 阴极反应:2H++2e→H2↑ • 总反应: Fe+2H+→Fe+2+H2↑ • 阳极: 在电化学反应中发生氧化反应的电极, • 阴极: 在电化学反应中发生还原反应的电极, • 电解质: 含有离子的溶液等,一般指土壤、水、潮气等, • 导体: 电子迁移的途径(金属导体)。
镁牺牲阳极(铸造镁阳极)
镁牺牲阳极(挤压阳极)
第四章 牺牲阳极阴极保护系统安装
1. 阳极沿被保护结构分布,一般竖直安装,要求埋设在冻土 层以下。 2. 对于管道的阴极保护,阳极顶端一般与管道底部水平。 3. 在土壤中应用时,一般要使用回填料,埋设时,要将其浸 湿。填料的作用是保证阳极均匀消耗,提高电流输出以及 阳极效率。 4. 在水环境下安装阳极时,其分布要尽量均匀,将其焊接或 铆接在被保护结构上。也可用阳极电缆悬挂或放在海底、 河床沿结构分布。 5. 保护埋地管道时,根据保护电流的需求量,阳极的间隔由 几米到几公里。 6. 阳极距离被保护结构一般为1 – 1.5 米。几支阳极可以成 组安装。
腐蚀发生的过程
• • • • • • • • • • • 1. 金属的腐蚀大多为电化学过程,金属表面与电解质接触, 如: 在大气环境下,含盐的水蒸气,当金属浸在淡水、海水、或埋 在土壤中时,电解质是含盐的水, 形成腐蚀电池。 2. 阴、阳极在金属表面的分布取决于金属的内部结构及外部环境。 电极电位较负的为阳极、电位较正的为阴极,电子将离开阳极 向阴极移动,而位于阳极区的金属原子由于失去电子而成为带 正电的离子、进入电解质。 3. 在阳极区,带正电的金属离子与周围电解质中的负离子发生反 应而形成腐蚀产物,金属发生腐蚀。 4. 在阴极区,由于存在多余的电子,金属不会发生腐蚀,化学反 应在电解质中发生,如:析氢反应。
从技术可行性上讲,阴极保护必须具备三个使用条件: 1. 管道纵向连续导电,确保阴极保护电流畅通,是阴 极保护的必要条件之一。法兰、丝扣部位需要电缆跨接。 2. 具有足够绝缘电阻的管道覆盖层。覆盖层的主要作 用是隔离土壤介质,阻止形成腐蚀电池。覆盖层绝缘电阻 愈大,需要的阴极保护电流愈小。 3. 管道与其他非保护构筑物之间电绝缘。电绝缘可以 防止阴极保护电流流失,减轻杂散电流干扰等。
管道防腐——牺牲阳极
天长市徐矿天然气有限公司
第一章:发生腐蚀的原因
• • • • • • • • • • 将金属放入电解质后,金属不同的部位,电极电位是不同的,从 而形成腐蚀电池。电极电位的不同是金属自身或环境状况不同所引起 的。 1、微观腐蚀电池 (1)金属化学成分的不均匀性、金相组织的不均匀性、表面物理 状态的不均匀性等; (2)金属表面有杂屑、划痕、受过碰撞; (3)金属表面均可形成无数微阴极和微阳极,构成微观腐蚀电池。 2、宏观腐蚀电池 (1)不同的金属与同一电解质相接触; (2)同一种金属接触不同的电解质; (3)不同的金属接触不同的电解质均可构成宏观腐蚀电池。
牺牲阳极可以单独埋设,也可以成组埋设
西气东输管道公司牺牲阳极使用情 况:
1、小口径短距离支线使用数组块状镁阳极进行阴极 保护,如杨子杨巴、东望支线; 2、淮武线定向钻穿越河流两端使用块状镁阳极组、 在钢筋混凝土套管内使用锌带作为补充阴极保护 措施; 3、使用镁带作为管道临时阴极保护; 4、使用锌接地电池进行绝缘接头防雷保护。
当管道与镁阳极连接在一起时,管道表面电位负移(阴极极化), 直到管道表面不再存在阳极或阴极,所以,消除了管道表面电流在阴、 阳极之间的流动,从而抑制了腐蚀。
牺牲阳极阴极保护,依靠外加阳极不断溶解所产生的电流实现阴 极保护。电位较负的阳极材料随着电流的流动而不断地消耗。 牺牲阳极材料所应具备的条件; 1.电位足够负,但不宜太负,以免阴极区产生析氢反应; 2.阳极的极化率要小,电位及电流输出要稳定; 3.阳极材料的电容量要大; 4.必须有高的电流效率; 5.溶解均匀,容易脱落; 6.材料价格低廉,来源充足。 常用的牺牲阳极材料有三类:镁和镁合金、锌和锌合金、铝和铝 合金。镁阳极电位更负、极化率小、发电量大,但电流效率低,适用 于敷设范围大、电阻率高和淡水中金属的保护;锌阳极要求有较高的 纯度(99.9%);铝是自钝化金属,但通过合金化可以破坏其保护膜, 获得满意性能,铝阳极电位较较正,但价格低廉。
第三章 牺牲阳极
牺牲阳极阴极保护: 根据金属在电动势序列中相对位置的不较活性的 金属流向较惰性的金属,为较惰性的金属提供保护。 该方法是利用电化学反应提供电流。通过将被保护结构与较活性 的金属连接在一起,使被保护金属结构变成阴极;而较活性的金属变 成阳极。 利用这一原理,将金属管道与较活泼的金属连接,使金属管道得 到保护电流。 常用的活泼金属包括: 1. 镁、锌,铝。(由于很难保证铝阳极表面的活性,所以,铝阳 极仅应用于海水环境)。 2. 由于在提供保护的同时,阳极被消耗掉,所以,这些阳极又被 称为牺牲阳极
发生腐蚀的必要条件
发生腐蚀必须满足以下 4 个条件: 1. 阳极和阴极必须同时存在,(阳极、阴极组成腐蚀电池); 2. 阴、阳极之间必须有电位差; 3. 阴、阳极之间必须有电气连接; 4. 阴、阳极必须处于电解质中。 去除四个条件中的任何一个,腐蚀就会停止。
第二章 阴极保护原理
• 阴极保护定义: 通过采取措施,使被保护金属表面在电化学电池 中为阴极而减缓其腐蚀的技术。 • 强制电流从周围电介质中流向被保护结构表面,使金属表面全部 处于阴极状态,就可抑制阴极区金属表面电子释放。施加的电流越大, 产生的阴极极化越强,直到腐蚀原电池的阴阳极达到等电位,消除结 构表面的阳极区,腐蚀得到抑制。 • 实现这一目的有两个途径,即:外加电流和牺牲阳极阴极保护。 • 从理论上讲,如果涂层是完整、无缺陷的,那么,涂层自己就可 以完成防腐任务。然而,要做到涂层无缺陷,实际上是很困难或不经 济的。因此,涂层与阴极保护的结合,99%的防腐任务由防腐层承担、 阴极保护对防腐层缺陷处进行保护,是最经济、有效的防腐措施。
应用范围:适用于保护范围相对简单、防腐层性能好且 与非保护设施有效绝缘隔离的金属结构。 优点:不需外部电源,应用灵活、易于安装、运行维护 简单. 对附近非保护金属构筑物无干扰。 缺点: 输出电流小(一般小于1A) 、仅用于保护电流需 求小的场合。驱动电压低,运行电位不可调,受环境因素 影响较大,仅用于低土壤电阻率环境(小于50 ohm.m , 一般不超过100 ohm.m )。
