碱性琼脂糖凝胶电泳缓冲液(10×)
琼脂糖凝胶电泳

琼脂糖凝胶电泳试剂:溴酚蓝指示剂点样缓冲液,电泳缓冲液(TAE),40 mmol/L Tris-乙酸,1 mol/L EDTA (配制方法:24.2克Tris碱,5.71ml冰乙酸,10ml 0.5mol/L EDTA(pH8.0),定容至5000ml),0.8% 琼脂糖凝胶(配制方法:称取琼脂糖0.4克,加入50ml TAE电泳缓冲液)实验步骤1.调节电泳槽平面至水平。
检查稳压电源与正负极的线路。
2.选择孔径大小合适的点样梳子,垂直架在电泳胶模的一端,使点样梳子底部离电泳胶模底部的距离为1.0mm。
3.制备0.8%琼脂糖凝胶,100℃水浴加热至琼脂糖融化均匀。
4.用吸管取少量琼脂糖凝胶溶液将电泳胶模四周密封好,防止浇灌琼脂糖凝胶板时发生渗透。
待琼脂糖凝胶冷却至60℃左右时,摇匀,轻轻倒入电泳胶模中,琼脂糖凝胶的厚度在3~5mm。
倒胶时要避免产生气泡,若有气泡可用吸管小心吸去。
5.琼脂糖凝胶凝固后,在室温放置20分钟,小心拔掉点样梳子和电泳胶模两端的挡板,保持点样孔的完好。
6.将电泳胶模放入电泳槽中,加入电泳缓冲液,使电泳缓冲液面高出琼脂糖凝胶表面1~2mm。
如点样孔内有气泡,用吸管小心吸出,以免影响加样。
7.将蛋白样品与1/5体积的溴酚蓝指示剂点样缓冲液混合。
上样缓冲液不仅可以提高样品的密度,使样品均匀沉到样品孔内,还可以使样品带颜色,便于上样和估计电泳时间和判断电泳的位置。
8.用微量移液器将样品小心加入加样孔内,记录样品点样秩序。
9.盖上电泳槽,开启电源开关,80V恒压电泳30-60分钟,使蛋白从负极向正极移动,电泳完毕后关闭电源,戴一次性塑料手套取出凝胶,考马斯亮蓝染色。
脱色液配制1L:600ml去离子水,无水乙醇300ml,冰醋酸100ml。
琼脂糖凝胶电泳步骤

琼脂糖凝胶电泳步骤实验前准备及注意事项:将所要用到的制胶锥形瓶、胶槽、梳齿等物品清理干净,如有残胶,需将残胶尽量去除。
注意:所有用来跑核酸胶的物品,只要接触过核酸染料,一定要专门放置,专物专用,不要再将污染过的物品随意放置,以免污染其他物品。
接触过核酸染料的手套不要再碰非污染区的物品。
制胶和拿取核酸胶时佩戴一次性PE手套,再操作其他地方时将一次性手套丢弃。
实验步骤:1.按每100ml 1×TAE/TBE缓冲液中加入1g琼脂糖(1%的胶,根据核酸大小选择制胶的浓度,一般情况用1%-2%的胶)的比例,称取琼脂糖,加入专门制琼脂糖凝胶的250ml-500ml的锥形瓶中。
2.按比例量取适量的1×TAE/TBE缓冲液,加入到锥形瓶中的琼脂糖一起,适当摇晃锥形瓶初步混匀。
3.将混合液放入微波炉中,用中高火加热,加热总时间可根据制胶总量调整,一般40ml左右的胶量加热90s左右。
如果制胶量大,记得每加热1min左右将瓶从微波炉中取出,轻轻晃匀后,再继续加热,以免局部过热导致胶溢出。
注意:取出加热后的瓶时,记得垫上纸,防止烫手!4.待胶加热好,完全溶解后,稍晾凉至45-55℃左右(以基本不太烫手为宜)按照1:10000的比例加入核酸染料(如100ml胶加10ul染料),迅速摇匀。
5.将胶槽和梳齿准备好,梳齿可以预先插好,将上一步摇匀的胶倒入胶槽中,一般厚度以60mm左右为宜,具体要根据梳齿的厚度以及样品量来定。
6.待胶变白,基本表示胶已凝好,此时可以将梳齿拔出,一定要竖着往上拔梳齿,不要摇晃,以免样品孔被破坏。
7.在电泳槽中倒入1×TAE/TBE缓冲液,将制好的胶放入缓冲液,以缓冲液没过样品孔为宜。
8.点样:根据样品孔的大小决定上样量,每一排样品孔至少有一个孔用来点DNA Marker。
(上样前确定每个样品和Marker里都已经加了Loading buffer,Loading buffer 的终浓度为1×)9.确定样品孔的方向,核酸带负电,样品孔要在负极,通电后在胶孔中向正极移动。
琼脂糖凝胶电泳步骤

琼脂糖凝胶电泳一、步骤:1、制胶(1%):将加入30ml 1×TAE缓冲液和0.6g琼脂糖的三角瓶在微波炉加热至沸腾,摇匀至无颗粒。
2、倒胶:先插梳子,再倒胶。
胶冷却至60℃左右(不烫手)加染料后(胶-GelRed:1ml-1ul或30ml胶+3ulGelRed)缓缓倒入电泳槽(先胶布封口,放好梳子),待胶凝固后取出梳子。
3、加样:1µl RNA + 2µl loading buffer混匀。
(点样孔置负极端即黑对黑,红对红)。
4、电泳:稳压条件下120V电泳,待溴酚蓝移动至接近胶前沿(约1cm)时停止电泳(约25min)。
5、观察结果:紫外分析仪上254nm观察,DNA存在处显亮绿色荧光条带,观察酶切后与未酶切质粒的DNA带位置,拍照。
二、注意事项:1、凝胶制备过程中,溶解的凝胶应及时倒入板中,避免倒入前凝固结块。
倒入板中的凝胶应避免出现气泡,影响电泳结果。
2、巨大的DNA链用普通电泳可能跑不出胶孔导致缺带。
高浓度的胶可能使分子大小相近的DNA带不易分辨,造成条带缺失现象。
3、电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲性能下降,可能使DNA电泳产生条带模糊和不规则的DNA带迁移的现象。
4、如果电泳时电压和温度过高,可能导致出现条带模糊和不规则的DNA带迁移的现象。
特别是电压太大可能导致小片段跑出胶而出现缺带现象。
5、变性的DNA样品可能导致条带模糊和缺失,也可能出现不规则的DNA条带迁移。
在上样前不要对DNA样品加热,用20mM NaCl缓冲液稀释可以防止DNA变性。
6、太多的DNA上样量可能导致DNA带型模糊,而太小的DNA上样量则导致带信号弱甚至缺失。
RNA的琼脂糖凝胶电泳实验原理和步骤

RNA的琼脂糖凝胶电泳实验原理和步骤关键词:RNA琼脂糖电泳2012-03-09 00:00 来源:互联网点击次数:38148 一、实验目的掌握植物总RNA非变性胶电泳的原理和方法。
二、实验原理RNA电泳可以在变性及非变性两种条件下进行。
非变性电泳使用%%的凝胶,不同的RNA条带也能分开,但无法判断其分子量。
只有在完全变性的条件下,RNA 的泳动率才与分子量的对数呈线性关系。
因此要测定RNA分子量时,一定要用变性凝胶。
在需快速检测所提总RNA样品完整性时,配制普通的1%琼脂糖凝胶即可。
三、实验材料、器具及药品蘑菇的总RNA溶液。
电泳仪,电泳槽,电子天平,移液器,枪头,微波炉,紫外透射检测仪等。
琼脂糖,1XTAE电泳缓冲液,μg/ml溴化乙锭(EB)10X载样缓冲液。
四、实验步骤(1)用1×TAE电泳缓冲液制作琼脂糖凝胶,加1×TAE电泳缓冲液至液面覆盖凝胶。
(2)在超净工作台上,用移液器吸取总RNA样品4μl于封口膜上。
在实验台上再加入5μl 1×TAE电泳缓冲液及1μl 的10X载样缓冲液,混匀后,小心加入点样孔。
(3)打开电源开关,调节电压至100V,使RNA由负极向正极电泳,约30min 后将凝胶放入EB染液中染色5min,用清水稍微漂洗。
在紫外透射检测仪上观察RNA电泳结果。
RNA的变性琼脂糖凝胶检测试剂:(1)MOPS缓冲液(10*):L 吗啉代丙烷磺酸(MOPS),L NaAc, 10mol/L EDTA。
(2)上样染料:50%甘油,1mmol/L EDTA ,%溴酚蓝,%二甲苯蓝。
(3)甲醛。
(4)去离子甲酰胺。
v电泳槽清洗:去污剂洗干净(一般浸泡过夜)——水冲洗——乙醇干燥——3%H2O2灌满——室温放置10分钟——%DEPC水冲洗。
操作:(1)将制胶用具用70%乙醇冲冼一遍,晾干备用。
(2)配制琼脂糖凝胶。
①称取琼脂糖,置干净的100ml 锥形瓶中,加入40ml蒸馏水,微波炉内加热使琼脂糖彻底溶化均匀。
RNA变性胶的配制

Байду номын сангаас
0.1% DEPC 水 在 1 L ddH2O 中加入 1 mL 的 DEPC 原液,密封,摇床上过夜混匀,高压灭菌,室 温避光保存。 (6) 10×MOPS 电泳缓冲液 称取 41.8 g MOPS 于烧杯中,加入 700 mL 0.1% DEPC 水搅拌溶解,使用 2 mol/L NaOH 调节 pH 至 7.0。再加入 20 mL 1 mol/L 的 NaOAc(DEPC 水处理)、 0.5 mol/L 的 EDTA(pH8.0、DEPC 水处理)20 mL,混匀后用 DEPC 水定容至 1 L。 室温避光保存。 (7) 1.5% 变性琼脂糖凝胶 用移液器量取 8.75 mL CH2O(甲醛)、5 mL 10×MOPS 于锥形瓶中混匀,置于 60 °C 水浴锅中预热。称取 0.75 g 琼脂糖,加入 36.25 mL ddH2O,加热融化至 无肉眼可见晶体,冷却至适当温度后与预热的 CH2O 溶液混匀,加入 2 μL 核酸 染料混匀,倒胶。
碱裂法小规模提取质粒DNA及琼脂糖凝胶电泳

碱裂法小规模提取质粒DNA及琼脂糖凝胶电泳一.实验原理碱裂解抽提质粒DNA是基于染色体DNA与质粒DNA的变性和复性的差异而达到分离目的。
在碱性条件下,线性大分子细菌染色体DNA的氢键断裂,双螺旋结构互补链变性解开。
质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状结构的两条互补链不会完全分离。
当用pH4.8的NaAc高盐缓冲液调其pH值至中性,变性的质粒DNA又恢复到原来的构型,保存在溶液中为可溶状态。
而染色体DNA不能复性,形成缠连的网状结构。
通过离心将细胞碎片,染色体DNA与不稳定的大分子RNA,蛋白质-SDS复合物等一起沉淀下来被除去,质粒DNA及部分RNA,蛋白质则存在于上清中,再用RNaseA 处理,酚/氯仿抽提和乙醇沉淀而获得质粒DNA。
质粒(plasmid)通常指细菌中独立于染色体外,能自主复制的遗传因子,它能够稳定地遗传某些性状。
天然的质粒都是环状双链DNA,大小从5kb到400kb不等。
质粒虽然独立于染色体外自主复制和遗传,但其复制又依赖于宿主编码的酶和蛋白质复制因子。
质粒按照其稳定拷贝数的多少可分为严谨型和松弛型,严谨型质粒在每个细菌细胞中有1~5拷贝,松弛型质粒在每个细菌细胞中可达10~200个,甚至更多拷贝。
1.质粒的结构:(1)抗性基因(Antibiotic resistance gene,such as Ampicillin resistance gene, Kanamycine resistance gene)ori, Origin of replication); (2)启始复制子((3)多克隆位点(MSC, Multiple cloning site or polylinker)2.细菌裂解的方法:(1)碱裂解法:0.2molNaOH+1%SDS(2)煮沸裂解法:沸水煮沸40秒(3)SDS裂解法:10%SDS,一般用于质粒大量提取。
SDS是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性,所以SDS处理细菌细胞后,会导致细菌细胞壁的破裂,从而使质粒DNA以及基因组DNA从细胞中同时释放出来。
琼脂糖凝胶电泳实验

琼脂糖凝胶电泳实验⼀、实验原理:琼脂糖凝胶电泳是分离和纯化DNA ⽚段的常⽤技术。
把DNA样品加⼊到⼀块包含电解质的多孔⽀持介质(琼脂糖凝胶)的样品孔中,并置于静电场上。
由于DNA分⼦的双螺旋⾻架两侧带有含负电荷的磷酸根残基,因此在电场中向正极移动。
在⼀定的电场强度下,DNA分⼦的迁移速度取决于分⼦筛效应。
具有不同的相对分⼦质量的DNA⽚段泳动速度不⼀样,因⽽可依据DNA分⼦的⼤⼩来使其分离。
凝胶电泳不仅可分离不同分⼦质量的DNA,也可以分离相对分⼦质量相同,⽽构型不同的DNA分⼦。
在电泳过程中可以通过⽰踪染料或相对分⼦质量标准参照物和样品⼀起进⾏电泳⽽得到检测。
相对分⼦质量标准参照物相对可以提供⼀个⽤于确定DNA⽚段⼤⼩的标准。
在凝胶中加⼊少量溴化⼄锭(ethidium bromide, EB)或者EB类似物,其分⼦可插⼊DNA的碱基之间,形成⼀种络合物,在254~365nm波长紫外光照射下,呈桔红⾊荧光,因此也可对分离的DNA进⾏检测。
⼀般琼脂糖凝胶电泳适⽤于⼤⼩在0.2kb~50kb范围内的DNA⽚段。
三种不同构型分⼦进⾏电泳时的迁移速度⼤⼩顺序为:超螺旋DNA>线性DNA>开环DNA正确选择凝胶浓度对于琼脂糖凝胶电泳,浓度通常在0.5~2%之间,低浓度的⽤来进⾏⼤⽚段核酸的电泳,⾼浓度的⽤来进⾏⼩⽚段分析。
低浓度胶易碎,⼩⼼操作和使⽤质量好的琼脂糖是解决办法。
注意⾼浓度的胶可能使分⼦⼤⼩相近的DNA带不易分辨,造成条带缺失现象。
适合的电泳缓冲液常⽤的缓冲液有TAE和TBE,⽽TBE⽐TAE有着更好的缓冲能⼒。
电泳时使⽤新制的缓冲液可以明显提⾼电泳效果。
注意电泳缓冲液多次使⽤后,离⼦强度降低,PH 值上升,缓冲性能下降,可能使DNA电泳产⽣条带模糊和不规则的DNA带迁移的现象。
Marker的选择DNA电泳⼀定要使⽤DNA Marker或已知⼤⼩的正对照DNA来估计DNA⽚段⼤⼩。
琼脂糖凝胶电泳常见问题分析
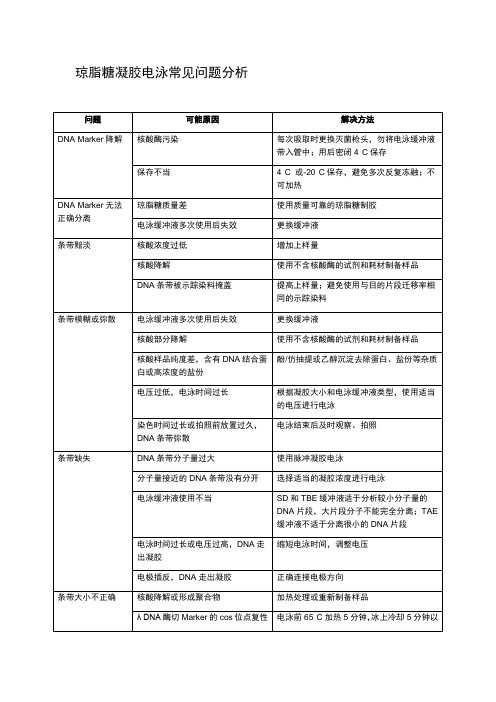
琼脂糖凝胶电泳常见问题分析DNA凝胶电泳简介一、实验原理DNA电泳是基因工程中最基本的技术,DNA制备及浓度测定、目的DNA片段的分离,重组子的酶切鉴定等均需要电泳完成。
根据分离的DNA大小及类型的不同,DNA电泳主要分两类:1、聚丙烯酰胺凝胶电泳适合分离1kb以下的片段,最高分辨率可达1bp,也用于分离寡核苷酸,在引物的纯化中也常用此中凝胶进行纯化,也称PAGE纯化。
2、琼脂糖凝胶电泳可分离的DNA片段大小因胶浓度的不同而异,胶浓度为0.5~0.6%的凝胶可以分离的DNA片段范围为20bp~50kb。
电泳结果用溴化乙锭(EB)染色后可直接在紫外下观察,并且可观察的DNA条带浓度为纳克级,而且整个过程一般1小时即可完成。
由于该方法操作的简便和快速,在基因工程中较常用。
二、琼脂糖凝胶琼脂糖是从琼脂中分离得到,由1,3连接的吡喃型b-D-半乳糖和1,4连接的3,6脱水吡喃型阿a-L-半乳糖组成,形成相对分子量为104~105的长链。
琼脂糖加热溶解后分子呈随机线团状分布,当温度降低时链间糖分子上的羟基通过氢键作用相连接,形成孔径结构,而随着琼脂糖浓度不同形成不同大小的孔径。
表1给出了不同浓度凝胶对DNA片段的线性分离范围。
表1不同类型琼脂糖分离DNA片段大小的范围由于琼脂糖凝胶是通过氢键的作用,因此过酸或过碱等破坏氢键形成的方法常用于凝胶的再溶化,象NaClO4能用于凝胶的裂解,一般的凝胶回收试剂盒利用的也是这一原理。
随着实验技术的发展,也针对不同用途开发了各种类型的琼脂糖凝胶:(1)低熔点琼脂糖凝胶,用于DNA片段的回收,且由于该种凝胶中无抑制酶,可在胶中进行酶切、连接等;(2)高熔点凝胶,可分离小于1kb的DNA片段,专用于PCR产物的分析;(3)快速凝胶,电泳速度比普通凝胶中快一倍,可节省实验时间;(4)适用于DNA大片段的分离。
(5)其它类型。
各生产商还开发很多类型的凝胶,可根据实验要求选择不同类型的,选择原则是考虑合适的机械强度和熔点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京雷根生物技术有限公司
碱性琼脂糖凝胶电泳缓冲液(10×)
简介:
碱性琼脂糖凝胶电泳缓冲液(10×)是一种10倍浓缩的碱性DNA 电泳缓冲液,由
NaOH 、EDTA 等组成,呈强碱性。
使用时稀释至1×使用,主要用于碱性琼脂糖凝胶电泳。
组成:
操作步骤(仅供参考):
1、 用去离子水稀释碱性琼脂糖凝胶电泳缓冲液(10×)至1×。
2、 用1×碱性琼脂糖凝胶电泳缓冲液制备用于碱性琼脂糖凝胶。
3、 加样品于琼脂糖加样孔,电泳。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
相关:
编号 名称 NA0070 Storage 碱性琼脂糖凝胶电泳缓冲液(10×) 500ml RT 使用说明书 1份 编号 名称
DH0006 苏木素伊红(HE)染色液
NA0030 Tris-乙酸电泳缓冲液(50×TAE)
NH0043 SSC 缓冲液(20×,pH7.0)
NR0040 RNase A(10mg/ml)
OR0001 pH 标准缓冲溶液(pH=4.00)
PW0040 Western blot 一抗稀释液
TC1243 甘油三脂(TG)检测试剂盒(GPO-PAP 单试剂比色法)。
