工艺流程专题
专题三 工艺流程题共35张

专题演练
命题点1:
1.(2017·玉林)海水“晒盐”得到的粗盐,含有氯化镁、氯 化钙、硫酸钠等可溶性杂质,必须对其进行分离和提纯,才 能用于工业生产和人们的日常生活。某实验小组设计如下流 程除去粗盐中的可溶性杂质,得到氯化钠晶体。请回答下列
问题。
专题三
工艺流程题
专题演练
(1)步骤Ⅱ加入的物质有:① 过量的碳酸钠溶液、② 过量的氢
(3)两种方法比较,符合绿色化学要求的是方法____ Ⅱ ;方法Ⅱ
的化学方程式为:
O2 2H2O,操作 实验步骤 2Cu +2H2SO4+______= 2CuSO4 +______ 蒸发 ,降温结晶。 为:______
专题三
工艺流程题
重难点突破
【思路点拔】 (1)碱式碳酸铜的俗称铜绿,过滤中要用到的玻 璃仪器:烧杯、漏斗和玻璃棒;(2)铜绿和稀硫酸反应生成硫
铜绿 ,操作①所用到的玻璃仪器有:烧杯、玻璃棒和 _______ 漏斗 。 __________ FeSO4或CuSO4或H2SO4 (2)溶液A的溶质有__________(只写一种);铁锈与稀硫酸反应 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 。 的化学方程式为:_______________________________________
金牌中考总复习
第六部分
专题复习
金牌中考总复习
专题三 工艺流程题
专题三 工艺流程展
1
解题技巧 ……………..…
2
重难点突破 ……………..…
3
专题演练 ……………..…
专题三
工艺流程题
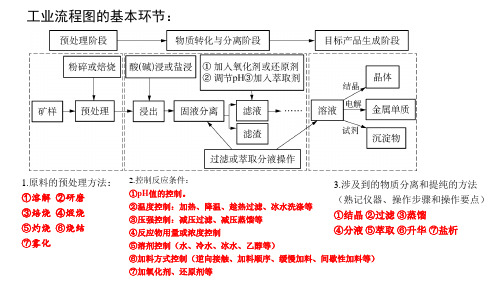
解题技巧
化工工艺流程题是将完整的化工生产过程或其中的一部分用 框图的形式表示出来,广东中考中的工艺流程题主要是物质 的生产和除杂,工艺流程一般为:原料→生产(除杂)→产品。 解答工艺流程题首先要克服恐惧心理,认真审题,明确生产 目的,这样解题的时候才能有的放矢。 一、 化工流程题型的结构、解题方法和思路:
化学工艺流程专题复习

箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产 物和副产物)。
第四页,。(酸溶解表述为“浸出”) 。 ②反应条件的控制(温度、压强、催化剂、原料配比、pH、溶剂等) ③反应原理(化学平衡、水解平衡、化学反应速率、反应热、 电化学等)。
第二十四页,共29页。
【即时巩固】 3.(2012·广东省佛山市普通高中高三教学质量检测)硫铁矿烧渣是一 种重要的化学化工产业中间产物,主要成分是Fe3O4、Fe2O3、FeO和二 氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁[Fe2(OH)n(SO4)3- n/2]m的流程图:
第二十五页,共29页。
第二十三页,共29页。
【答案】 (1)Fe3+ Al3+ (2)Al(OH)3 Ca(OH)2 (3)Al(OH)3+OH-===[Al(OH)4]- (4)①盐酸挥发,制取的二氧化碳中含有 HCl 在甲与乙之间加 一盛有饱和碳酸氢钠溶液的洗气瓶 ②CaCO3(s) Ca2+(aq)+CO23-(aq)
(4)①某同学在实验室中用下图装置制取
CO2气体并通入溶液Ⅱ中,结果没有沉淀产 生,可能的原因是__________;
为了能产生沉淀该同学对图装置进行了 改进,改进的方法为__________。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混
合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,
用方程式表示该溶解平衡关系_______________ _。
化学工艺流程专题复习
2023/5/28
生产计划部
第一页,共29页。
工艺流程题的特点 一是试题源于生产实际,以解决化学实际问题为线索进行 设问,使问题情境真实。二是试题内容丰富,涉及化学基础知 识的方方面面,能考查考生对化学知识的掌握和应用情况,同 时考查考生解决化工生产中的相关问题的迁移推理能力。三是 试题新颖,阅读量、思维含量较大,考查考生的资料收集、处 理能力。该类试题常涉及的知识点有:
2024年中考化学复习专题:工艺流程题

2024年中考化学复习专题:工艺流程题1.合成氨人类科学技术上的一项重大突破,为化肥工业奠定了基础,以下是合成氨的工艺流程图。
(1)“液氮的沸点是−196℃,液氧的沸点是−183℃”,这属于 (填“物理性质”或“化学性质”);氮气常温下化学性质较稳定,可用做 。
(2)下列有关氮气和氢气反应的催化剂说法正确的是 。
a.化学反应前后其化学性质改变了b.其改变了生成物的质量c.只是改变了化学反应速率(3)根据上图,写出氮气和氢气反应生成氨气的文字表达式 。
(4)上述流程图中,“净化压缩”过程,从微观角度解释是气体分子的 改变。
2. 垃圾分类, 有利于变废为宝。
利用废旧白口铁(镀锌铁皮) 制备磁性Fe 3O 4胶体粒子及副产物ZnO ,其工艺流程图如下:(资料:铁不与氢氧化钠溶液反应,锌会与氢氧化钠溶液反应;不溶性碱受热分解生成金属氧化物和水。
)(1)℃中将不溶物和溶液A 分离的操作为 。
(2)℃中发生反应的化学方程式为 。
(3)溶液B 中含有的金属离子为 ,℃中加入适量H 2O 2溶液的目的是 。
3.某品牌电器的废旧电路板中还有Fe 、Cu 、Ag 、Ni (镍,银白色金属)等金属,如下图是某车间回收部分金属的工艺流程,已知22442Δ2Cu+O +2H SO 2CuSO +2H O 。
回答下列问题。
(1)滤渣℃中含有的金属是。
(2)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(3)滤液℃中加入足量铁粉的主要目的是,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为。
(4)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是。
4.消毒剂在公共场所进行卫生防疫时发挥着重要作用。
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。
以粗盐为原料生产ClO2的工艺主要包括:℃粗盐精制;℃电解微酸性NaCl 溶液制NaClO3; ℃ClO2的制取。
高中化学工艺流程专题复习

高中化学工艺流程专题复习高中化学工艺流程专题复第一部分:常见的工艺手段、操作名称和目的知识归纳一、设备:注意设备的选择和使用。
例如:二、工艺流程一)、原料处理阶段:处理类型包括:1.粉碎固体:目的是增大表面积,使固体充分反应或加快反应速率。
注:常考提高浸出率的方法。
2.溶解原料:使用溶剂或有机溶剂等进行溶解、富集。
例如:3.灼烧、焙烧:仪器选择:酒精灯、三脚架、坩埚钳等,例如从海带中提碘。
4.煅烧原料:可以改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解。
例如碳酸钙分解,煅烧高岭土等。
5.其他:1)研磨或剪碎、榨汁等。
2)表面处理:如金属表面的氧化物用浸洗。
3)除去金属表面的油污等:用浸洗。
二)、分离提纯阶段:理清原料和产品的关系→“多的要除、少的要加”→不清楚的跳过。
I.提纯的方法包括:1.氧化除杂:如除去Cu中的Fe。
1)氧化:用氧化剂将Fe氧化成易于后期处理的形式。
2)调节pH除杂:控制溶液的酸碱性使Fe离子形成氢氧化物沉淀。
加入的物质常为纯碱,但尽量不引入杂质。
2.试剂除杂:加试剂直接反应除去杂质。
例如粗盐的提纯。
3.萃取、分液除杂:如从海水中提取溴和碘单质,利用溴和碘单质易溶于有机溶剂。
1)溴和碘单质的颜色:类型水有机溶剂溴单质3+2+碘单质2+2+2)使用到的仪器:4.过滤除杂:使用到的仪器:5.蒸馏除杂:1)使用范围:2)使用到的仪器:3)常见类型:II.常见题型或知识点考查:1.加热的目的:加快化学反应或促进反应等。
2.降温反应的目的:防止某物质在高温时会参与的反应;或为使化学平衡向着某方向,例如有H2O2参与的反应。
3.电解:注意:有新信息按新信息写,无新信息按教材知识写。
4.氧化还原反应的考查:书写氧化还原反应时,找准氧化还原状态,注意环境的酸碱性、反应的条件、符号,然后配平方程式。
三)、获得产品阶段流程:结晶→过滤→洗涤→干燥1)结晶方法:①蒸发结晶:一般适用于溶质且该物质热稳定性好(不会热分解)的结晶析出。
高三化学第一轮复习10.4工艺流程专题课件

3.0
8.1
完全沉淀pH 3.2
9.0
4.7
10.1
( __F_4e_()_O_“_H__沉)3__淀。转溶”中,V2O5·xH2O转化为钒酸盐溶解。滤渣③的主要成分是
高考零距离
【2021年全国I卷】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存 在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿 制备NH4VO3。
控制温度在一定范围
防止温度过高物质分解或挥发、分离产品、催化剂活性、防止副反 应发生、分馏等 降低温度
促使化学平衡移动、降温液化(固化)、结晶、防止温度过高物质分 解或挥发、减缓化学反应速率、降低能源成本等
学以致用
碳酸锶(SrCO3)是一 种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱 锶矿(含80~90% SrCO3, 少量MgCO3、CaCO3、 BaCO3等)制备高纯碳酸锶的工 艺流程如下:
高考零距离
【2021年全国I卷】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存 在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿 制备NH4VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe3+
Fe2+
Al3+
Mn2+
一、工业流程的表现形式 形式一:
形式二:
二、工业流程的常见考点 【小结】工业流程常见问题有哪些?
1、原料的预处理2、反应条件的控制:温度、压强、催化剂、原料配 比、pH、溶剂等。3、基本概念:氧化还原反应的判断、方程式的书写 等。4、反应原理:化学平衡、水解平衡、化学反应速率、反应焓变、 电化学等。5、实验基本操作:除杂、分离、检验、洗涤、干燥等。
2024高考化学工艺流程专题
②还原焙烧:指在低于炉料熔点和还原气氛条件下,使矿石中的金属氧化物转变为相应 低价金属氧化物或金属的焙烧过程。 该焙烧过程中,一般要在矿石中附加细小的炭粒作还原剂。 还原焙烧目前主要用于处理难选的铁、锰、镍、铜、锡、锑等矿物原料。
产物 ②控制反应速率 ③控制反应物转化率和产品产率 ④控制环境温度 ⑤抑制(促进)离子 的水解 ⑥降低生产成本酸浸时酸过量的目的:为了提高矿石中某金属元素的浸取率;抑制**离 子的水解等。对有多种反应物的体系,增大便宜、易得的反应物的浓度目的是:提高其他物质 的利用率,使反应充分进行;降低生产成本等。如:增大浓度可以加快反应速率,使平衡发生 移动等。(应结合具体问题进行具体分析)。(2)控制加料的方法:逆向接触、加料顺序、缓 慢加料、间歇性加料等。
(2023·全国甲卷第26题)BaTiO3是一种压电材料。以BaSO4为原料,采用下 列路线可制备粉状BaTiO3。
回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是_______。(2)“焙烧”后固体产物 有BaCl2、易溶于水的BaS和微溶于水的CaS。
“浸取”时主要反应的离子方程式为_______。 (1)“焙烧”步骤中,BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、BaS 和CaS,BaSO4被还原为BaS,因此,碳粉的主要作用是做还原剂,将BaSO4还原。(2)S2-易发生 水解生成HS-,
4.研磨:增大固体样品与溶液的接触面积,加快反应(浸取)速率或使反应更充分。
真题思演维练模型和方法模型
专题-工艺流程题解题技巧

2015 全国1
27(1)
2015 全国2
28(1)(3) 36(4)
27(5) 27(3) 27(3) 27(2)
36(3)
27(1) 28(2)
1.反应条件的控制或目的—— pH的调节
【专题整合】
例题:2015全国1-27.(14分)硼及其化合物在工业上有许多用途。以铁硼矿(主要成 分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备 硼酸H(H3B3OBO3 、3)的F工eS艺O4流、程Fe如2(S图O所4)3示、:Al2(SO4)3 、MgSO4
26(4)
26(2) 26(2)
2017 全国1
27(2)
27(6)
2017 全国2
26(2)常规
2016 全国1
28(2)
2016 全国2
27(3)
26(3)
28(3) 28(4)
27(4) 27(1)
27(5) 27(3)
28(1)
26(1) 26(2)(3)
27(4) 28(5)
28(3)提纯
SiO2、CaSO4
△
Mg2B2O5·H2O+2H2SO4 2MgSO4+2H3BO3
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式
。
(3)“净化除杂”需先加H2O2溶液,然后在调节溶液的pH约为5,目的是
使Al3+与Fe3+形成氢氧化物沉淀而除去
高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸点/℃58136181(升华)3161412熔点/℃?69?25193304714在TiCl4中的溶解互溶——微溶难溶性(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+ kJ·mol-12C(s)+O2(g)=2CO(g) ΔH2= kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【知识梳理】一、中考流程图题命题问题情境归纳整理粗盐的提纯二、中考流程图题命题考查内容和特点1.考查内容(1)化学反应原理。
(2)元素化合物知识。
(3)实验操作及名称。
(4)物质除杂、分离。
(5)流程中的物质转化和循环。
三、化工流程图题型的结构、解题方法和思路 1.化工流程图题型的结构题头(引入信息)→题干(提取信息,应用解题)→题尾(得出结论或产品)。
2.解题方法和思路3.具体操作(1)关注“箭头”:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
(2)关注方框内所指。
(3)关注流程“三线”和“核心”(如下图)。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环使用。
海水资源的开发和利用例.制盐工业:通过海水晾晒可得粗盐,粗盐除NaCl 外,还含有MgCl 2、CaCl 2、Na 2SO 4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:过滤Na 蒸发、结晶、烘干粗盐溶解BaCl 2NaOH2CO 3HCl精盐过量④过量过量①②③⑤⑥⑦(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO 4、Mg(OH)2、 (4)在第③步操作中,选择的除杂的试剂不能用KOH 代替NaOH ,理由是 。
(5)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_________ 。
【解题思路】1、从题干上画出并提取相关的信息,明确实验目的;提纯物质:溶液 固体(一般情况下用蒸发的方法)目的 Mg 2+ Mg(OH)2 (加入碱) Ca 2+ CaCO 3(加入碳酸盐)除杂 Ba 2+ BaSO 4或者BaCO 3(加入含硫酸根化合物或者碳酸盐) OH — H 2O (加入盐酸或者硫酸)CO 32—CO 2和H 2O (加入盐酸或者硫酸)①所涉及有关的化学反应 ②溶液中具有的溶质 2、分析 ③除去有关的杂质④除杂剂用量的选择(过量与适量)3、解题【专项训练】1.(10年)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。
某硫酸钠粗品中含有少量CaCl 2和MgCl 2,实验室进行提纯的流程如下:回答下列问题:(1)用NaOH 和Na 2CO 3除杂时,反应的化学方程式分别为_________________________________、__________________________________。
(2)NaOH 和Na 2CO 3如果添加过量了,可加入适量___________溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至________(填序号)。
A .完全蒸干时停止加热B .快干时停止加热,利用余热蒸干C .有大量固体析出时停止加热,过滤弃去剩余的少量溶液(4)已知硫酸钠的溶解度随温度变化的曲 线如右图所示。
40℃时,100g 蒸馏水 中溶解______g 硫酸钠达到饱和。
将 该饱和溶液升高温度至90℃,观察到的现象是_____________________。
2.(11年)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。
某工厂以石灰石为原料生产二水化钙(2CaCl O H 22•)的流程如下。
原料石灰石中含有杂质主要是3MgCO 、4MgSO 和32O Al 。
硫酸钠粗品 溶解 除杂 NaOH 过滤 后续处理 水Na 2CO 3 除杂01020304050600102030405060708090温度/℃溶解度 /g(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为______________。
(2)加入BaCl2除去的杂质离子是________________;加入Ca(OH)2除去的杂质离子是________。
⑶检验“滤液”酸碱性,如果显碱性,还需加入适量的___________________(填化学式)提高产品纯度。
3.(12年)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:(1)写出下列反应的化学方程式:反应①:_____________________________________________________;反应②:___________________________________________________。
(2)反应①所用的硫酸的质量分数为24.5%。
现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水。
实际操作时,用lOml量筒取98%的硫酸(密度为1.84g/cm3),请在答题卡图中画出所取硫酸的液面。
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行。
(4)试剂A可选用___________溶液(填一种物质的化学式)。
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)______________________________________________________。
4.(13年)实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。
某研究性学习小组发现一瓶未密闭的KOH 固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH;假设2:含KOH和K2CO3;假设3:只含K2CO3(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________。
(2)取少量样品于试管中,加入足量稀盐酸,观察到_____________________,说明假设2或假设3成立。
(3)进一步探究的过程如下:①“操作1”的名称是____________检验②“固体A ”的化学式是___________。
③加入足量CaCl 2溶液的作用是_______________________________。
(4)变质试剂也有利用价值,从KOH 和K 2CO 3的组成和性质看,这瓶变质试剂的用途是 __________________________________________(写出一条)。
5.(14年)粗盐中除NaCl 外还含有MgSO4以及泥沙等杂质。
初步提纯粗盐的实验流程如下:溶解过滤3.6g 粗盐蒸馏水滤渣滤液蒸发结晶精盐回收装瓶(1)“滤渣”是粗盐中含有的 。
(2)实验过程中四次用到玻璃棒,分别是: 第一次:溶解时搅拌;第二次: ; 第三次: ; 第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因:(4)看图可知,200C 时NaCl 的溶解度为 g,本实验溶解3.6g 的粗盐,蒸馏水的最佳使用量约为 ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是 。
6.(14年海珠区)某校化学兴趣小组的同学探究如何利用水垢制取氯化钙。
水垢的主要成分是CaCO 3和Mg(OH)2,由水垢制取氯化钙的流程如下:请回答:(1)“试剂A ”是一种酸,其化学式为 。
(2)“试剂B ”是氢氧化钙,加入其除去的主要杂质离子是 ,所发生反应的化学方程式为 ;“试剂B ”不能选用氢氧化钠,理由是 。
(3)“酸化”的主要目的是 。
(4)“操作1”中,需要用到的玻璃仪器除烧杯、玻璃棒外,还有 。
溶解水垢除杂试剂B操作1酸化试剂A滤渣蒸发CaCl 2试剂A7.(14年天河区)某化学兴趣小组查阅资料得知,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。
为了将粗盐提纯,设计了以下操作流程:过量盐酸请你根据以上信息回答下述问题:(1)操作Ⅰ的名称为_______________。
(2)加入过量氢氧化钠溶液,发生化学反应的方程式为。
(3)加入过量碳酸钠溶液的实验目的是。
经过操作Ⅱ所得溶液中含有的阴离子是。
(4)某同学所得精盐比其他同学明显要多,原因可能是__________。
A.滤纸破损,滤液浑浊就蒸发 B.蒸发时未用玻璃棒,有一些液体溅出C.提纯后所得精盐尚未完全干燥 D.溶解时水的量太少,使食盐未完全溶解8.(14年育才中学)某粗盐中主要成分为NaCl,含有少量的氯化镁,氯化钙和少量泥沙。
除去杂质,得到纯净的氯化钠。
实验室进行提纯的流程如下:回答下列问题:(1)步骤①和②的操作是。
在该操作中要用到的玻璃仪器中除烧杯、玻璃棒以外,还有。
(2)步骤②判断加入的氢氧化钠溶液已经过量的操作和现象是;步骤④判断加入的盐酸“适量”的现象是。
(3)步骤⑤加热蒸发时要用玻璃棒不断搅拌,这是为了防止。
(4)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:;。
(5)用化学符号表示滤液2中含有的微粒。
9.(14年第21中学)某粗盐中主要成分为NaCl,含有少量的氯化镁,氯化钙和少量泥沙。
除去杂质,得到纯净的氯化钠。
实验室进行提纯的流程如下:回答下列问题:(1)步骤①和②的操作是。
在该操作中要用到的玻璃仪器中除烧杯、玻璃棒以外,还有。
(3)步骤②判断加入的氢氧化钠溶液已经过量的操作和现象是;步骤④判断加入的盐酸“适量”的现象是。
(3)步骤⑤加热蒸发时要用玻璃棒不断搅拌,这是为了防止。
(4)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:;。
(5)用化学符号表示滤液2中含有的微粒。
