过氧化氢制取氧气的步骤解析
过氧化氢制取氧气的步骤

过氧化氢制取氧气的步骤
氧气是生命存在的必要物质,利用过氧化氢制取氧气的方法从技术上说,不仅
仅是在实验室里可以实现,也可以在家里居家环境自行实现,现在我们就一起分析一下利用过氧化氢制取氧气的步骤:
首先,准备工作包括:
1、准备好实验器材,实验材料,如重酸(如HCl)、氨水(NH3)、硼酸水溶液等,以及取氧容器,如玻璃瓶等;
2、准备配好H2O2溶液,应用在过氧化氢氧化反应中;
3、准备好接氧用的橡胶管,以及用于收集氧气的容器,如瓶子;
其次,过氧化氢的制备及取氧流程:
1、将重酸(如HCl) 、氨水(NH3)、硼酸水溶液混合,将混合溶液从实验室的
滴定架中滴定进去;
2、将混合液中的HCl溶解后,再加入H2O2;
3、将可溶性混合液和非溶性混合液放入立方体容器中;
4、把橡胶管插入容器,并用玻璃瓶容器收集产生的气泡;
5、等小颗粒结晶完全溶解时,会出现白色烟气,并有助于氧气产生;
6、等气泡收集到瓶中,便可取得氧气;
最后,实验完成后,需要注意几点:
1、实验室要保持通风良好的环境;
2、过氧化氢具有强烈的氧化性和强毒性,所以应做到定期检查,以免出现意
想不到的意外;
3、实验时,要多留意安全操作,如穿防腐手套,工作室用木头工具等;
4、收集好取氧容器,并保存于实验室合适的位置;
以上就是通过过氧化氢制取氧气的步骤,本实验的安全性和可行性较高,但需
要加强安全性,不能忽略任何安全操作,以免出现意外。
总之,认真对待这个过程,可以顺利的制取出氧气,真正的实现利用氧气的目的。
过氧化氢制取氧气的

过氧化氢制取氧气的【摘要】本文探讨了过氧化氢制取氧气的方法和应用。
在化学性质部分介绍了过氧化氢的结构和性质,以及它可以被用来制取氧气的原理。
接着介绍了制取氧气的化学方程式和反应条件,以及工业生产和实验室制取氧气的具体方法。
在结论部分讨论了过氧化氢制取氧气在医疗、环境和工业领域的应用,并展望了未来的发展趋势。
通过本文的阐述,读者可以进一步了解过氧化氢制取氧气这一过程的重要性和实际应用。
【关键词】过氧化氢,制取氧气,化学性质,原理,化学方程式,反应条件,工业生产,实验室制取,应用,发展趋势1. 引言1.1 过氧化氢制取氧气的概述过氧化氢是一种常见的化学物质,也被称为双氧水。
它是一种无色、无臭的液体,在常温下呈淡蓝色。
过氧化氢具有强氧化性,可以用于消毒、漂白等各种应用。
过氧化氢还可以被用来制取氧气,这是一种重要的化学反应。
制取氧气是一种重要的化学反应,因为氧气是生物体呼吸和燃烧的重要物质。
过氧化氢制取氧气的过程相对简单,通过适当的条件可以使过氧化氢分解释放出氧气。
这样既可以得到纯净的氧气,又可以实现资源的充分利用。
在实际生产中,过氧化氢制取氧气已经得到了广泛应用。
无论是工业生产还是实验室研究,都可以通过这种方法制取氧气,而且效率高,操作简单。
未来,随着科学技术的不断发展,过氧化氢制取氧气的应用将会越来越广泛,为人类生活带来更多便利和进步。
2. 正文2.1 过氧化氢的化学性质过氧化氢(化学式为H2O2)是一种重要的氧化剂,也是一种带有活性氧的化合物,具有较强的氧化性和漂白性。
其化学性质主要表现在以下几个方面:1. 过氧化氢是一种不稳定的化合物,易分解为水和氧气。
这种分解反应在常温下相当缓慢,但加热或受到光照会加速分解,释放出氧气。
2. 过氧化氢可以发生双原子氧的自由基反应,生成氢氧自由基。
这种自由基具有较强的氧化性,可以与有机物发生氧化反应。
3. 过氧化氢在弱酸性条件下可以发生还原反应,将许多金属氧化物还原为金属。
过氧化氢制取氧气的原理

过氧化氢制取氧气的原理一、引言氧气是生活中常见的气体之一,它在医疗、工业和科学研究等领域有着重要的应用。
过氧化氢(H2O2)是一种常见的化学品,它可以通过一定的方法制取氧气。
本文将介绍过氧化氢制取氧气的原理及相关过程。
二、过氧化氢的性质过氧化氢是一种无色液体,具有较强的氧化性。
它可以与许多物质反应,产生氧气和水。
过氧化氢在储存和运输时需要特殊的注意,避免其分解或爆炸。
三、过氧化氢制取氧气的原理1. 催化分解法过氧化氢可以通过催化分解的方法制取氧气。
一种常用的催化剂是二氧化锰(MnO2),它可以加速过氧化氢的分解反应。
当过氧化氢与二氧化锰接触时,会发生以下反应:2H2O2(过氧化氢)→2H2O(水)+ O2(氧气)2. 热分解法另一种制取氧气的方法是利用过氧化氢的热分解。
当过氧化氢受热时,其分子内的氧气键断裂,分解为水和氧气。
这种方法通常需要在高温下进行,例如使用催化剂加热或通过电加热。
3. 光解法光解是指利用光能使化学物质发生分解反应的方法。
过氧化氢也可以通过光解来制取氧气。
当过氧化氢受到紫外线或可见光的照射时,会分解为水和氧气。
这种方法常用于实验室中小规模制取氧气的需求。
四、过氧化氢制取氧气的实验过程1. 准备实验装置:需要一个适当的容器来储存过氧化氢,可以使用试管或烧瓶。
同时需要一个催化剂,如二氧化锰,以及一个收集氧气的装置,如气球或气体收集瓶。
2. 加入催化剂:将适量的催化剂加入容器中。
3. 加入过氧化氢:将过氧化氢缓慢地加入容器中。
4. 观察反应:观察过氧化氢分解反应的进行,可以观察到氧气的产生。
5. 收集氧气:将产生的氧气通过管道或导管引导到收集装置中。
6. 实验注意事项:在进行过氧化氢分解实验时,需要注意安全问题。
过氧化氢具有较强的氧化性,应避免与易燃物质接触。
同时,实验操作要小心,避免剧烈分解或爆炸。
五、过氧化氢制取氧气的应用过氧化氢制取氧气的方法在实验室中常用于小规模制取氧气的需求。
用过氧化氢制取氧气实验步骤

用过氧化氢制取氧气实验步骤嘿,朋友们!今天咱就来讲讲用过氧化氢制取氧气这个超有趣的实
验步骤哈!
先得把那些实验器具都准备齐全咯,这就好比战士上战场得带好自
己的武器一样重要呢!锥形瓶、长颈漏斗、双孔橡皮塞、导管、集气瓶、水槽,一个都不能少呀!
然后呢,把过氧化氢溶液倒进锥形瓶里,就好像给它喂了一顿“大餐”。
这时候你就想象一下,这些过氧化氢分子们都兴奋起来了,准备
大干一场呢!
接着,把长颈漏斗插进橡皮塞里,再把橡皮塞紧紧地塞住锥形瓶瓶口,就像是给瓶子戴上了一顶严实的帽子,可不能让那些气体偷偷跑
掉呀!
当一切都准备就绪,就可以开始制取氧气啦!打开长颈漏斗的活塞,让过氧化氢溶液慢慢地滴下去。
这就好像是给这场化学反应按下了启
动键,哇哦,奇妙的事情就要发生啦!
过氧化氢在催化剂的作用下,开始分解啦,产生了氧气。
这些氧气
就像一群小精灵,欢快地从溶液里跑出来,顺着导管一路向前冲。
导管的另一头呢,要伸到集气瓶里哦。
看着氧气一点点地充满集气瓶,是不是感觉特别有成就感呀?就好像自己是个神奇的魔法师,在创造着什么了不起的东西呢!
等集气瓶里装满了氧气,就可以把它从水槽里拿出来啦。
这时候你可得小心哦,别让好不容易制取到的氧气跑掉啦!
哎呀,这整个过程是不是特别有意思呀?就像一场小小的冒险,每一步都充满了新奇和惊喜。
通过自己的双手,亲眼看到氧气被制取出来,这种感觉简直太棒啦!
所以呀,大家都可以自己动手试试这个实验哦,亲自感受一下科学的魅力。
相信你们一定会爱上这个过程,说不定还会从此对化学实验着迷呢!别犹豫啦,赶紧行动起来吧!。
分解过氧化氢制取氧气

步骤三:反应停止后,重新加入过氧化氢溶液,把 带火星的木条伸入试管。观察发生的现象。 现象:有大量气泡产生,带火星的木条复燃了
结论:二氧化锰(MnO2)仍然在起作用使过氧化 氢溶液分解产生氧气。
二氧化锰在反应中的作用
实验中应该注意什么呢?
1、实验前应首先检查装置的气密性;
2、当导管口有连续均匀的气泡产生时, 再收集气体;以防收到的气体不纯
3、取出后的集气瓶应正放。 4、若用排水法收集,集气瓶充满水时不能留 有气泡,若用向上排空气法时,导气管应 插到集气瓶底部。
随堂检测
1.工业上制取大量氧气的方法是 (C)
(A)加热氯酸钾 (B)加热高锰酸钾 (C)分离液态空气 (D)加热二氧化锰
探究:过氧化氢(H2O2)溶液制取氧气
步骤一:在常温下,把带火星的木条伸入过 氧化氢溶液的试管,观察木条是否复燃? 现象:带火星的木条不能复燃 结论:常温下过氧化氢溶液分解很慢,放出 氧气少。
步骤二:向上述试管中,加入少量二氧化锰, 把带火星的木条伸入试管。观察发生的现象。
现象:有大量气泡产生,带火星的木条复燃了
“二不变”:本身 的质量和化学性质 在化学反应前后都 没有改变
催化剂应掌握 ⑴改变速率包括加快和减慢; ⑵化学性质和质量匀未改变,物理性质会改变; ⑶对某具体反应可作催化剂,并不是任何时候都
作催化剂。 ⑷同一反应可能有多种催化剂。 ⑸不能改变生成物的质量。 ⑹参加了化学反应。 6、催化作用 催化剂在化学反应中所起的作用叫催化作用。
探究内容
现象
反应快慢
1、在试管A中加入约5mL过氧化
氢溶液,伸入带火星的木条, 无明显现象
过氧化氢制取氧气化学表达式

过氧化氢制取氧气化学表达式过氧化氢是一种常见的氧化剂,它在很多领域中都有广泛的应用,例如消毒、漂白、环保等。
而通过其制取氧气,也是一项重要的化学反应。
下面将分步骤阐述过氧化氢制取氧气的化学表达式。
1. 原理过氧化氢(H2O2)经过催化分解(MnO2为催化剂),分解成水和氧气(O2),其中氧气是我们所需要的产物。
这种反应可以写成如下化学方程式:2H2O2(过氧化氢)→ 2H2O(水)+ O2(氧气)2. 反应条件该反应需要在温度和压力的控制下进行,一般需要在常温下加入过量的过氧化氢(H2O2),然后加入催化剂(MnO2),反应生成氧气(O2)。
反应完全进行时,生成的氧气可以通过收集或者其他方式进行提取。
3. 化学表达式该反应的化学表达式为:2H2O2(过氧化氢)→ 2H2O(水)+ O2(氧气)这个方程式表达了过氧化氢催化分解生成氧气的反应过程,使用化学元素符号简洁明了地表示了每个反应物和生成物的数量和成分。
4. 反应特点过氧化氢制取氧气的反应是一种高效、经济的方法。
不仅能够从过氧化氢中制取氧气,还能将过氧化氢分解成成分更简单的物质,减少污染。
同时,反应过程中涉及到催化剂的运用,为我们提供了一种新的研究途径。
5. 应用领域过氧化氢制取氧气的化学反应在许多领域中具有广泛的应用,例如医疗用途、工业制氧等等。
此外,还可以用于消毒、漂白等生活家用。
总之,过氧化氢制取氧气是一项有着重要应用价值的反应,在工业、医疗、环保等许多领域有着广泛的应用。
通过控制反应条件,优化反应过程,可以更好地利用过氧化氢这种常见物质,实现氧气产生和污染减少等目的,进一步促进化学领域的发展和创新。
用过氧化氢溶液制取氧气

明确所用的药品和反应的条件:
1、加热高锰酸钾(KMnO4)
2、常温下分解过氧化氢(H2O2)
3、加热氯酸钾(KClO3)
高锰酸钾
△
锰酸钾+二氧化锰+氧气
\
过氧化氢二氧化锰 水+氧气
氯酸钾
二氧化锰 加热
制取原理
氯化钾+氧气
分解过氧化氢溶液制取氧气
【探究实验】 (1)在试管中加入5%的过氧化氢溶液,不 用加热,把带火星的木条伸入试管,观察 木条是否复燃?
二氧化锰加快 液能迅速产生氧气。
催化剂:在化学反应里能改变其他物质的化学反 应速率,而本身的质量和化学性质在反应前后都 没有发生变化的物质。 催化作用:催化剂在化学反应中所起的作用。
【小结】 (1)“一变”是指催化剂能改变其他物质的化学 反应速率,这里“改变”包括加快和减慢。 (2)“两不变”是指催化剂的质量和化学性质在 化学反应的前后没有改变。 (3)催化剂参加了化学反应。 (4)催化剂只能改变化学反应速率,不能增加或 减少生成物的质量。 (5)不同的反应需要不同的催化剂,同一个反应 也可选择不同的催化剂。 如过氧化氢分解制取氧气时,既可以选择二氧 化锰做催化剂,也可以选择铁锈、新鲜的土豆等 做催化剂。
3、研究表明,许多金属氧化物对氯酸钾的分解有催 化作用。下表是不同金属氧化物作催化剂,氯酸钾 剧烈反应时的温度。 氧化物 氧化铁 氧化铝 氧化铜 氧化镁 剧烈反应 490℃ 540℃ 350℃ 545℃ 时的温度 实验室用氯酸钾制取氧气,如果不用二氧化锰作催 化剂,最好选用( ) A、氧化铁 B、氧化铝 C、氧化铜 D、氧化镁
课堂教学展示 典例剖析
例 下列关于催化剂的说法中,正确的是 ( D ) × A.加入催化剂能使反应速率加快
实验室用过氧化氢制取氧气
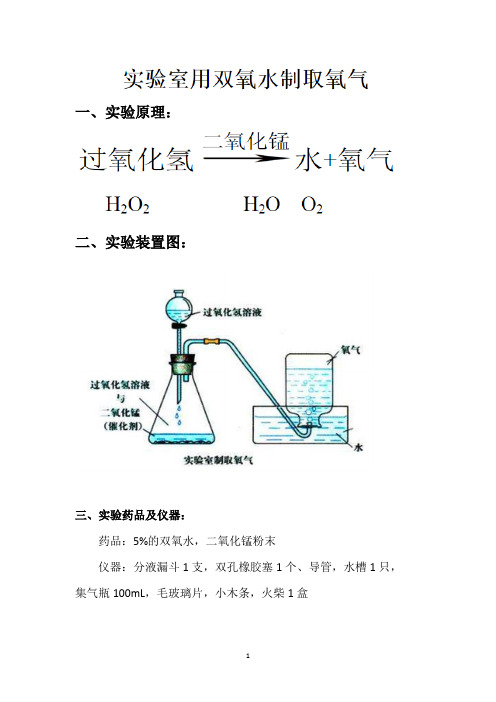
一、实验原理:
二、实验装置图:
三、实验药品及仪器:
药品:5%的双氧水,二氧化锰粉末
仪器:分液漏斗1支,双孔橡胶塞1个、导管,水槽1只,集气瓶100mL,毛玻璃片,小木条,火柴1盒
四、实验步骤:
1.连接好实验装置,检查试验装置气密性
2.在锥形瓶中加入少量的二氧化锰粉末,塞紧橡胶塞,再分液漏斗中加入适量的过氧化氢溶液。
3、打开活塞,等气泡连续均匀冒出时,把导管口伸入盛满水的集气瓶,开始收集气体。
4、等集气瓶中液面下降至瓶口,瓶外有气泡产生时,在水面下用玻璃片盖住瓶口。
小心地把集气瓶移出水槽,正方在桌子上。
5、将带火星的木条伸入集气瓶中,观察现象
6、实验完毕,整理器材。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过氧化氢制取氧气的步骤解析
2
通过过氧化氢在二氧化锰的催化下生成水和氧气(固体与液体不加热的方法)来制取氧气,是实验室制取氧气的常见方法之一。
那么过氧化氢制取氧气的步骤解析你清楚吗?下面就一起随佰佰安全网小编来了解一下吧。
①检查装置气密性
②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花)
③将试管固定在铁架台上
④点燃酒精灯,预热后加热试管
⑤当导管口有连续均匀的气泡冒出时开始收集气体
⑥收集完毕,先将导管移出水面
⑦熄灭酒精灯。
加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。
可用谐音记忆为“茶庄定点收利息”。
过氧化氢制取氧气注意事项
①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。
②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。
③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。
④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。
