杂环季铵盐汇总
杂环化学总结
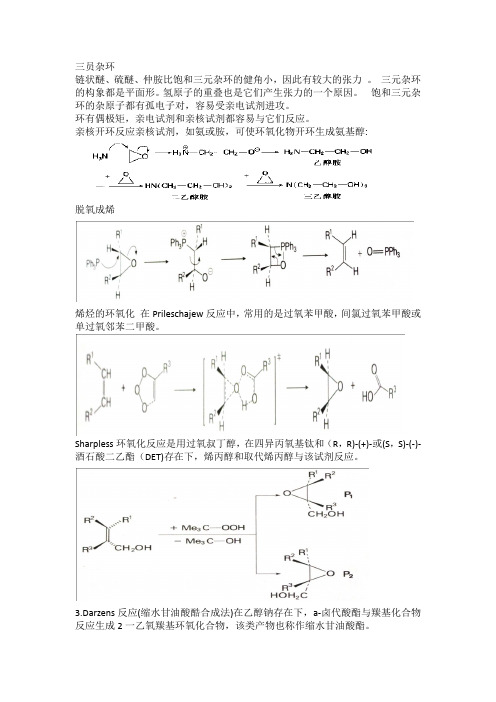
三员杂环链状醚、硫醚、仲胺比饱和三元杂环的健角小,因此有较大的张力。
三元杂环的构象都是平面形。
氢原子的重叠也是它们产生张力的一个原因。
饱和三元杂环的杂原子都有孤电子对,容易受亲电试剂进攻。
环有偶极矩,亲电试剂和亲核试剂都容易与它们反应。
亲核开环反应亲核试剂,如氨或胺,可使环氧化物开环生成氨基醇:脱氧成烯烯烃的环氧化在Prileschajew反应中,常用的是过氧苯甲酸,间氯过氧苯甲酸或单过氧邻苯二甲酸。
Sharpless环氧化反应是用过氧叔丁醇,在四异丙氧基钛和(R,R)-(+)-或(S,S)-(-)-酒石酸二乙酯(DET)存在下,烯丙醇和取代烯丙醇与该试剂反应。
3.Darzens反应(缩水甘油酸酷合成法)在乙醇钠存在下,a-卤代酸酯与羰基化合物反应生成2一乙氧羰基环氧化合物,该类产物也称作缩水甘油酸酯。
Corey合成法该合成方法是由卤化三烷基锍盐或卤化三烷基亚砜盐衍生的S一叶立德与羰基化合物反应四员杂环1.β-氨基酸环化脱水制得【2+2】环加成反应(1)亚胺十烯酮.亲电取代反应呋喃发生亲电取代反应的速度要比苯快。
原因如下:①呋喃的共振能比苯低;②呋喃环上每个原子的电子密度大于1,而苯环上每个原子的 电子密度等于1。
1,4-二羰基化合物(Paal-Knorr反应)在酸碱平衡中,酸加到1,4-二羰基体系13中的一个羰基上,使第2个羰基能与其发生分子内亲核反应形成14;最后,在酸催化下,发生β-消除反应。
.Feist-Benary合成a-卤代羰基化合物和β-酮羧酸酯发生环缩合反应生成3-呋喃酸。
噻吩噻吩的芳香性小于苯大于呋喃,原因:①因为硫和氧相比有较低的电负性,硫上的电子对能更有效地共轭;②硫,作为第二短周期的元素,能够扩展其八隅体。
噻吩的亲电取代反应活性和苯甲醚相近。
反应机制与呋喃相同,取代反应发生在2-位或2,5-位。
光异构化反应最简单的方法是1,4-二碳基化合物硫化后再环化脱水,这和呋喃的Paal-Knorr合成类似。
药物合成中最常见的7类N-杂环结构

药物合成中最常见的7类N-杂环结构氮杂环结构是药物中最重要的结构组成之一,在已上市药物中约包含25种最常见的N-杂环结构,可归纳为如下七类:三元杂环和四元杂环,五元杂环,六元杂环,七元八元杂环,融合杂环,桥环,大环氮杂环。
25种最常见的N-杂环结构如上所示,其中哌啶环在药物中的使用频率最高,吡啶环次之,依次是哌嗪环,β-内酰胺,吡咯,噻唑和咪唑等。
4种最常见的四元N-杂环结构是:头孢烯(Cephems), 青霉烷类(Penams),碳青霉烯类(Carbapenem),2-氮杂环丁酮(2-Azetidinone)。
5种最常见的五元N-芳香杂环结构分别是:噻唑(thiazole),咪唑(imidazole), 吲哚(Indole),四氮唑(tetrazole), 苯并咪唑(benzimidazole)。
5种最常见的五元N-杂非芳香杂环结构分别是:吡咯烷(pyrrolidine),咪唑啉啶(imidazolidine),咪唑啉(imidazoline),恶唑烷(oxazolidine),吲哚啉(indoline)。
5种最常见的六元N-杂芳香杂环结构分别是:吡啶,嘧啶,喹唑啉,喹啉,吡嗪。
5种最常见的六元N-杂非芳香杂环结构分别是:哌啶,哌嗪,吩噻嗪,4-喹啉酮,吗啉。
6种最常见的七元N-杂环结构分别是:苯二氮卓类,二苯二氮卓类,环己亚胺(azepane),二苯并氧氮杂卓类(Dibenzo-oxazepine),四氢苯并[b]氮杂卓(Tetrahydro-beno[b]azepine),四氢苯并[d]氮杂卓(Tetrahydro-beno[d]azepine)。
4种最常见的融合N-杂环结构分别是:麦角林、嘌呤、二氢嘌呤-2,6-二酮、苯并[f]三唑并[1,4]二氮杂卓类。
4种最常见的桥环N-杂环结构:吗啡、托烷、奎宁、苯并吗啡。
参考文献:J. Med. Chem. 2014, 57, 10257。
杂环化合物及其衍生物

12.1.4杂环化合物及其衍生物选述Selected Introduction of HeterocyclicCompounds and Their Derivatives(1)呋喃及其衍生物。
呋喃存在于松木焦油中,是无色而有特殊气味的气体。
沸点320C ,不溶于水而溶于乙醇、乙醚等有机溶剂。
它遇盐酸浸湿的松木片显绿色,被称为松木片反应。
用此反应可以检查呋喃的存在。
呋喃是有机合成的原料。
①α- 呋喃甲醛。
α- 呋喃甲醛最早是由米糠与稀酸共热制得的,故又称糠醛,通常利用含有多聚戊糖的农副产品如米糠、玉米芯、高梁杆、花生壳等作原料来制取:OCHO(C 5H 8O 4)n + nH 2O+H HC C HHO HC CH OH +-3nH 2O多聚戊糖 戊醛糖 糠醛纯粹的糠醛是无色而有特殊气味的液体,沸点1620C ,微溶于水,易溶于乙醚和乙醇等有机溶剂。
在空气中被氧化聚合为黄色、棕色以至黑褐色的物质。
在醋酸存在下与苯胺呈鲜红色反应,可用于糠醛与戊糖的鉴别。
糠醛是一个不含α-氢原子的不饱和醛,化学性质很活泼,容易发生氧化、还原、歧化和聚合等反应,是有机合成工业的重要原料,广泛应用于油漆、树脂、医药和农药等工业。
②呋喃类药物。
呋喃坦丁、呋喃唑酮和呋喃西林是一类5-硝基呋喃甲醛的衍生物。
它们都是人工合成的广谱抗菌药物,其结构式如下:OO 2NCHNOO 2NN H呋喃坦丁 呋喃唑酮OO 2NCHNH C NH 2O呋喃西林呋喃坦丁又名呋喃妥因。
它是鲜黄色晶体,味苦,熔点约2580C (分解),难溶于水及有机溶剂,可溶于N ,N -二甲基甲酰胺中。
由于它的分子中含有酰亚胺结构,故显弱酸性,能与碱生成盐。
它主要用于抑制和杀灭大肠杆菌、金葡萄球菌、化脓性链球菌和伤寒杆菌等,常用于治疗泌尿系统的炎症。
呋喃唑酮又名痢特灵。
它是黄色粉末,熔点254~2580C (分解),难溶于水及有机溶剂,呈弱酸性。
大肠杆菌、炭疽杆菌、痢疾杆菌和伤寒杆菌等对其最为敏感,故常用于治疗肠道感染和菌痢等。
表面活性剂应用导论第5章阳离子表面活性剂

5.1 阳离子表面活性剂概述
②锍盐化合物
锍盐化合物可溶于水,具有除草、杀灭软体动物、
杀菌和杀真菌等作用,是有效的杀菌剂,而且对皮肤的
刺激小,因此使用性能优于传统的季铵盐化合物。
氧化锍衍生物是锍盐型阳离子表面活性剂中性能十
分优异的品种,它在阴离子洗涤剂和传统的松香皂配方
中均能保持良好的杀菌性。
R1
+
γ(0.01%溶液) 72.3 72.2 71.9 70.9 68.7 67.1 62.4 53.9 43.7 43.2 43.4 43.6
CH3
+ R N CH2
Cl-
CH3
①随着烷基碳链长度的 增加,表面活性剂的表 面张力逐渐下降。
表中: γ-表面张力,mN/m
5.2 阳离子表面活性剂的性质
(3)表面张力 分子结构相同时,表面张力与溶液的浓度有关:
季铵盐分子中所含的主要是吗啉环、 吡啶环、 咪 唑啉环、 哌嗪环、 喹啉环,等。
主要用作:
湿润剂、洗涤剂、杀菌剂、缓蚀剂、纤维柔软剂、 助染色剂、抗静电剂、分散剂、起泡剂,等。
5.3 几种阳离子表面活性剂
(4)含杂环的季铵盐 ①含有吗啉环的季铵盐
+ C16H33 N
O· HCl ·(SO3OCH3)-
Krafft点可以衡量表面活性剂的溶解性能。
5.2 阳离子表面活性剂的性质
(2)Krafft 温度点 ②Krafft点与成盐的配对阴离子的关系
如,配对阴离子对十六烷基吡啶Krafft点的影响:
+ C16H33 N
X-
配对阴离子X
Cl Br I
Krafft点/℃
17 28 45
按照 Cl、Br、I的次序,表 面活性剂的Krafft点温度升高, 由此可知,其溶解性能将按此 顺序依次降低。
含氮有机化合物和杂环汇总

CH3NHCH2CH3 甲乙胺 (仲胺) 甲基-乙基-环丙基 H 3C N CH2CH3 胺(叔胺)
6
NHCH 3
N-甲基苯胺
邻-甲基苯胺 N-甲基-N-乙基 苯胺
7
NH 2 CH3
N CH3 CH2CH3
CH2NH 2
+ NH 3 Cl
苯甲胺(苄胺) 氯化苯铵 溴化四甲铵
-
(CH3)4N Br
31
第二节 重氮化合物 和偶氮化合物
重氮化合物 R-N=N(Ar)
偶氮化合物
R-N=N-R’ (Ar)
32
重氮化合物的化学性质 1.重氮基取代反应(放氮反应)
33
OH
+
N2
H
+
3 PO 2+ H 2O
O H2
/ △
N2
N2
N) 2 C ( u 2 C N KC
+
Cu
2X 2
+H
X
CN N2
X
+
27
(3) 叔胺和亚硝酸反应
N(CH3)2
N(CH3)2
+ HNO2
N O
28
鉴别:
伯胺 脂 肪 族 仲胺
HNO2
N2 黄色油 状物
叔胺
溶解
29
五.与医学有关的胺类
苯胺
NH 2 + 3Br2(水)
Br Br NH 2 Br + HBr
白
30
ห้องสมุดไป่ตู้
拓展
“新洁尔灭”
溴化二甲基十二烷基苄基铵,又称苯扎溴 铵(C6H5CH2N+(CH3)2C12H25Br-),商品名为 “新洁尔灭”。它为季铵盐型阳离子表面活性 广谱杀菌剂,杀菌力和去垢效力强,对皮肤和 组织无刺激性,对金属、橡胶制品无腐蚀作用, 不污染衣服,性质稳定,易于保存,属消毒防 腐类药物。1:1000~2000的新洁尔灭溶液广泛 用于手、皮肤、粘膜、器械等的消毒。
【大学】表面活性剂(5)

2.3 阳离子表面活性剂
2.3.1阳离子表面活性剂的概述 • 阳离子表面活性剂主要是含氮的有机胺衍
生物,由于分子中的氮原子含有孤对电子, 故能以氢键与酸分子中的氢结合,使氮基 带上正电荷。因此,他们在酸性介质中才 具有良好的表面活性剂;而在碱性介质中 容易析出而失去表面活性,除了含氮阳离 子表面活性剂外,还有一部分含硫、磷、 砷等元素的阳离子表面活性剂。
亲核加成反应, 反应中叔胺的氮原子上有一 对孤对电子, 它易进攻环氧树脂的环氧基团, 使之发生开环加成反应:
.
.
环氧树脂与十六叔胺在酸性介质中的反应方程式如下:
.
2.3.4 阳离子表面活性剂的应用特点
• 与各种类型表面活性剂相比,阳离子表面活
性剂的调整作用最突出,杀菌作用最强,尽
管有去污力差,起泡性差,配伍性差、刺激
性大,价格昂贵等缺点。
• 阳离子表面活性剂不直接与阴离子表面活性
剂配伍,只能作为调理剂组分或杀菌剂来使
用。阳离子表面活性剂在液体洗涤剂中作为
辅助表面活性剂(配方用量很少的调理剂组
分)一般用于较高档次产品,主要用于洗发
香波。作为调整剂组分在高档次液体洗涤剂
洗发香波中不是其他类型表面活性剂所能替
代的。
.
•HLB值是用来衡量表面活性剂分子中的亲水基团和亲油基 团对整个分子所做贡献大小的物理量,是选择表面活性剂的 一个经验值。
•将表面活性剂分子结构分解为一些基团,每一基团对HLB 值均有确定的贡献。由实验可测得各种基团的HLB值,将基 团的HLB值带入公式即可计算表面活性剂分子的HLB值。
HLB=7+∑(亲水基团数) - ∑(亲油基团数)
•HLB值越大,亲水性越大; HLB值越小,亲油性越大。
第5章 阳离子表面活性剂
+
CH2CH2 O . HCl . CH3OSO2O
.
_ Cl
. Cl
_
C11H25
+ N
. Cl
_
式中,R是含8~22个碳原子的烷基;R/是低级烷基或苄基
含吡啶环的季铵盐
纤维防水剂、染色助剂和杀菌剂。
CnH 2n+1 + N
. Cl
_
C17H35CONHCH2
+ N
. Cl
_
n=12或16,X为Cl或Br 或 , 为 或
C2H5 C17H33CONHCH2CH2 N C2H5 + (CH3O)2SO2 C17H33CONHCH2CH2 CH3 N + CH3
NaOH
C2H5
3C17H33COCl + H3PO4
C 2 H5 C17H33CONHCH2CH2 N C2H5
. CH3SO4_
CH3
表面活性剂Sapamine MS 表面活性剂 色必明
方法二:脂肪酸和伯胺直接进行N-酰化反应。
2C17H35COOH
140~170 C , N2 + H2NCH2CH2NHCH2CH2NH2 _ 2H2O
O
CH2
CH O
CH2Cl
O
C17H35CO CONHCH2CH2NHCH2CH2NHCOC17H35
110~120 C
+ _ C17H35CONHCH2CH2NHCH2CH2NHCOC17H35 . Cl CH2 HC O CH2
R1 RX + N R2 R3 R
R1 N R2 R
3
.
_ X
(1)十二烷基三甲基溴化铵 )
第九章 含氮及杂环化合物
17
9.2 胺类化合物
9.2.1 胺的分类、命名和结构特征
9.2.1.1 分类 氨分子中的一个、两个或三个氢原子被烃基取代的产物分别称为第一胺,第二胺和第三胺,或 称为伯胺、仲胺、叔胺。
N O深紫红色
NO 2 2,4,6-三硝基苯甲醚
12
9.1 硝基化合物
9.1.3 硝基化合物的化学性质
9.1.3.5 硝基对芳香环上取代基的影响 (1) 硝基对卤素活泼性的影响
能量
O N O
F OCH 3
O N O F
+ CH 3O
O N O OCH 3 +
F
反应坐标
芳环上双分子亲核取代反应的能线图
硝基的吸电子诱导效应(-I)大于羰基。硝基化合物的α-H的酸性强于羰基化合物的α-H。硝基与芳 环相连时,共轭效应也表现为强吸电子共轭效应(-C)。
3
9.1 硝基化合物
9.1.3 硝基化合物的化学性质
9.1.3.1 α-H的酸性
硝基化合物有较强的酸性:
例如:CH3NO2(pKa=10.2),CH3CH2NO2(pKa=8.5), CH3CH2CH2NO2(pKa=7.8) 硝基烷烃能跟NaOH作用生成盐:
-
RCH2NO2 + NaOH
[RCHNO2]Na+ + H2O
RCHNO2存在下列异构现象:
O RC HN O
-
RHC
N
OO
4
9.1 硝基化合物
9.1.3 硝基化合物的化学性质
季铵盐表面活性剂总结
季铵盐型阳离子表面活性剂
从结构上看,季铵盐型阳离子表面活性剂是铵盐的4个氢原子被有机基团取代而形成的,通常是用叔胺与烷基化剂进行反应制得。
所用的烷基化剂有:氯甲烷、苄基氯等卤代烷;硫酸二甲酯等硫酸二烷酯。
分别用这些烷基化剂与叔胺反应可获得相对应的季铵盐型表面活性剂。
季铵盐阳离子表面活性剂的碱性较强,在碱性溶液中不产生游离胺,性质稳定。
季铵盐型阳离子表面活性剂有许多优良性能,可用作纤维的抗静电剂、柔软剂、缓染剂、固色剂等,还可用作杀菌消毒剂和发用化妆品的护发剂等。
按结构,季铵盐型阳离子表面活性剂可分为烷基三甲基铵盐型、二烷基二甲基铵盐型、烷基二甲基苄基铵盐型等。
(1)烷基三甲基铵盐型阳离子表面活性剂。
烷基三甲基铵盐是以高级脂肪胺与氯甲烷在氢氧化钠存在下进行反应制得的。
这种表面活性剂的代表性产品为十六烷基三甲基氯化铵和十八烷基三甲基氯化铵,易溶于水,呈透明状,具有良好的表面活性,可用作洗发剂、杀菌洗涤剂、聚苯乙烯树脂等外部涂敷用抗静电剂、纤维用抗静电剂、匀染剂、破乳剂和分散剂等。
(2)二烷基二甲基铵盐型阳离子表面活性剂。
二烷基二甲基铵盐是以二烷基胺或者二烷基甲基胺与氯甲烷,在氢氧化钠存在下进行反应制得的。
这种表面活性剂可作为洗发剂或家用纤维制品的柔软剂,性能良好。
(3)烷基二甲基苄基铵盐型阳离子表面活性剂。
烷基二甲基苄基氯化铵是以烷基二甲基叔胺与氯化苄反应制得的。
其中有代表性的是十二烷基二甲基苄基氯化铵(1227),易溶于水,呈透明状,含量为万分之几即有杀菌消毒能力,对皮肤无刺激,无毒性,对金属不腐蚀,即使在沸水中亦稳定,其杀菌力随pH值升高而增大,此外还具有良好的发泡力。
第十章 胺及杂环化合物
胺 amines
胺可以看作氨 (NH3) 的烃基衍生物,是生物界 最丰富的一类化合物
Viagra ®
(普鲁卡因)
胺对有机化学家来说同样是重要的一类化合物
10.1.1 胺的分类和命名
胺的分类
氨 (NH3,ammonia) 的一个或多个氢被烃基取 代所得到的化合物称为胺 (amine)
(氨)
(吗啡)
(阿托品)
大多数生物碱都是 氨基酸的代谢产物
大多数生物碱都具有显著的生物活性
(抗痉挛药)
Atroperum
(颠茄)
(罂粟)
Cinchona ledgeriana
(金鸡纳树)
(抗疟疾药)
Lycoris radiata
(石蒜)
(抗重症肌无力药)
脂肪胺 叔胺 > 仲胺 > 伯胺 > NH3 > 苯胺 酰胺
溶剂化效应
溶剂与溶解于其中的分子 或离子之间的相互作用称 为溶剂化效应
氢键
R
+
N
H H H
:OH2 :OH2 :OH2
--- 共轭酸 (铵正离子) 的稳定性
伯胺 > 仲胺 > 叔胺
空间效应
氮原子上连接的烃基对氮原子上孤对电子的屏蔽作用 烃基的数目越多或体积增大,胺的碱性降低
碱性
氮原子上的孤对电子 没有参与大 p 键的形 成,有一定的自由度
吡啶的碱性弱于氨/胺 (sp3),这是因为sp2杂化 轨道上s成分较多,距核较近,因而该氮原子 孤对电子受核束缚较强 吡啶碱性强于苯胺
吡啶的反应
• 亲电取代反应
活性比苯低,较难反应
取代基多进入b位 (3位)
• 还原反应 (比苯易还原)
NH2
CH3CH2NH2
