2021高考化学一轮复习专题4第2讲氯及其化合物卤素课件新人教版
高考化学一轮复习:4.2《氯及其化合物》ppt课件

(2)实验装置:
(3)验满方法: ①将湿润的淀粉碘化钾试纸靠近盛 Cl2 的集气瓶口,观 察到试纸立即变蓝,则证明已集满。 ②将湿润的蓝色石蕊试纸靠近盛 Cl2 的集气瓶口,观察 到试纸先变红后褪色,则证明已集满。 ③实验室制取 Cl2 时,常常根据集气瓶中气体的颜色判 断是否收集满。
2.注意事项 (1)必须用浓盐酸,MnO2 与稀盐酸不反应。 (2)为了减少制得的 Cl2 中 HCl 的含量,加热的温度不宜 过高,以减少 HCl 的挥发。 (3)实验结束后,先使反应停止并排出残留的 Cl2,再拆 卸装置,避免污染空气。 (4)尾气吸收时,不能用澄清石灰水吸收 Cl2,因为溶液 中 Ca(OH)2 浓度小,吸收不完全。
【答案】 (1)证明制备 Cl2 时有 H2O(g)挥发出来 吸收 HCl 中的 Cl2,防止干扰 HCl 检验
(2)证明干燥 Cl2 无漂白性 证明 HClO 有漂白性 (3)证明制备 Cl2 时有 HCl 挥发出来 防止 F 中的溶液倒 吸
(4)E F 湿润的有色布条或湿润的淀粉 KI 试纸 检验 Cl2 是否除尽
(2)写出步骤③中第一份及第二份滤液发生反应的离子 方程式:
第一份_________________________________________。 第二份________________________________。 (3)试根据所学知识推测,在②的滤液中含有的溶质,除 了溶解的极少量氯气外,还含有的其他溶质为(写化学 式)________________________________________________。
物质的检验和比较
[典例导引] (2013·广东高考)化学实验有助于理解化学知识,形成化 学观念,提高探究与创新能力,提升科学素养。 在实验室中用浓盐酸与 MnO2 共热制取 Cl2 并进行相关 实验。 设计实验比较 Cl2 和 Br2 的氧化性,操作与现象是:取少 量新制氯水和 CCl4 于试管中,_________________________。
2021届人教版高中化学高三一轮总复习:非金属及其化合物-氯及其化合物 课件 ppt

【思考3】漂白粉的Байду номын сангаас白原理?
Ca(ClO)2+H2O+CO2=CaCO3 ↓ +2HClO
漂白粉失效的原因?
Ca(ClO)2+H2O+CO2=CaCO3 ↓
+2HClO
光
2HClO
2最H终C是l +什O么2成↑分?CaCl2
三、Cl2的制备
1、工业制法 (氯碱工业)
通电
2NaCl + 2H2O
2NaOH + H2↑+ Cl2↑
17、如果您无法控制何时入睡,那么您拥有什么资格来控制自己的生活并使自己变得更好呢?一开始并不容易。只要长期坚持下去,您就能 收获很多并成长。许多人不会一直待在舒适的地方。工作越努力,您就越幸运,自律越强,您的生活就会越高。
13、一个人的气质掩盖了他对生活的良好态度。实际上,生活并没有我们想象的那么糟糕。毕竟,一个人的成长就是突破外面厚厚的土壤, 这样才能有希望的突破。
HClO 氯水 漂白粉 Na2O2 H2O2
O3
SO2
漂白原理
氧化漂白 —不可逆
漂白效果
永久性漂白
与有色物质结合生成 暂时性漂白, 不稳定的无色物质。 不能漂白指示剂
活性炭 物理吸附
16、最后,您最终将理解有些人有某些东西,但是,无论是爱还是不爱,无论陪伴还是离开,您都必须时刻准备着接受所有的事故。 10、您偷走的每个懒惰都会为您自己挖一个坑。在未来的日子里,您必须付出很大的努力来填补所挖的漏洞。您现在吃的所有苦味都是为了 未来。有所作为。将来,您将享受痛苦带来的快乐。
8、下雨的时候,我知道谁会送你一把雨伞。当某件事发生时,我知道谁对你真诚。有些人只会在蛋糕上加糖霜,不会在雪地里放木炭。有些 人只会给火上添油,而不会彼此诚实。
高考化学一轮复习 第二章 第2节 氯及其化合物配套课件
(5)与还原性无机化合物反应(书写离子方程式): ①与碘化钾溶液反应: 2I-+Cl2===I2+2Cl- 。
②与 SO2 水溶液反应:Cl2+SOபைடு நூலகம்+2H2O===4H++2Cl- +SO24-。
(× )
2.如遇到氯气泄漏,应如何自救? 提示:Cl2 的密度比空气大,要逆风向高处转移。由于 Cl2 易 和碱反应,可用蘸有肥皂水或纯碱溶液的毛巾捂住鼻孔。
3.久置的氯水和新制氯水性质上有哪些差异?
提示:长时间放置的氯水最终会变成稀盐酸,溶液酸性增强,
但氧化性降低,最终溶液由黄绿色变成无色。 4.把 Cl2 通入石蕊溶液中的现象是什么?能否用 pH 试纸测定
氯水的 pH? 提示:先变红后褪色;不能用 pH 试纸测定氯水的 pH。
5.试写出下列反应的离子方程式: (1)向 FeBr2 溶液中通入少量 Cl2:_______________________。 (2)向含 1 mol FeBr2 的溶液中通入 1 mol Cl2:____________。 (3)向 FeI2 溶液中通入少量 Cl2:_______________________。 (4)向 FeI2 溶液中通入足量 Cl2:________________________。 答案:(1)2Fe2++Cl2===2Fe3++2Cl- (2)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- (3)2I-+Cl2===I2+2Cl- (4)2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
为 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
高中化学一轮复习课件:氯及其化合物课件

H2+Cl2
2HCl
苍白
白雾
[注意] 氯气可与Si、P等大多数非金属单质化合,如2P+3Cl2
Si+2Cl2
SiCl4。
2PCl3、
(3)从化合价的角度认识Cl2产生的“歧化反应” Cl2中氯元素为0价,处于氯元素的中间价态,因此Cl2既具有氧化性又具有还原性。 常温下,Cl2与水或碱溶液反应时,Cl2产生“歧化反应”,Cl元素由0价变为+1价和-1价。
为
,最外层有7个电子,在化学反应中很容易 得到 1个电子,使
最外电子层到达8个电子的稳定结构。
(1)与金属反应 氯气能与大多数金属化合,生成金属氯化物;与变价金属(Fe、Cu等)反应生成 高价态金属氯化物。
2Fe+3Cl2
2FeCl3
Cu+Cl2
CuCl2
(2)与非金属反应
H2+Cl2 2HCl
⑥ Ca(ClO)2+4HCl(浓) =CaCl2+2Cl2↑+2H2O ;
⑦ 2Fe+3Cl2 2FeCl3 ;
⑧ H2+Cl2 2HCl ;
⑨ Fe+2HCl =FeCl2+H2↑
(其他合理答案均可)
。
1.判断正误(正确的打“√”,错误的打“×”) (1)新制氯水在空气中久置,氯水酸性增强,氧化性减弱( √ )
[解析]氯气与Na、Fe、Cu和H2反应,生成金属氯化物或HCl,Cl2均是氧化剂,表 现氧化性,A正确; 金属钠的熔点低,且灼烧生成过氧化钠,正确的操作为取一块绿豆大的金属钠, 用滤纸吸干煤油、切去氧化层,放在陶土网上用酒精灯微热,待钠熔成小球,将 盛有Cl2的集气瓶迅速倒扣在钠上方,B错误;
公开课 高三化学一轮复习 氯气及其化合物_卤素_PPT课件

(3)AgF溶于水,CaF2难溶; (4)F元素无正价,氟无含氧酸;
(5)HF水溶液呈弱酸性,而HCl,HBr,HI水溶液为 强酸性;
氯
⑴凡能生成次氯酸的物质均有强氧化 性〔Cl2水、NaClO、Ca(ClO)2〕;
⑵Cl-+Ag+=AgCl↓(白),不溶于稀 HNO3;
Cl
的相同点 电子,有强氧化性
Br
①核电荷数增加
I
原子结构上 ②电子层数增加
At
的不相同点 ③原子半径增大
元素的非金属性依次减弱 单质的氧化性依次减弱 对应离子(X-)的还原性依次增强
2、化学性质 (1)液氯和氯水
液氯 分类 纯净物
氯水 混合物 新制氯水 久置氯水
成分
只有Cl2 分子
分子:Cl2 HClO H2O 离子:H+ Cl- ClO-OH-
加成
与CH2=CH2、乙炔等 不饱和烃加成
【例】 Cl2在70℃的NaOH水溶液中,能同时 发生两个自身氧化还原反应,反应完全后测
得溶液中NaClO与NaClO3的物质的量之比为
1︰2,则反应中被氧化的Cl2与被还原的Cl2
的物质的量之比为
D
A. 2︰3
B. 4︰3
C. 10︰3
D. 3︰11
(3)、卤素单质的化学性质及递变规律
2FeBr3
与Cu
反应 Cu+Cl2=
方程
CuCl2
式
Cu+Br2= CuBr2
2Cu+I2= 2CuI
④与强碱反应:
X2 + 2NaOH = NaX + NaXO + H2O
公开课 高三化学一轮复习 氯气及其化合物_卤素36页PPT

谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来 Nhomakorabea苦涩的,回味起来却有 久久不会退去的余香。
公开课 高三化学一轮复习 氯气及其化合 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。 物_卤素
2020-2021学年人教版高三化学一轮复习讲义4.2.1氯及其化合物

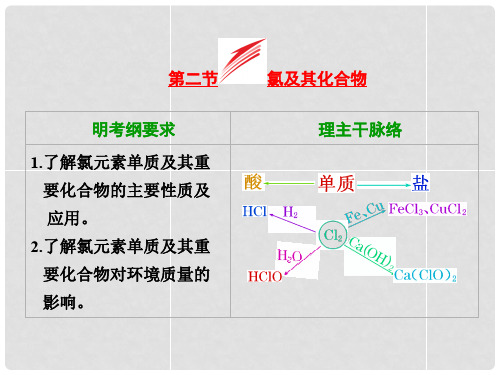
第四章非金属及其化合物第2讲氯及其化合物[课程标准]1.结合真实情境中的应用实例或通过实验探究,了解氯及其重要化合物的主要性质。
2.知道氯气及其主要化合物的制备方法,认识其在生产中的应用和对生态环境的影响。
考点一氯及其重要化合物知识梳理1.物理性质2.化学性质(1)与金属反应。
①与铁反应:_____________________________(________烟)②与铜反应:_____________________________(________烟)③与钠反应:_____________________________(________烟)(2)与非金属反应。
与H2反应:__________________________________________________,(3)与水反应。
离子方程式为___________________________________________________________。
(4)与碱反应:与NaOH溶液反应。
离子方程式为____________________________________________________________。
(5)与还原性物质反应。
①与碘化钾溶液反应:__________________________________________________。
②与SO2水溶液反应:___________________________________________________。
③与FeCl2溶液反应离子方程式为__________________________________________。
(6)参与有机反应①取代反应:____________________________________②加成反应:____________________________________[回扣判断](正确的打“√”,错误的打“×”)(1)氯气的水溶液可以导电,说明氯气是电解质()(2)Cl2通入水中的离子方程式为Cl2+H2O===2H++Cl-+ClO-()(3)Cl2具有很强的氧化性,在化学反应中只能作氧化剂()(4)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5N A()(5)用pH试纸测定氯水的pH为4()(6)常温下干燥的氯气或液氯均不与铁反应,故液氯通常储存在钢瓶中()[重点提醒]关于氯气与水的反应1.三个平衡:Cl2+H2O HClO+HCl、HClO H++ClO-、H2O H++OH-。
高考化学一轮复习第4单元 第2课时 氯及其化合物 讲义(人教版)

第四单元 非金属及其化合物第二课时 氯及其化合物复习目标:1.掌握氯元素单质及其重要化合物的主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.了解氯及其重要化合物的制备方法。
考点一氯及其化合物的性质和应用自主梳理1.氯元素的原子结构 氯元素位于元素周期表中第三周期ⅦA 族,原子结构示意图为,最外层有7个电子,在化学反应中易获得1个电子而表现为-1价。
自然界中氯主要以化合态形式存在。
tQex4Mo7f4HH2J8GRy1O TdAoAj7YrMesWjngZ8eAuZm3jxDuKVmpI5ngfQWLFqGtQeLIlSGJkqkURx52FDdwpPKQW709btV3jSd 4。
2.氯气的性质(1)物理性质:颜色气味 毒性 密度 特性 黄绿色 强烈刺激性气味 有毒 比空气大 易液化注意:闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的Cl 2飘进鼻孔。
(2)化学性质:①与金属反应:与变价金属反应生成高价金属氯化物(书写化学方程式)。
a .与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
b .与铜反应:Cu +Cl 2=====点燃CuCl 2。
②与非金属反应:与H 2反应:H 2+Cl 2=====点燃2HCl 。
③与水反应:溶于水的氯气部分与水反应,离子方程式为Cl 2+H 2O H ++Cl -+HClO ;④与碱反应:与NaOH 溶液反应,离子方程式为Cl 2+2OH -===Cl -+ClO -+H 2O ;⑤与还原性无机化合物反应(书写离子方程式):a .与碘化钾溶液反应:2I -+Cl 2===I 2+2Cl -。
b .与SO 2水溶液反应:Cl 2+SO 2+2H 2O===4H ++2Cl -+SO 2-4。
goxsAsM8fLbzu6KjRng4MAXFNII2kLHAfCn5fIJIRGB1QjhgGXzPI3NGrSFRJJNt3BkSJE39Dyc5ZVOuqrlncSSbOHEn2RY8S7Xf 。
