乙醛乙烯乙烷乙炔的c-c键长
乙炔_乙炔
化学 性质
二、乙炔的性质
物理性质
乙炔为无色、无味的气体, 密度比空气略小,微溶于水,易 溶于有机溶剂。
化学性质
(A)氧化反应:
(1)被氧气氧化:
甲烷、乙烯、乙炔的燃烧
淡蓝色火焰
火焰明亮 带有黑烟
火焰很明亮带 有浓烈黑烟
实验现象:火焰很明亮,带有浓烈黑烟 完全燃烧方程式:
2C2H2+5O2 点燃 4CO2+2H2O
观察分析上面的热化学方程式,并思考生产中 为什么常用氧炔焰来切割或焊接金属,而不用 氧烷焰或氧烯焰呢?
乙炔完全燃烧所需氧的物质的量最少,生成水的 物质的量也最少,因此燃烧时用以提高氧温度以 及水气化所消耗的反应热也最少,所以乙炔火焰 温度最高。
(2)被酸性KMnO4溶液氧化。
2KMnO4 + 3H2SO4 + C2H2 → 2MnSO4 + K2SO4 + 2CO2 + 4H2O
b.与H2加成
催化剂
CHCH + H2
CH2=CH2 + H2
催化剂
CH2=CH2
CH3CH3
c.与HCl加成
CHCH + HCl nCH2 = CHCl
催化剂
CH2= CHCl
氯乙烯
催化剂
加温、加压
CH2CH
n
Cl
聚氯乙烯
聚乙烯:用聚乙烯薄膜做成塑料袋是无毒的,可
以用来盛装食物,只是强度差些,且不能经受80℃ 以上的高温,并有一定的透气性,不宜长期用来盛 装茶叶、香料等。
四、乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。 2、 乙炔是一种重要的基本有机原料,可 以用来制备氯乙烯、 聚氯乙烯和乙醛等。
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
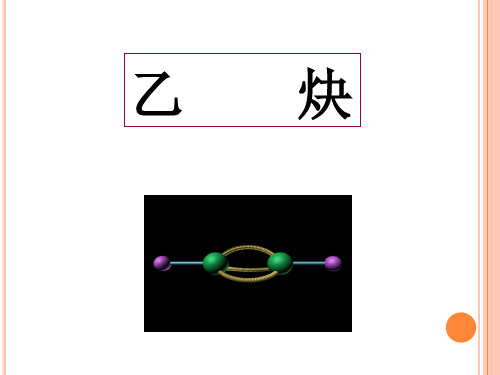
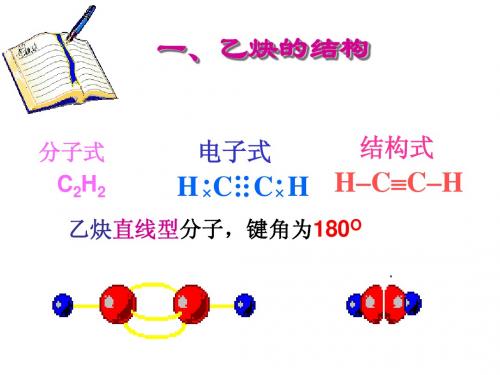
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
邢其毅《基础有机化学》(第3版)(上册)配套题库【课后习题】第1章~第3章【圣才出品】

圣才电子书 十万种考研考证电子书、题库视频学习平台
(ii)哪些化合物分子中的原子都在一条直线上? (iii)哪些化合物分子中的原子处在两个相互垂直的平面中? (iv)哪些化合物分子中的碳原子都是 sp3 杂化轨道? 解:(i)乙炔、乙烯、苯分子中的原子都在同一平面中。 (ii)乙炔分子中的原子都在同一直线上。 (iii)丙二烯分子中的原子处在两个相互垂直的平面中。 (iv)甲烷、环己烷分子中的原子都是 sp3 杂化。
;极性化合物为:
;非极性化合
物为:
。
习题 1-6 结合教材(P18)表 1-3 中的数据回答下列问题:
(i)甲烷、乙烯、乙炔中的C—H键键长为什么不同?
(ii)乙烷、乙烯、乙炔中碳碳键键长为什么不同?
(iii)卤甲烷中的碳卤键的键长为什么不同?
解:(i)甲烷、乙烯、乙炔中,碳原子的杂化方式不同,甲烷中碳为 sp3 杂化,乙烯中
习题 1-8 将下列各组化合物按键解离能(只考虑下划线的键)由大到小排列成序。 (i)
(ii) (iii)
解:参考教材表(P19)1-5 中的一些常见键的解离能,可知:
(i)
>
>
>
>
5 / 76
圣才电子书 十万种考研考证电子书、题库视频学习平台
>
>
>
(ii)
>
>
>
(iii) > >
>
>
>
>
>
>
习题 1-9 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为 碱?
HI NH2OH SO42- H2O HCO3- NH4+ HClO4 HS- I- CN- 解:根据酸碱质子论,酸是质子的给予体,碱是质子的接受体。根据该理论,所以:
分子内含有碳碳双键(CC)的烃

分子内含有碳碳双键(C=C )的烃,称为烯烃(有单烯烃,二烯烃,多烯烃),炔烃是分子中含有-C≡C -的烃,二烯烃是含有两个碳碳双键的烃,它们都是不饱和烃。
2.1、烯烃和炴烃的结构2.1.1、双健的结构C=C 键能 610KJ / molC -C 键能 346KJ / mol由键能看出碳碳双键的键能不是碳碳单键的两倍,说明碳碳双键不是由两个碳碳单键构成的。
事实说明碳碳双键是由一个σ键和一个π键构成的。
双键( C=C) = σ键 + π键现代物理方法证明:乙烯分子的所有原子在同一平面上,其结构如下:1、sp 2杂化杂化轨道理论认为,碳原子在形成双键时是以另外一种轨道杂化方式进行的,这种杂化称为sp 2杂化。
H 0.108nm 0.133nm 117°121.7°p sp 2轨道和p Z Z 轨道乙烯分子109.5.碳原子的四个sp 3杂化轨道甲烷分子2、乙烯分子的形成其它烯烃的双键,也都是由一个σ键和一个π键组成的。
π键键能=双键键能-单键键能= 610 kJ/mol – 346 kJ/mol = 264.4kJ/molπ键的特点:①不如σ键牢固(因p 轨道是侧面重叠的);②不能自由旋转(π键没有轨道轴的重叠);③电子云沿键轴上下分布,不集中,易极化,发生反应;④不能独立存在。
2.1.2、叁键的结构最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
现代物理方法证明,乙炔分子是一个线型分子,分子中四个原子排在一条直线上。
杂化轨道理论认为三键碳原子既满足8电子结构结构和碳的四价,又形成直线型分子,故三键碳原子成键时采用了SP 杂化方式 .H H 0.106nm 0.12nm180°σ键乙炔分子1、sp杂化轨道杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),剩下两个未杂化的P 轨道。
两个sp杂化轨道成180分布,两个未杂化的P轨道互相垂直,且都垂直于sp杂化轨道轴所在的直线。
05炔烃
sp的特点
① sp的形状类似于sp3和sp2,呈葫芦形 ②sp的能量介于s和p轨道之间; ③方向性:两个sp杂化轨道在同一条直线上;
④剩余的两个未参与杂化的p轨道,互相垂直,且均与两个sp 杂化轨道所在的直线垂直。
5)电负性: sp3 < sp2 < sp
(5) 总结 •碳碳叁键是由一个 键和两个 键 组成. •键能—乙炔的碳碳叁键的键能是:837 kJ/mol; 乙烯的碳碳双键键能是:611 kJ/mol; 乙烷的碳碳单键键能是:347 kJ/mol. •C-H键长—和p轨道比较, s轨道上的电子云更接近原 子核.一个杂化轨道的s成分越多,则在此杂化轨道上的 电子也越接近原子核.由sp杂化轨道参加组成共价键 , 所以乙炔的 C-H 键的键长 (0.106 nm) 比乙烯 (0.108 nm)和乙烷(0.110nm)的C-H键的键长要短. •碳碳叁键的键长—最短(0.120 nm),这是除了有两个 键,还由于 sp 杂化轨道参与碳碳键的组成.
CH3 Br C=C H H
(3) 和水的加成 CHCH + H2O
H2SO4 HgSO4
HO H2C=CH
RCCH + H2O
记住反应 条件!
H2SO4 HgSO4
H 分子重排 CH3-C=O 乙醛 OH O 分子重排 R-C=CH2 R-C-CH3 烯醇式化合物 酮
为什么发生重排? CH2=C-OH CH3-C=O H H •乙 醛 的 总 键 能 2 7 4 1 kJ/mol 比 乙 烯 醇 的 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定. •由于两者能量差别不大 (63kJ/mol),在酸存在下 ,它们中 间相互变化的活化能很小.
(3) 乙炔的键
炔烃2018

R C CH[Ag(NH3)2]+N)2]+Cl
CH
CuC
CCu
砖红色沉淀
乙炔亚铜
4.4.1.3 炔氢的弱酸性
• 炔烃中的炔氢可以和强碱反应,说明它有弱酸性:
酸性:
pKa: 50
只有乙炔
44
25
可以和Na
反应!
碱性:
原因解释:
乙烷 乙烯 乙炔 水
H2C CH CH CH2
1,3-丁二烯
单双键交替出现称为共轭二烯烃。
3、隔离二烯烃(isolated diene)
H2C CH CH2 CH CH2
二烯烃的系统命名法
• 1.选主链
• 选含双键个数最多的最长碳链为主链,叫“X二烯”
在此烯烃中,最长碳链有5个碳,但 因选主链要求双键个数最多,所以 只能含两个双键的4个碳的碳链为主 链。 1
CH3O- +
CH3OH
4.4.3 氧化反应 • 乙炔通入高锰酸钾溶液中,即可被氧化成CO2和H2O,
同时KMnO4溶液褪色。因反应现象非常明显,常用于 炔烃的定性鉴别。
• 根据炔烃的氧化产物,可以方便地推断出炔烃的结构。
炔烃结构的推测
• 因炔烃叁键碳上只能连有一个烃基,所炔烃结构的
推测比烯烃更方便更容易。炔烃氧化后的产物只有
• 在碱的存在下,炔烃可与醇发生加成反应,得到 产物甲基乙烯基醚。此反应是亲核加成反应。
KOH HC CH + CH3OH 加热加压 CH2 CH OCH3
• 炔烃在碱性条件下与醇加成该体系中无H+,不能 进行亲电加成,而是按以下亲核加成机理完成。
CH3OH + KOH
CH3O-K+ + H2O
甲烷、乙烯、乙炔空间构型PPT

三、乙炔
用左键进行旋转 用右键进行缩放 用双键进行位移 空格键进行重置
分子式:C2H2 C≡C跟C—H键间的夹角:180°
叁键键能:812kJ/mol
注:叁键的的键能是812kJ/mol,比三个单键的键能之和要小得多。
乙炔分子的空间构型是一直线型。
返回
中央电教馆资源中心制作
中央电教馆资源中心制作200311甲烷乙炔乙烯用左键进行旋转用右键进行缩放用双键进行位移空格键进行重置返回用左键进行旋转用右键进行缩放用双键进行位移空格键进行重置返回用左键进行旋转用右键进行缩放用双键进行位移空格键进行重置返回
甲烷、乙烯、乙炔空间构型
甲烷
乙烯
乙炔
一、甲烷
用左键进行旋转 用右键进行缩放 用:109°28′ C—H键的键能:413kJ/mol 甲烷分子为正四面体型结构
返回
二、乙烯
用左键进行旋转 用右键进行缩放 用双键进行位移 空格键进行重置
分子式:C2H4 键角:120°
双键的键能:615kJ/mol。
注:乙烷分子C—C单键的键能是348kJ/mol。碳碳双键的键能并 非是碳碳单键的键能之和,其中的一个键的键能较小。
2003.11
11. 只向最顶端的人学习,只和最棒的人交往,只做最棒的人做的事。 5. 成功者不是比你聪明,只是在最短的时间采取最大的行动。 17. 我相信我没偷过半小时的懒。 9. 当一个人先从自己的内心开始奋斗,他就是个有价值的人。 8. 温暖是飘飘洒洒的春雨;温暖是写在脸上的笑影;温暖是义无反顾的响应;温暖是一丝不苟的配合。 12. 无论今后的道路多么坎坷,只要抓住今天,迟早会在奋斗中尝到人生的甘甜。抓住人生中的一分一秒,胜过虚度中的一月一年! 9. 成你做了什么,而要问你为别人做了什么。 5、当你感到悲哀痛苦时,最好是去学些什么东西。学习会使你永远立于不败之地。 10. 如果我们做与不做都会有人笑,如果做不好与做得好还会有人笑,那么我们索性就做得更好,来给人笑吧! 8. 别再自己摸索,问路才不会迷路。 16. 我的财富并不是因为我拥有很多,而是我要求的很少。 7. 领导力不是训练人,是选对人。 6. 只要再坚持一下下,我们就能到幸福的彼岸。 15、夫妇一条心,泥土变黄金。 15. 一个人的命运不是自己想改变就能改变了的,至于理想,只不过是职业好坏的代名词罢了 。 1. 最短的距离是从手到嘴,最长的距离是从说到做。 6、时间,是靠自己去挤的。在你这一秒空闲的时候,时间又像脚底抹了油似的溜走了,只有去抓住它,它似乎才会停下脚步这时,你就可以做自己想做的事情。 10. 成功的法则极为简单,但简单并不代表容易。 12. 昨晚多几分钟的准备,今天少几小时的麻烦。 8. 每天只看目标,别老想障碍。 8. 只有不断找寻机会的人才会及时把握机会。
乙炔炔烃
C H + Ca(OH)2 C H
一、乙炔的实验室制法
1、原料: 电石(CaC2 )、水 2、原理: CaC2+2H2O Ca(OH)2+C2H2↑(剧烈)
为得到平稳乙炔气流 常 用饱和 NaCl 溶液代替水 电石与 饱和NaCl溶液 ( 已知 : NaCl 与CaC 2不反 应) 接触能否制出乙炔?
解析:
①是碳碳双键被酸性高锰酸钾溶液氧化为羧基。其产物
中有羧基和溴原子两种官能团;②是卤代烃水解反应,溴原子在题目 所给条件下发生水解,溴原子为羟基所取代,产物中有羟基和碳碳双 键两种官能团;③是卤代烃的消去反应,生成物中只含有碳碳双键一 种官能团;④是不饱和有机化合物与HBr的加成反应,生成物中只含有 “—Br”一种官能团。 答案: C
[变式训练]1.(2009·海南单科)某含苯环的化合物A,其相对分子质量
为104,碳的质量分数为92.3%。
(1)A的分子式为________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为___________,
反应类型是__________________________; (3)已知:
【自我检测】
烯烃与炔烃
(1)分子通式 烯烃:CnH2n(n≥2) 炔烃:CnH2n-2(n≥2)
(2)物理性质
①烯烃、炔烃的沸点随碳原子数的增多而升高。
②液态烯烃、炔烃的密度随碳原子数的增多而增大。
(3)化学性质 ①氧化反应 a.燃烧
b.烯烃、炔烃均能使KMnO4酸性溶液褪色。
②加成反应
丙烯、丙炔与足量Br2反应的化学方程式分别为
104×92.3%÷12=8,含氢原子个数:104-12×8=8,故只能含C、H 两种元素,且分子中有8个H原子,A的分子式为C8H8。(4)A与H2反应后C、H 为原子个数比为: C8H16,为乙基环己烷。 ∶ =1∶2,故最简式为CH2,分子式为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醛乙烯乙烷乙炔的c-c键长
乙醛,化学式为CH3CHO,是一种含有羰基(C=O)的有机化合物。
在其分子中,Carbon-Carbon键长为1.51angstrom。
乙烯,化学式为C2H4,是一种四面体构型的无色气体。
乙烯的分子是由两个碳原子和四个氢原子组成的。
在乙烯分子中,C-C键长为1.33 angstrom。
乙炔,化学式为C2H2,是一种含有碳碳三键的有机物。
在其分子中,C-C键长为1.2 angstrom。
由于碳碳的三键共价存在于分子中,乙炔的角度比较小,只有137.5度。
总的来说,C-C键长的大小主要取决于原子种类、键的杂化、形状和电性等各种因素。
对于同一元素而言,sp2杂化的碳原子和sp杂化的碳原子形成的键的长度相对较短。
对于同一个杂化状态的碳原子而言,键长与其所形成的化合物的分子结构、电性以及相互作用
等方面都有密切的关系。
