第六章 红外吸收光谱法2
第六章 红外吸收光谱分析
active) ;反之则为红外非活性(infrared inactive)。
9
二、 分子振动方程式
10
双原子分子可以看成是谐振子,根据经典力 学(胡克定律),可导出如下公式:
1 v 2 k
k
m1 m2 m1 m2
1303 k
v
1 2 c
-1) ; k为力常 ν 为振动频率(Hz), 用波数表示 (cm v 数,表示每单位位移的弹簧恢复力 (dyncm-1) ; μ 为折合质量(g)。
实验中观察到的C=O伸缩振动频率都在1700cm-1附近。 值得注意的是:在弹簧和小球的体系中,其能量变化是 连续的,而真实分子的振动能量变化是量子化的。
13
三、 分子振动的形式
(一)分子的振动自由度
每个原子在空间的位置必须有三个坐标来确定,则由 N个原子组成的分子就有了3N个坐标,或称为有3N个运
动自由度。分子本身作为一个整体,有三个平动自由度
和三个转动自由度。
14
直线型分子的振动形式:3N - 5 非直线型分子的振动形式:3N -6
15
(二)分子的振动形式
a.直线型分子:3N-5
如CO2
16
b. 非线形分子: 3N – 6
如H2O
17
分子的振动形式:
•化学键两端的原子沿键轴方向作来回周期运动 对称伸缩振动
11
可见,影响基本振动频率 (即基频峰位置 )的直接原因是原 子质量和化学键力常数。
表15-1 某些化学键的力常数
化 学 键 键 长(A) k(N· cm-1)
C-C C=C 1.54 4.5 1.34 9.6
C≡C C-H O-H N-H C=O 1.20 15.6 1.09 5.1 0.96 7.7 1.00 6.4 1.22 12.1
红外光谱的吸收

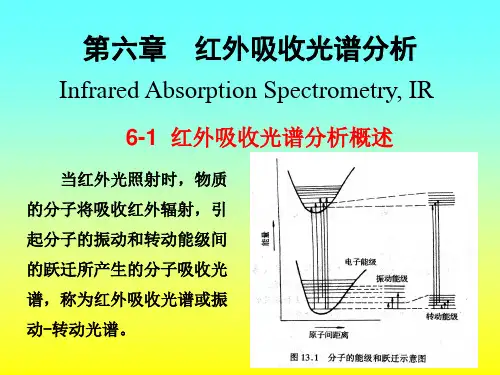
第六章红外吸收光谱法基本要点:1.红外光谱分析基本原理;2.红外光谱与有机化合物结构;3.各类化合物的特征基团频率;4.红外光谱的应用;5.红外光谱仪.学时安排:3学时第一节概述分子的振动能量比转动能量大,当发生振动能级跃迁时,不可避免地伴随有转动能级的跃迁,所以无法测量纯粹的振动光谱,而只能得到分子的振动-转动光谱,这种光谱称为红外吸收光谱。
红外吸收光谱也是一种分子吸收光谱。
当样品受到频率连续变化的红外光照射时,分子吸收了某些频率的辐射,并由其振动或转动运动引起偶极矩的净变化,产生分子振动和转动能级从基态到激发态的跃迁,使相应于这些吸收区域的透射光强度减弱。
记录红外光的百分透射比与波数或波长关系曲线,就得到红外光谱。
一、红外光区的划分红外光谱在可见光区和微波光区之间,波长范围约为0.75~1000µm,根据仪器技术和应用不同,习惯上又将红外光区分为三个区:近红外光区(0.75~ 2.5µm),中红外光区( 2.5~25µm),远红外光区(25~1000µm)。
近红外光区(0.75~ 2.5µm)近红外光区的吸收带主要是由低能电子跃迁、含氢原子团(如O—H、N—H、C—H)伸缩振动的倍频吸收等产生的。
该区的光谱可用来研究稀土和其它过渡金属离子的化合物,并适用于水、醇、某些高分子化合物以及含氢原子团化合物的定量分析。
中红外光区(2.5~25µm)绝大多数有机化合物和无机离子的基频吸收带出现在该光区。
由于基频振动是红外光谱中吸收最强的振动,所以该区最适于进行红外光谱的定性和定量分析。
同时,由于中红外光谱仪最为成熟、简单,而且目前已积累了该区大量的数据资料,因此它是应用极为广泛的光谱区。
通常,中红外光谱法又简称为红外光谱法。
远红外光区(25~1000µm)该区的吸收带主要是由气体分子中的纯转动跃迁、振动-转动跃迁、液体和固体中重原子的伸缩振动、某些变角振动、骨架振动以及晶体中的晶格振动所引起的。
红外吸收光谱法IR2

IR
*红外光是一种电磁波,其波长
在0.78-1000μ m,介于可见光 和微波之间。
-1 数ν ,其单位是cm 。
*在红外光谱中,常用单位是波
*
*当一定频率(能量)的红外光照
射分子时,如果分子中某个基团 的振动频率和外界红外辐射频率 一致时,光的能量通过分子偶极 矩的变化传递给分子,这个基团 就吸收一定频率的红外光,产生 振动跃迁。
饱和-C-H(3000-2800)
三键及累积双键区2500-1900cm-1
C≡C ,C≡N, C=C=C, C=C=O等 2240-2260 (非共轭) 2220-2230 (共轭) 分子中有N、H、C峰强且 锐; 有O则弱,离基团越近则 越弱。
C≡N
RC≡CR’
RC≡CH
2169-2260
RC=CR’则无红外吸收
C=C
指纹区1300-600cm-1
单、双键伸缩振动 (不含氢)
1300-900
C-O(1300-1000) C-(N、F、P),P-O, Si-O
面内弯曲振动
900-650
用于顺反结构,取代类型 的确定
*
*目前有两类红外光谱仪: 色散型 干涉型(傅里叶变换红
外光谱仪)
*
光 源
*
吸
收 池
例题:由元素分析某化合物的分子式为 C4H6O2,测得红外光谱如下图,试推测其结构
100
3095 T%
50 977
1762 4000 3000 2000 1649 l/cm 1372 1217
877
0
1138
1000
1500
*解:
特征区:
由分子式计算不饱和度Ω =1+4-6/2=2
红外吸收光谱s

(2)分析时间短。 通过检索、与标准红外吸收谱图对照, 一般可在10~30min完成分析。若用计算机 检索标准谱图,可在几分钟内完成分析。 (3)所用试样量少。 对固体和液体试祥,进行常量定性分析 只需20mg,半微量分析约5mg,微量分析约 20μg。对气体试样约200mL。
这种能量通常可由照射体系的红外线供给。振动
能级是量子化的,分子振动只能吸收一定的能量 ★吸收的能量将取决于键力常数(k)与两端连接的 原子的质量,即取决于分子内部的特征。这就是 红外光谱可以测定化合物结构的理论依据。
2016/4/14 /96 13
红外吸收光谱的术语:
基频峰:当分子吸收红外辐射后,振动能级从 基态跃迁到第一激发态时所产生的 吸收峰。
IR(远) IR(中)
UV-Vis
2016/4/14
/96
2
分子振动能级差为0.05~1.0eV,比转动 能级差(0.0001 ~ 0.05 eV)大,因此分子 发生振动能级跃迁时,不可避免地伴随转动 能级跃迁,红外光谱实际上是分子的振动转动光谱,即带状光谱。
2016/4/14
/96
3
■红外光谱 当样品受到频率连续变化的红外光照射时, 分子吸收了某些频率的辐射,并由其振动或 转动运动引起偶极矩的净变化,产生分子振 动和转动能级从基态到激发态的跃迁,使相 应于这些吸收区域的透射光强度减弱。记录 红外光的百分透射比(T%)与波数(ζ)或 波长(λ)关系的曲线,就得到红外光谱。
如:醇类的OH基在四氯化碳溶剂中伸缩振 动的强度比在乙醚溶剂中弱得多。而在不同浓 度的四氯化碳溶液中,由于缔合状态不同,强 度也有很大差别。
2016/4/14 /96 29
(3)谱带的强度与振动形式有关。
仪器分析-红外吸收光谱法

第 6 章红外吸收光谱法6.1 内容提要6.1.1 基本概念红外吸收光谱——当用红外光照射物质时,物质分子的偶极矩发生变化而吸收红外光光能,有振动能级基态跃迁到激发态(同时伴随着转动能级跃迁),产生的透射率随着波长而变化的曲线。
红外吸收光谱法——利用红外分光光度计测量物质对红外光的吸收及所产生的红外光谱对物质的组成和结构进行分析测定的方法,称为红外吸收光谱法。
振动跃迁——分子中原子的位置发生相对运动的现象叫做分子振动。
不对称分子振动会引起分子偶极矩的变化,形成量子化的振动能级。
分子吸收红外光从振动能级基态到激发态的变化叫做振动跃迁。
转动跃迁——不对称的极性分子围绕其质量中心转动时,引起周期性的偶极矩变化,形成量子化的转动能级。
分子吸收辐射能(远红外光)从转动能级基态到激发态的变化叫做转动跃迁。
伸缩振动——原子沿化学键的轴线方向的伸展和收缩的振动。
弯曲振动——原子沿化学键轴线的垂直方向的振动,又称变形振动,这是键长不变,键角发生变化的振动。
红外活性振动——凡能产生红外吸收的振动,称为红外活性振动,不能产生红外吸收的振动则称为红外非活性振动。
诱导效应——当基团旁边连有电负性不同的原子或基团时,通过静电诱导作用会引起分子中电子云密度变化,从而引起键的力常熟的变化,使基团频率产生位移的现象。
共轭效应——分子中形成大键使共轭体系中的电子云密度平均化,双键力常数减小,使基团的吸收频率向低波数方向移动的现象。
氢键效应——氢键使参与形成氢键的原化学键力常数降低,吸收频率将向低波数方向移动的现象。
溶剂效应——由于溶剂(极性)影响,使得吸收频率产生位移现象。
基团频率——通常将基团由振动基态跃迁到第一振动激发态所产生的红外吸收频率称为基团频率,光谱上出现的相应的吸收峰称为基频吸收峰,简称基频峰。
振动偶合一一两个相邻基团的振动之间的相互作用称为振动偶合。
基团频率区一一红外吸收光谱中能反映和表征官能团(基团)存在的区域。
第六章 红外吸收光谱

二、分子振动方程式
h E h 2 k
k 1307 M
M 1M 2 M M1 M 2
沿轴振动,只改变键长,不改变键角 1 1 k
2c
K化学键的力常数,与键能和键长有关 M为双原子的折合质量 影响振动频率的因素:键两端原子的折合质量、键的力常数,即取 决于分子的结构特征。
包含C—X(X:O,H,N)单键的伸缩振动及各种面内弯曲振动
特点:吸收峰密集、难辨认→指纹
2、四分区(4000 670 cm-1)
(1)40002500 cm-1X—H伸缩振动区(X:O,N,C,S) (2)25001900 cm-1三键,累积双键伸缩振动区 (3)19001200 cm-1双键伸缩振动区 (4)1200670 cm-1X—Y伸缩,X—H变形振动区
醚:C-O-C伸缩振动位于 1250~1050 cm-1 ,确定醚类存在的唯一谱带
常见基团的红外吸收带
=C-H O-H
CC
C-H
C=C
C=O C-C,C-N,C-O C-X
O-H(氢键)
S-H
N-H
P-H CN
N-O N-N C-F C=N
C-H,N-H,O-H 3500 3000 2500 2000 1500 1000
§6.2 红外光谱分析基本原理
一、红外吸收光谱产生的条件
1、辐射应具有能满足物质产生振动跃迁所需的能量 振= 红外光 2、分子要有偶极距
红外吸收是由于分子振动引起的偶极距和红外光束的振动相互作用产生的
对称分子:没有偶极矩,辐射不能引起共振,无红外活性 。 如:N2、O2、Cl2 等 非对称分子:有偶极矩,红外活性。
红外吸收光谱法
C CH3 O
CH3
1686
H3C
CH3
C CH3
O
CH3
1693
α,β不饱和酮
23
(6)氢键效应
由于氢键改变了原来化学键的力常数,对峰位,峰强产
生极明显影响。移向低波数,增加,并变宽。 移向高波
数。
R
O
H NH R
游离
C=O
1690
HN H O
氢键 1650
N-H
3500
3400
N-H
1650-1620
T(%)
2)红外光谱的表示方法:
红外光谱以T~ (μm) 或 T~波数1/λ ( cm-1 )来表示,
苯酚的红外光谱。
可以用峰数,峰位,峰形,峰强来描述。
3
3) 红外光区划分
红外光谱 (0.75~1000m)
近红外(泛频) (0.75~2.5 m)
中红外(振动区) (2.5~25 m)
远红外(转动区) (25-1000 m)
1576cm-1 1611cm-1
CH2 CH2
CH2
1781cm-1 1678cm-1 1657cm-1
1644cm -1
CH2 1651cm-1
22
(5)位阻应效
共轭效应会使基团吸收频率移动。若分子中存在空间 阻碍,使共轭受到限制,则基团吸收接近正常值。
C CH3 O
υc=o/cm-1 1663
1000~800 (面外摇摆)
(1) = CH >3000 cm-1为不饱和碳上质子振动吸收,是与饱 和碳上质子的重要区别。
(2) C=C的 位置及强度 与烯碳的取代情况及分子对称性 密切相关。
末端烯烃 C=C吸收最强,双键移向碳链中心时结构对称 性增强, C=C带减弱。顺式较反式强。
红外吸收光谱分析法
红外吸收光谱分析法
一、红外吸收光谱分析法概述
红外吸收光谱分析法是一种利用物质的红外光吸收能力来探测它们的物质组成的技术。
它特别适用于有机化合物和无机化合物的光谱分析。
通过分析红外吸收光谱,可以检测物质中的有机键、C-H键、C-O键或N-H 键的存在和位置,从而鉴定出物质的化学结构和性质。
红外光吸收法的原理是,物质中的分子、晶体或其他结构会在不同的波长处吸收光,产生光谱,这些吸收光谱是物质的独特特征,反映出物质的特性。
根据这种特性,分析用不同波长的光照射样品,并从所得到的光谱中提取出电子激发、分子振动等信息,从而得到物质的结构和性质。
二、红外吸收光谱分析法基本原理
红外吸收光谱分析法的原理是,当物质受到红外幅射的照射时,它的分子会产生振动和旋转,这些振动和旋转的能量会转化为更高能量的电子跃迁。
这些电子跃迁会引起物质材料吸收一些具有特定波长的红外光,从而产生在不同波长的吸收光谱,通过分析这些吸收光谱,就可以求取物质分子的结构和性质。
红外光谱分析 红外吸收光谱法
υ=
1
2
(1)
1
105 N
= 2c = 2c
Cm-1 (2)
K为键力常数,其含义是两个原子由平衡位置伸长0.1nm(lA0) 后的回复力,单位是 dyn/cm。
μ’ 为折合质量。 μ’=m1m2/(m1+m2) (m为原子质量)
原子质量用相对原子量代替:
m1=M1/N, m2=M2/N 。
举例:
例:由元素分析某化合物的分子式为 C其4H结6构O2。,测得红外光谱如图,试推测
解: 由分子式计算不饱和度U = 4-6/2+1= 2
特征区:3 070cm-1有弱的不饱和C—H伸缩振动吸收, 与1 650cm-1的vc=c 谱带对应表明有烯键存在,谱带较 弱,是被极化了的烯键。
1 76பைடு நூலகம்cm-1强吸收谱带表明有羰基存在,结合最强吸收 谱带1 230cm-1和1 140cm-1的C-O-C吸收应为酯基。
跃迁的几率与振动方式有关: 基频(V0→V1)跃迁几率大,所以吸收较强; 倍频(V0→V2)虽然偶极矩变化大,但跃率几率很低, 使峰强反而很弱。
3、振动的量子化处理
根据量子力学,其分子的振动能 E=(υ+1/2)h v振
在光谱学中,体系从能量E变到能量E1',要遵循 一定的规则,即选择定则,谐振子振动能级的选择定则 △υ=±1。由选择定则可知,振动能级跃迁只能发生在 相邻的能级间 。
2.基本概念
a..偶极矩:当化学键两端的电子电负性不同时,电中性的 分子便产生负电中心的分离,成为极性分子,极性大小用 偶极矩μ衡量,μ=r×q,即正、负电荷中心间的距离r和 电荷中心所带电量q的乘积。
b.基频:常温下分子处于最低振动能级,此时叫基态,V=0。 从基态V0跃迁到第一激发态V=1,V0V1产生的吸收带
2红外光谱
C-H (2000-1667cm-1)
-(CH2)n- (900-600cm-1)
一、红外光的区划
红外线:波长在0.76~500μm (1000μm) 范围内的电磁波
近红外区:0.76~2.5μm 主要用于研究O-H、N-H、C-H键的倍频吸收或组
频吸收,此区域吸收峰强度较弱。
中红外区:2.5~25μm (400-5000cm-1) 振动、伴随转动光谱主要研究
基本形式 伸缩振动:原子沿键轴方向伸缩,键长变化但键角不变的振动。 变形振动:基团键角发生周期性变化,但键长不变的振动。又称 弯曲振动或变 角振动。 下图给出了各种可能的振动形式(以甲基和亚甲基为例)。
HH C
对称伸缩振动 s
symmetric stretching
HH C
面内弯曲振动或剪切振动 s
红外吸收强度
红外吸收强度由振动时偶极矩变化的大小决定。 分子中含有杂原子时,其红外谱峰一般都较强。
如C=C,C-C因对称度高,其振动峰强度小;而C=X,C-X,因对
称性低,其振动峰强度就大。峰强度可用很强(vs)、强(s)、 中(m)、弱(w)、很弱(vw)等来表示。
五 、红外谱图解析
红外吸收波段
面内弯曲振动 ✓ 特点:吸收峰密集、难辨认→指纹 ✓ 注:相关峰常出现在指纹区
• 经典力学导出的波数计算式为近似式。因 为振动能量变化是量子化的,分子中各基 团之间、化学键之间会相互影响,即分子 振 动的波数与分子结构(内因)和所处的化 学环境(外因)有关。
六、影响吸收峰位的因素
1.内部因素:化学键的振动频率不仅与其性质有关, 还受分子的内部结构和外部因素影响。相同基团的特 征吸收并不总在一个固定频率上。 (1)诱导效应(吸电效应): 使振动频率移向高波数区
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸的C=O 羧酸的
1820~1750 cm-1 , 氢键,二分子缔合体;
10:14:23
4. X—Y,X—H 变形振动区 < 1650 cm-1 ,
指纹区(1350 ∼ 650 cm-1 ) ,较复杂。 较复杂。 指纹区 较复杂 C-H,N-H的变形振动; , 的变形振动; 的变形振动 C-O,C-X的伸缩振动; , 的伸缩振动; 的伸缩振动 C-C骨架振动等。精细结构的区分。 骨架振动等。精细结构的区分。 骨架振动等 顺、反结构区分; 反结构区分;
10:14:23
苯衍生物的C=C 苯衍生物的
苯衍生物在 1650 ∼ 2000 cm-1 出现 C-H和C=C键的面内 和 键的面内 变形振动的泛频吸收(强度弱),可用来判断取代基位置。 ),可用来判断取代基位置 变形振动的泛频吸收(强度弱),可用来判断取代基位置。
2000 1600
10:14:23
苯环上的C—H =C—H ≡ C—H 3030 cm-1 3010 ∼ 2260 cm-1 3300 cm-1
3000 cm-1 以上
10:14:23
2. 叁键(C ≡C)伸缩振动区 叁键( )
(2500 ∼ 1900 cm-1 )
在该区域出现的峰较少; 在该区域出现的峰较少; (1)RC ≡ CH ) (2100 ∼ 2140 cm-1 ) RC ≡ CR’ (2190 ∼ 2260 cm-1 ) R=R’ 时,无红外活性 (2)RC ≡N (2100 ∼ 2140 cm-1 ) ) 非共轭 2240 ∼ 2260 cm-1 共轭 2220 ∼ 2230 cm-1 仅含C、 、 时 峰较强、尖锐; 仅含 、H、N时:峰较强、尖锐; 原子存在时; 越靠近 越靠近C 有O原子存在时;O越靠近 ≡ N,峰越弱; 原子存在时 ,峰越弱;
h ∆E = hν = 2π 1
k
µ
1 k k ν= = = 1307 λ 2πc µ µ
K化学键的力常数,与键能和键长有关, 化学键的力常数,与键能和键长有关, 化学键的力常数
µ为双原子的折合质量 µ =m1m2/(m1+m2) 为双原子的折合质量 (
发生振动能级跃迁需要能量的大小取决于键两端原子的 折合质量和键的力常数,即取决于分子的结构特征。 折合质量和键的力常数,即取决于分子的结构特征。
满足两个条件: 满足两个条件: (1)辐射应具有能满足物质产生振动跃迁所需的能量; (2)辐射与物质间有相互偶合作用。 对称分子:没有偶极矩,辐 对称分子 射不能引起共振,无红外活性。 如:N2、O2、Cl2 等。 非对称分子:有偶极矩,红 非对称分子 外活性。 偶极子在交变电场中的作用示 意图
10:14:23
10:14:23
第六章 红外吸收光谱 分析法
infrared absorption spectroscopy,IR
第二节 红外光谱与分子结构
infrared spectroscopy and molecular structure
一、红外光谱的基团频率 group frequency in IR 二、分子结构与吸收峰 molecular structure and absorption peaks 三、影响峰位移的因素 factors influenced peak shift 四、不饱和度 degree of unsaturation
10:14:23
某些键的伸缩力常数(毫达因/埃 表 某些键的伸缩力常数(毫达因 埃)
键类型 力常数 峰位
—C≡C — > —C =C — > —C — C — ≡ 15 ∼ 17 9.5 ∼ 9.9 4.5 ∼ 5.6 4.5µm 6.0 µm 7.0 µm µ
化学键键强越强(即键的力常数 越大 越大) 化学键键强越强(即键的力常数K越大)原子折合质量 越小,化学键的振动频率越大,吸收峰将出现在高波数区。 越小,化学键的振动频率越大,吸收峰将出现在高波数区。
10:14:23
不对称 υas(CH3) 2960㎝ 2960㎝-1
不对称δas(CH3)1460㎝-1 对称δ )1460㎝
2.峰位、峰数与峰强 峰位、
(1)峰位 ) 化学键的力常数K越大,原子折合质量越小, 键的振动频率越大,吸收峰将出现在高波数区(短波长区); 反之,出现在低波数区(高波长区)。 例1 水分子 非对称分子) (非对称分子)
10:14:23
三、分子中基团的基本振动形式
basic vibration of the group in molecular
1.两类基本振动形式
伸缩振动 亚甲基: 亚甲基:
(动画) 动画)
变形振动 亚甲基
10:14:23
甲基的振动形式
伸缩振动 甲基: 甲基: 对称 υs(CH3) 2870 ㎝-1 变形振动 甲基 对称δs(CH3)1380㎝-1 对称δ )1380㎝
10:14:23
例题: 由表中查知C=C键的 键的K=9.5 ∼ 9.9 ,令其为 例题 由表中查知 键的 令其为 9.6, 计算波数值。 计算波数值。
1 k k 9.6 v= = =1307 =1307 =1650cm−1 λ 2πc µ µ 12 / 2
1
正己烯中C=C键伸缩振动频率实测值为1652 cm-1
一、概述 概述 introduction 二、红外吸收光谱产生的 条件 Infrared infrared absorption spec- condition ofspectroscopy absorption troscopy,IR 三、分子中基团的基本振 动形式 第一节 basic vibration of the group 红外光谱分析基本原理 in molecular 四、红外吸收峰强度 principle of IR intensity of infrared absorption bend
10:14:23
1715 cm-1 1735 cm-1 1680 cm-1
酮 酯 酰胺
红外光谱信息区
常见的有机化合物基团频率出现的范围: 常见的有机化合物基团频率出现的范围:4000 ∼ 670 cm-1 依据基团的振动形式,分为四个区: 依据基团的振动形式,分为四个区: (1)4000 ∼ 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) 伸缩振动区( 伸缩振动区 , , , ) (2)2500 ∼ 1900 cm-1 三键,累积双键伸缩振动区 三键, (3)1900 ∼ 1200 cm-1 双键伸缩振动区 (4)1200 ∼ 670 cm-1 X—Y伸缩, 伸缩, 伸缩 X—H变形振动区 变形振动区
(3)C=O (1850 ∼ 1600 cm-1 ) ) 碳氧双键的特征峰,强度大,峰尖锐。 碳氧双键的特征峰,强度大,峰尖锐。
饱和醛(酮 不饱和向低波移动; 饱和醛 酮)1740-1720 cm-1 ;强、尖;不饱和向低波移动; 醛,酮的区分? 酮的区分?
10:14:23
酸酐的C=O 酸酐的
双吸收峰:1820~1750 cm-1 ,两个羰基振动偶合裂分; 线性酸酐:两吸收峰高度接近,高波数峰稍强; 环形结构:低波数峰强;
第六章 红外吸收光谱 分析法
10:14:23
一、概述
introduction
分子中基团的振动和转动能级跃迁产生:振-转光谱 分子中基团的振动和转动能级跃迁产生: 辐射→分子振动能级跃迁→红外光谱→官能团→分子结构 近红外区 中红外区 远红外区
10:14:23
10:14:23
红外光谱与有机化合物结构
(动画) 动画)
分子振动方程式
双原子分子的简谐振动及其频率
化学键的振动类似于连接两个小球的弹簧
分子的振动能级(量子化): 分子的振动能级(量子化): E振=(V+1/2)hν ( V :化学键的 振动频率; 振动频率;
ν:振动量子数。 振动量子数。
10:14:23
任意两个相邻的能级间的能量差为: 任意两个相邻的能级间的能量差为:
10:14:23
(2)饱和碳原子上的—C—H
—CH3 —CH2— —C—H 2960 cm-1 2870 cm-1 2850 cm-1 2890 cm-1 反对称伸缩振动 对称伸缩振动
3000 cm-1 以下
2930 cm-1 反对称伸缩振动 对称伸缩振动 弱吸收
(3)不饱和碳原子上的 )不饱和碳原子上的=C—H(≡ C—H ) (光谱的特征性
group frequency in IR
与一定结构单元相联系的、 与一定结构单元相联系的、在一定范围内出现的化学键 振动频率——基团特征频率(特征峰); 基团特征频率( 振动频率 基团特征频率 特征峰) 特征峰; 例: 2800 ∼ 3000 cm-1 —CH3 特征峰; 1600 ∼ 1850 cm1 —C=O 特征峰; 特征峰; 基团所处化学环境不同,特征峰出现位置变化: 基团所处化学环境不同,特征峰出现位置变化: —CH2—CO—CH2— —CH2—CO—O— —CH2—CO—NH—
C2H4O
O
H
1730cm-1
1165cm-1
H H H
C
2720cm-1
C
δ(CH3)1460 cm-1,1375 cm-1。 ν(CH3)2930 cm-1,2850cm-1。
10:14:23
四、红外吸收峰强度
intensity of Infrared absorption bend
问题: 为什么? 问题:C=O 强;C=C 弱;为什么? 吸收峰强度→跃迁几率→ 吸收峰强度→跃迁几率→偶极矩变化 吸收峰强度 ∝ 偶极矩的平方 偶极矩变化——结构对称性; 结构对称性; 偶极矩变化 结构对称性 对称性差→偶极矩变化大→ 对称性差→偶极矩变化大→吸收峰强度大 符号: 强 ; 中 ; 弱 符号:s(强);m(中);w(弱) 红外吸收峰强度比紫外吸收峰小2~ 个数量级 个数量级; 红外吸收峰强度比紫外吸收峰小 ~3个数量级;
