第一章第三节实际金属的晶体结构
合集下载
第一章-金属的晶体结构(共118张PPT)可修改全文

(3) 不需最小整数化; (4) 〔1 1 1〕
B面:
(1) 该面与z轴平行,因此x=1,y=2, z=∞; (2) 1/x=1,1/y=1/2,1/z=0; (3) 最小整数化1/x=2,1/y=1,1/z=0; (4) 〔2 1 0〕
C面:
(1) 该面过原点,必须沿y轴进行移动,因此x= ∞ ,y=-1,z=∞ (2) 1/x=0,1/y=-1,1/z=0; (3) 不需最小整数化;(4) 〔0 1 0〕
晶胞在三维空间的重复构成点阵
〔4〕晶格常数
在晶胞中建立三维坐标体系, 描述出晶胞的形状与大小
晶胞参数- 晶格常数:a、b、c 棱间夹角:α、β、γ
2 晶系与布拉菲点阵
依据点阵参数 的不同特点划分为七种晶系
(1) 三斜晶系
α≠β≠γ≠90° a≠ b≠ c
复杂单胞 底心单斜
(2) 单斜晶系
α=γ=90°≠β a≠ b≠ c
3 原子半径: r 2 a
4 配位数= 12
4
5 致密度= nv/V=(4×3πr3/4)/a3=0.74
γ-Fe(912~1394℃)、Cu、Ni、Al、Ag 等
——塑性较高
面心立方晶胞中原子半径与晶 格常数的关系
a
r 2a 4
(三)密排六方结构〔 h.c.p〕 〔 了解〕
金属:Zn、Mg、Be、α-Ti、α-Co等
具有光泽:吸收了能量从被激发态回到基态时所 产生的幅射;
良好的塑性:在固态金属中,电子云好似是 一种流动的万能胶,把所有的正离子都结合 在一起,所以金属键并不挑选结合对象,也 无方向性。当一块金属的两局部发生相对位 移时,金属正离子始终“浸泡〞在电子云中, 因而仍保持着金属键结合。这样金属便能经 受较大的变形而不断裂。
B面:
(1) 该面与z轴平行,因此x=1,y=2, z=∞; (2) 1/x=1,1/y=1/2,1/z=0; (3) 最小整数化1/x=2,1/y=1,1/z=0; (4) 〔2 1 0〕
C面:
(1) 该面过原点,必须沿y轴进行移动,因此x= ∞ ,y=-1,z=∞ (2) 1/x=0,1/y=-1,1/z=0; (3) 不需最小整数化;(4) 〔0 1 0〕
晶胞在三维空间的重复构成点阵
〔4〕晶格常数
在晶胞中建立三维坐标体系, 描述出晶胞的形状与大小
晶胞参数- 晶格常数:a、b、c 棱间夹角:α、β、γ
2 晶系与布拉菲点阵
依据点阵参数 的不同特点划分为七种晶系
(1) 三斜晶系
α≠β≠γ≠90° a≠ b≠ c
复杂单胞 底心单斜
(2) 单斜晶系
α=γ=90°≠β a≠ b≠ c
3 原子半径: r 2 a
4 配位数= 12
4
5 致密度= nv/V=(4×3πr3/4)/a3=0.74
γ-Fe(912~1394℃)、Cu、Ni、Al、Ag 等
——塑性较高
面心立方晶胞中原子半径与晶 格常数的关系
a
r 2a 4
(三)密排六方结构〔 h.c.p〕 〔 了解〕
金属:Zn、Mg、Be、α-Ti、α-Co等
具有光泽:吸收了能量从被激发态回到基态时所 产生的幅射;
良好的塑性:在固态金属中,电子云好似是 一种流动的万能胶,把所有的正离子都结合 在一起,所以金属键并不挑选结合对象,也 无方向性。当一块金属的两局部发生相对位 移时,金属正离子始终“浸泡〞在电子云中, 因而仍保持着金属键结合。这样金属便能经 受较大的变形而不断裂。
金属学与热处理第一章 金属的晶体结构

金属:Zn、Mg、Be、α -Ti、α -Co等
晶体结构特征:
点阵参数: a1=a2=a3=a,
α 1=α 2=α 3=1200
平面轴X1、X2、X3和Z轴的夹角=90 ——四轴坐标系
O
Z轴的单位长度=c,用a、c两个量来度量
点阵参数:α=β=90º, γ=120º; a1=a2=a3≠c, 理想状态:c/a=1.633
第一章 金属的晶体结构
本章教学目的
建立金属晶体结构的理想模型 揭示金属的实际晶体结构
§1-1 金属
一. 金属的特性和概念
1. 特性
金属通常表现出的特性:良好的导电性、导 热性、塑性、金属光泽、不透明。
2. 概念
(1) 传统意义上的概念。 (2) 严格意义上的概念:具有正的电阻温度系 数的物质,即电阻随温度的升高而增加的物质。
晶向─晶体点阵中,由阵点组成的任一直线,代 表晶体空间内的一个方向,称为晶向。 晶面─晶体点阵中,由阵点所组成的任一平面, 代表晶体的原子平面,称为晶面。
1.晶向指数的标定
晶向指数─用数字符号定量地表示晶向,这种数字符 号称为晶向指数。 以晶胞为基础建立三维坐标体系: z C′ O′ A′ c
γ O β α
晶体有各向异性, 非晶体则各向同性。
各向异性:不同方向上的性能有差异。
3.晶体与非晶体的相互转化性
玻璃
长时间保温
金属 极快速凝固
“晶态玻璃”
“金属玻璃”
非晶新材料的发展:光、电、磁、耐蚀 性、高强度等方面的高性能等。
二.晶体学简介
1.晶体结构模型的建立
(1) 假设:原子为固定不动的刚性小球,每个原子 具有相同的环境。
O′
z B′
C′
晶体结构特征:
点阵参数: a1=a2=a3=a,
α 1=α 2=α 3=1200
平面轴X1、X2、X3和Z轴的夹角=90 ——四轴坐标系
O
Z轴的单位长度=c,用a、c两个量来度量
点阵参数:α=β=90º, γ=120º; a1=a2=a3≠c, 理想状态:c/a=1.633
第一章 金属的晶体结构
本章教学目的
建立金属晶体结构的理想模型 揭示金属的实际晶体结构
§1-1 金属
一. 金属的特性和概念
1. 特性
金属通常表现出的特性:良好的导电性、导 热性、塑性、金属光泽、不透明。
2. 概念
(1) 传统意义上的概念。 (2) 严格意义上的概念:具有正的电阻温度系 数的物质,即电阻随温度的升高而增加的物质。
晶向─晶体点阵中,由阵点组成的任一直线,代 表晶体空间内的一个方向,称为晶向。 晶面─晶体点阵中,由阵点所组成的任一平面, 代表晶体的原子平面,称为晶面。
1.晶向指数的标定
晶向指数─用数字符号定量地表示晶向,这种数字符 号称为晶向指数。 以晶胞为基础建立三维坐标体系: z C′ O′ A′ c
γ O β α
晶体有各向异性, 非晶体则各向同性。
各向异性:不同方向上的性能有差异。
3.晶体与非晶体的相互转化性
玻璃
长时间保温
金属 极快速凝固
“晶态玻璃”
“金属玻璃”
非晶新材料的发展:光、电、磁、耐蚀 性、高强度等方面的高性能等。
二.晶体学简介
1.晶体结构模型的建立
(1) 假设:原子为固定不动的刚性小球,每个原子 具有相同的环境。
O′
z B′
C′
第一章金属的晶体结构

图2-6密排六方晶胞
第三节 晶体学概念
• • • • • • • 1.3.1 晶胞中的原子数 体心立方: 面心立方: 密排六方: 1.3.2 原子半径 1.3.3 配位数和致密度 配位数:指晶体结构中与任一个原子最近邻且等距离的原 子数目。 • 体心立方晶体8个,面心立方12个,密排六方12个,所以 面心立方和密排六方致密度高 • 致密度分别为0.68、0.74、0.74
图2-5
面心立方晶胞
• (3)密排六方晶胞(close packed lattice hexagonal):密排六方晶体的晶胞如图1.6所示。 • 它是由六个呈长方形的侧面和两个呈正六边形的 底面所组成的一个六方柱体。因此,需要用两个 晶格常数表示,一个是正六边形的边长a,另—个 是柱体的高c。在密排六方晶胞的每个角上和上、 下底面的小心都有一个原子,另外在中间还有三 个原子。因此,密排六方晶格的晶胞中所含的原 子数为:6×1/6×2+2×1/2+3=6个。 • 具有密排六方晶体结构的金属有Mg、Zn、Be、 Cd、α-Ti、α-Co等。
A、B组元组成的固溶体也可表示为A(B), 其中A为溶剂, B为 溶质。例如铜锌合金中锌溶入铜中形成的固溶体一般用α表 示, 亦可表示为Cu(Zn)。
• 固溶体特性:1固溶体成分可以在一定范围内变化, 在相图上表现为一个区域。2固溶体必须保持溶剂 组元的点阵类型。3纯金属结构有哪些类型,固溶 体也应有哪些类型,即固溶体本身没有独立的点 阵类型。4组元的原子尺寸不同会引起的点阵畸变, 原子尺寸相差越大,引起的畸变也越大。
• 1.3.4晶体中原子的排列方式(略) • 1.3.5 晶体结构中的间隙 • 三种典型晶体结构的四面体间隙、八面体间 隙(图1-13,1-14,1-15) • 间隙半径与原子半径之比rB/rA=?(见表1-2) • 可见面心立方结构八面体间隙比体心立方结 构四面体间隙还大,因此溶碳量大的分类 • 1.按溶剂分类 • (1)一次固溶体:以纯金属组元作为溶剂的 固溶体称为一次固溶体,也叫边际固溶体。 • (2)二次固溶体:以化合物为溶剂的固溶体 称二次固溶体,或叫中间固溶体。如电子 化合物、间隙相。 • 有的化合物和化合物之间,也可以相互溶 解而组成固溶体,如Fe3C和Mn3C,TiC和 TiN等。
机械工程材料 第1章 金属的晶体结构

常见的化学键
离子键 共价键 分子键 金属键
化学键的特性决定材料的组织结构和性能
第一节 材料的化学键
1.金属键
金属正离子和自由电子之间的相互吸引力而使金属原子结合的方式。
金属特性:导电、导热性,塑性,强度,金属光泽。
金属键模型
正离子与自由电子之间的吸引力
第一节 材料的化学键
2. 结合力和结合能
双原子作用模型
第四节 合金的相结构
(2) 按固溶度 有限固溶体、无限固溶体
(3) 按相对分布 有序固溶体、无序固溶体
无序分布
偏聚分布
短程有序分布
第四节 合金的相结构
2、固溶体的性能
溶入溶质原子形成固溶体而使金属强度、硬度升高而塑性、 韧性下降的现象。——固溶强化 溶质原子含量↑,σb、HB↑,ψ、αk↓ 固溶强化效果:间隙固溶体>置换固溶体。
可影响合金相的类型。
第四节 合金的相结构
1、固溶体——固态下组元间相互溶解而形成的相。 溶剂:原子分数多者,其晶格保持不变的组元。 溶质:原子分数少者。
溶剂
溶质
特点:所形成的固相晶体结构仍然保持溶剂晶格类型
第四节 合金的相结构
固溶体的分类:(1) 按溶质原子在晶格中的位置
置换固溶体 、间隙固溶体
x
第二节 材料晶体结构的概念
4、晶格特征参数
晶格常数:描述晶胞几何形状与大小的参数。如立方晶胞: 三棱边a、b、c; 三棱边夹角α、β、γ
晶胞所占原子数: 指一个晶胞所占的原子总数
配位数: 指晶体结构中与任何一个原子最近领且等距离的原子数目
致密度: 晶胞中原子所占体积与晶胞体积之比
其中配位数和致密度可衡量晶胞中原子排列的紧密程度
金工--3-晶体结构

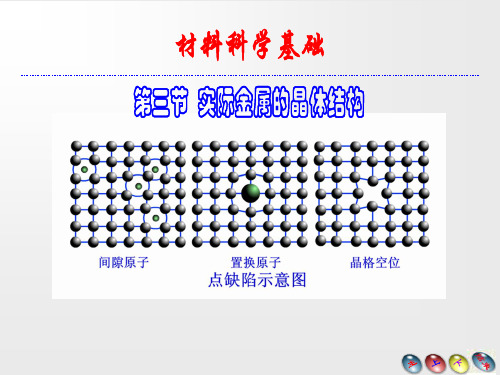
间隙原子
晶格空位
11
(2)线缺陷
在三维空间的两个方向上尺 寸很小的晶体缺陷,如位错。
G H E
F B
位错 — 是指晶格中一列或若 干列原子发生了某种有规律的 错排现象。
A
位错造成金属晶格畸变, 位错造成金属晶格畸变,并 对金属的性能,如强度、塑性、 对金属的性能,如强度、塑性、 疲劳及原子扩散、 疲劳及原子扩散、相变过程等 都将产生重要影响。 都将产生重要影响。
多晶体材料内部以晶界分开的、晶 体学位向相同的晶体称为晶粒。 将任何两个晶体学位向不同的晶粒 隔开的那个内界面称为晶界。
9
由于一般的金属材料是多晶体结构, 由于一般的金属材料是多晶体结构,故 通常测出的性能是各个位向不同的晶粒的 平均性能, 平均性能,其结果使金属材料显示出各向 同性。 同性。
晶粒越多,晶界也越多, 晶粒越多,晶界也越多,则晶粒移动所受 的阻力越大,宏观来看,材料越不容易发生变形, 的阻力越大,宏观来看,材料越不容易发生变形, 即材料的硬度越高,强度越好。 即材料的硬度越高,强度越好。
一、冷却曲线与过冷度
纯金属的结晶是在一定的温度下进行的(恒温),其结晶过程可用冷却曲线 来描述。 【冷却曲线】 冷却曲线】 首先将金属熔化,然后以缓慢的速度冷却,记录温度-时间之间的关系,并 在温度-时间坐标上绘制出来,所得到的图形。
14
1 理论结晶温度
液态金属随着时间的推移,温度不断下降,当冷却到某一温度时,在冷 却曲线上出现水平线段,这个水平线段所对应的温度就是金属的理论结晶温 度(T0)。 (计算出来的)
3
晶面
晶 格
晶 面
晶 向
晶
晶 胞
4
(三)常见的金属晶格类型
金属晶体结构及结晶

★ 亚晶粒是组成晶粒的尺寸很小,位向差也很小(1 ~2)的小 晶块(或称“亚结构”)。亚晶粒之间的交界面称亚晶界 。亚晶界的原子排列也不规则,也产生晶格畸变。
亚晶界示意图
Cu-Ni 合金中的亚结构
金属的晶体结构
①使实际金属的强度远远小于理想金属 ②晶界处位错密度高,使其局部强度 强度 硬度 塑性 韧性 硬度
金属的晶体结构
(二)晶体学基础
把晶体中每个原子抽象成一个点,用直线连接,构成的空
间格架称为晶格。
组成晶格的最小几何组成单元是晶胞。a、b、c是晶格常 数,单位是10-10m(Å); 晶胞各边夹角以a、b及g表示。
Z
b g X ba a源自c Y原子排列模型晶
格
晶
胞
简单立方晶体
金属的晶体结构
(二)晶体学基础
物质由原子组成。原子的结 合方式和排列方式决定了物 质的性能。 原子、离子、分子之间的结 合力称为结合键。它们的具 体组合状态称为结构。 自然界中的固态物质按其原 子(或分子、离子)的聚集 状态可分为晶体和非晶体两 大类。
C60
金属的晶体结构
晶体:原子(原子团或离子)在三维空间按一定规则 周期性重复排列的固体。如固态金属、钻石、冰等。 晶体具有各向异性。 非晶体:原子(原子团或离子)在三维空间中无规则 排列的物质,也称为玻璃态。如松香、玻璃、塑料等。
[111]方向上,弹性模量E=290000Mpa ;[001]方向上,弹性模量E=135000Mpa
金属的晶体结构
(五)单晶体的各向异性 单晶体具有各向异性的特征。但工业上 实际应用的金属材料,因为属于多晶体,一
般不具有各向异性的特征。如工业纯铁在任
何方向上其弹性模量E均为2.1×105MPa。
亚晶界示意图
Cu-Ni 合金中的亚结构
金属的晶体结构
①使实际金属的强度远远小于理想金属 ②晶界处位错密度高,使其局部强度 强度 硬度 塑性 韧性 硬度
金属的晶体结构
(二)晶体学基础
把晶体中每个原子抽象成一个点,用直线连接,构成的空
间格架称为晶格。
组成晶格的最小几何组成单元是晶胞。a、b、c是晶格常 数,单位是10-10m(Å); 晶胞各边夹角以a、b及g表示。
Z
b g X ba a源自c Y原子排列模型晶
格
晶
胞
简单立方晶体
金属的晶体结构
(二)晶体学基础
物质由原子组成。原子的结 合方式和排列方式决定了物 质的性能。 原子、离子、分子之间的结 合力称为结合键。它们的具 体组合状态称为结构。 自然界中的固态物质按其原 子(或分子、离子)的聚集 状态可分为晶体和非晶体两 大类。
C60
金属的晶体结构
晶体:原子(原子团或离子)在三维空间按一定规则 周期性重复排列的固体。如固态金属、钻石、冰等。 晶体具有各向异性。 非晶体:原子(原子团或离子)在三维空间中无规则 排列的物质,也称为玻璃态。如松香、玻璃、塑料等。
[111]方向上,弹性模量E=290000Mpa ;[001]方向上,弹性模量E=135000Mpa
金属的晶体结构
(五)单晶体的各向异性 单晶体具有各向异性的特征。但工业上 实际应用的金属材料,因为属于多晶体,一
般不具有各向异性的特征。如工业纯铁在任
何方向上其弹性模量E均为2.1×105MPa。
1.3.实际金属的晶体缺陷
3.柏氏矢量 (1)柏氏矢量的确定方法 先确定位错线的方向(一般规定位错线垂直纸面时,由纸
面向外为正向),按右手法则做柏氏回路,右手大拇指指位 错线正向,回路方向按右手螺旋方向确定。 从实际晶体中任一原子出发,避开位错附近的严重畸变区 作一闭合回路,回路每一步连接相邻原子。按同样方法在完 整晶体中做同样回路,步数、方向与上述回路一致,这时终 点和起点不重合,由终点到起点引一矢量即为柏氏矢量b。
图 位错的滑移
(a)正刃型位错 (b)负刃型位错 图 刃位错的滑移
当一个刃型位错沿滑移面滑过整个晶体,就会在晶体表面
产生宽度为一个柏氏矢量b的台阶,造成晶体的塑性变形。 在滑移时,刃型位错的移动方向一定是与位错线相垂直, 即与其柏氏矢量相一致。 位错线沿着滑移面移动时,它所扫过的区域是已滑移区, 而位错线未扫过的区域为未滑移区。
1.3.1 点缺陷
图 晶体中的点缺陷(a) 肖脱基空位
空位的两种类型:
(b) 弗兰克尔空位
离位原子迁移到晶体的表面上,这样形成的空位通常称为
肖脱基缺陷;可迁移到晶体点阵的间隙中,这样的空位称弗 兰克尔缺陷。
1.3.1 点缺陷
§1.3.1.2 点缺陷的运动及平衡浓度
1.点缺陷的运动 点缺陷并非固定不动,而是处在不断改变位置的运动过程
对于柏矢量b沿晶向[uvw]的位错
柏矢量的模
柏矢量的模的计算就是矢量模的计算,同第 一章中介绍的晶向长度计算。对于立方晶系:
位错的加法按照矢量加法规则进行。
4.位错密度
晶体中所含位错的多少可用位错密度来表示。位错密度
定义为单位体积晶体中所含位错线的总长度,其表达式为
S (cm / cm 3 ) V
图 刃型位错与螺型位错
《金属学与热处理》-国家级重点教材

一、金属原子的结构特点
金属原子的结构特点是,其最外层的电子数 很,一般为1~2个,最多不超过3个。由于这些外 层电子与原子核的结合力弱,所以很容易脱离原 子核的束缚而变成自由电子,此时的原子即变为 正离子。因此,常将金属元素称为正电性元素。
金属原子的结构特点
过渡族金属元素,如钛、钒、铬、锰、铁、钴、 镍等,它们的原子结构,除具有上述金属原子的特 点外,还有一个特点,即在次外层尚未填满电子的 情况下,最外层就先填充了电子。因此,过渡族金 属的原子,不仅容易丢失最外层电子,而且还容易 丢失次外层1~2个电子,这样就出现过渡族金属化 合价可变的现象。
结合力与结合能
图1-2 双原子作用模型
结合力与结合能
将上述双原子作用模型加以推广,不难理解, 当大量金属原子结合成固体时,为使固态金属具有 最低的能量,以保持其稳定状态,大量原子之间也 必须保持一定的平衡距离,这就是固态金属中的原 子趋于规则固态金属中把某个原子从平衡位置 拿走,就必须对它做功,以克服周围原子对它的作 用力。显然,这个要被拿走的原子周围近邻的原子 数越多,所需要做的功便越大。由此可见,原子周 围最近邻的原子数越多,原子间的结合能(势能) 越低。能量最低的状态是最稳定的状态,而任何系 统都有自发从高能状态向低能状态转化的趋势。因 此,常见金属中的原子总是自发地趋于紧密的排列, 以保持最稳定的状态。
一、晶体的特性
由于晶体中的原子呈一定规则重复排列着, 这就造成晶体在性能上区别于非晶体的一些重要 特点。首先,晶体具有一定的熔点(熔点就是晶 体向非结晶状态的液体转变的临界温度)。在熔 点以上,晶体变为液体,处于非结晶状态;在熔 点以下,液体又变为晶体,处于结晶状态。从晶 体至液体或从液体至晶体的转变是突变的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
面滑移到另一个滑移面。
3 柏氏矢量
柏氏矢量:既可表示位错的性质,也可表示晶格畸变的大小和 方向。 柏氏矢量的确定方法:P24图1-36 ⑴在实际晶体中,从距离位错一定距离的任一原子M出发,
以到相邻原子为一步,沿逆时针方向环绕位错线作一闭合回路,
称之为柏氏回路。 ⑵在完整晶体中以同样方向和步数作回路,但未封闭。 ⑶由完整晶体的回路终点Q到始点M引一矢量b,使该回路 闭合,矢量b即为柏氏矢量。
弗兰克尔缺陷
空位的移动: 处于不断的运动、消失和形成过程中
遇到周围空位 迁移至晶体表面 换位 消失
遇到间隙原子
消失
a
b
c
d
空位的移动
e
f
空位的浓度: 浓度随温度变化而改变 温度↑,浓度↑; 温度↓,浓度↓。 但空位的平衡浓度是很小的(如铜:一般为10-5数量级)。 在空位周围的原子会偏离平衡位臵出现弹性畸变区。 ┕ 晶格畸变
间隙原子引起的 晶格畸变
Hale Waihona Puke 占据原来基体原子平 衡位置的异类原子
3 臵换原子
产生晶格畸变 是一种热平衡缺陷 ┕ 平衡浓度为固溶度或溶解度
(比间隙原子的固溶度要大得多)
三种点缺陷均为热平衡缺
陷,均造成晶格畸变,对 金属的性能产生影响。
小原子置换引起的 晶格畸变
线缺陷
线缺陷:即位错(分为刃型位错和螺旋位错 ) 。它是
E B
位错线
F C
D
τ
位错。图中EF线为已滑
移区与未滑移区的分界 处。
τ
分类:有左螺旋和右螺旋。 根据螺旋面旋转方向,符合右手法则(即以右手拇指代表螺 旋面前进方向,其他四指代表螺旋面的旋转方向)的称为右旋 螺型位错。符合左手法则的称为左旋螺型位错.
D C
τ
A B
τ 右旋螺型位错
左旋螺型位错
螺型位错的重要特征:
指晶体中的原子发生了有规律的错排现象。
特点:原子发生错排的范围只在一维方向上很大,直径 为3~5个原子间距,长数百个原子间距以上的管状原子 畸变区。
1 刃型位错
形成及定义:晶体在大于屈服值的切应力τ 作用下,以ABCD 面为滑移面发生滑移。滑移后产生额外半原子面EFGH,EF是 晶体已滑移部分和未滑移部分的交线,EF线犹如砍入晶体的一 把刀的刀刃,即刃位错(或棱位错)。
少。或多或少都存在差异,存在弹性畸变。
非共格界面:界面两边原子排列差异很大, 弹性畸变大,界面能很高,畸变能高至无法 维持共格关系。 完全共格关系的相界
半共格界面示意图
非共格界面示意图
6 晶界特性
⑴ 晶界有界面能。原因是晶界原子或多或少地偏离平衡位臵。 晶粒越细晶界越多,能量越高,越不稳定。在一定的温度下, 为降低能量、减少晶界长度,晶粒有长大的趋势。 ⑵ 相变时新相晶核往往优先在界面上形成。原因是晶界上空 位、位错等缺陷较多,原子扩散速度较快。
① 螺型位错没有额外半原子面。 ② 位错线是一个具有一定宽度的细长晶格畸变管道,其 中只有切应变,没有正应变。 ③ 位错线EF与晶体的滑移方向相平行。位错线运动的方 向垂直于位错线。
F
位错线运动方向
E
刃型位错与螺型位错的区别:
— 螺型位错没有额外半原子面,而刃型位错有; — 螺型位错只有切应变,没有正应变,而刃型位错均有; —螺型位错的位错线与晶体的滑移方向相平行,而刃型位错 则垂直。 —刃型位错的滑移面是唯一的,而螺型位错可以从一个滑移
点缺陷 线缺陷 面缺陷
间隙原子、空位、臵换原子
位错(刃型、螺旋)
晶体表面、晶界、相界面等
点缺陷
晶体中的各种点缺陷 1—大臵换原子 2—肖脱基空位 3—异类间隙原子 4—复合空位 5—弗兰克尔空位 6—小的臵换原子
1 空位
┕ 是一种热平衡缺陷 形成原因:原子的热运动导致能量起伏,使一些原子脱离 原有位臵迁移到别处,在原位形成空结点。 脱离平衡位臵的原子去处: 移至表面——肖脱基空位 间隙 —— 弗兰克尔空位 其它空位处——使空位变换位臵
位错线上各点的伯氏矢量相同,只是各点的刃型、螺型分 量不同而已。
b刃 τ
B A b C
b混
θ b螺 位错线
(a)混合位错 (b)混合位错分解为刃 位错和螺位错示意图
θ
b C
A处为螺型位错(位错线与b平行)
C处为刃型位错(位错线与b垂直) AC之间为混合位错
A
5 位错的性质
— 已滑移区与未滑移区的边界线就是位错线。 — 位错线不能终止于晶体内部,只能露头于晶体表面 或晶界上,或与其它位错线相连接、或自成封闭线.
空位
肖脱基空位:
如原子在热起伏过程中获得足够能量离开平衡位臵,跳 跃到晶体的表面,在原位臵上留下空位,这种缺陷称为肖脱 基空位。 ┕ 金属中大部分为此空位。
肖脱基空位
弗兰克尔空位: 在晶格内原子热振动时,一些能量足够大的原子离开 平衡位臵后,进入晶格点的间隙位臵,变成间隙原子, 而在原来的位臵上形成一个空位,这种缺陷称为弗兰克 尔空位。
金属强度和位错的关系
晶须中:ρ =10m/cm3 1—理论强度(不含位错) 2—晶须强度(几乎不含位错的
——位错密度很小
1
2 强度
小晶体,变形抗力极高)
3—未强化纯金属强度(或退 火状态) 4 3 ρm 4—合金化、加工硬化或热处 理的合金强度 金属铁须晶(直径1.6μm): 13400MPa, 退火工业纯铁:300MPa,
4 混合位错(实际晶体中常见)
在外力τ作用下,晶体两部分之间发生相对滑移,在 晶体内部已滑移和未滑移部分的交线既不垂直也不平行滑 移方向,而是一条曲线,它是刃型位错与螺旋位错的混合
型,这样的位错称为混合位错。
位错线上任意一点,经矢量分解后,可分解为刃位
错和螺位错分量。晶体中位错线的形状可以是任意的,但
G
D
H
F C
A
E
B
刃型位错示意图
刃型位错分类:
正刃位错:额外半原子面位于晶体的上半部,“┻”
负刃位错:额外半原子面位于晶体的下半部,“┳”
正刃位错
负刃位错
刃型位错的重要特征:
① 刃型位错有一额外半原子面 ② 位错线是一个具有一定宽度 的细长晶格畸变管道,既有切 应变,又有正应变,对于正刃
型位错,滑移面之上晶格受到
原因是:铝的层错能大,不易产生层错。
5 相界
晶界
不同晶体结构的 两相之间的分界 面
相界
金属材料内部的晶粒 (a)固溶处理的1Cr18Ni9Ti不锈钢中同一类的等轴晶粒(600×)
(b)黄铜H62(62%Cu,38%Zn)的两种晶粒(120×)
相界面结构类型: 共格界面、半共格界面、非共格界面。 共格界面: 界面上的原子同时位于两相晶格的结点上,为两种晶格所共有。 完全共格能量最低,畸变最小,但此相界很
点缺陷
缺陷的 类型
其特点:在三维方 向上的尺寸都很小, 缺陷的尺寸处在一、 两个原子大小的级 别,又称零维缺陷。
线缺陷
面缺陷
其特点:仅在二维方向上 的尺寸较大,而另外一维 方向上的尺寸很小,故也 称二维缺陷。
其特点:仅在 一维方向上的 尺寸较大,而 另外二维方向 上的尺寸都很 小,故也称一 维缺陷,通常 是指位错。
α
γ
⑶ 晶界内的吸附现象。 目的是降低晶界能 ┕即杂质原子向晶界的偏聚。 ⑷ 晶界对材料的塑性变形起阻碍作用,晶粒越细,界面积越 大,材料的强度和硬度越高。
┕晶界强化或细晶强化
⑸ 晶界由于有界面能,加之低熔点杂质含量较高,故其熔点 低于晶内; ⑹ 晶界容易被腐蚀和氧化。
小结
1 晶体缺陷的分类:点缺陷、线缺陷、面缺陷
第三节 实际金属的 晶体结构
引言
前面讨论的晶体是所谓的理想晶体,即原子或分子
在空间呈绝对规则的排列。但实际上晶体的某些区域 总是存在原子或分子的不规则排列,这就是晶体结构 缺陷,以下简称晶体缺陷。 晶体缺陷对晶体的性能和物理化学变化(如强度、 塑性、扩散、固态相变等)都有着重大的影响。
晶体结构缺陷的类型
刃型位错柏氏矢量的确定
从柏氏回路可知:刃型位错的柏氏矢量与其位错线相垂直 —刃位错的重要特征
螺旋位错柏氏矢量的确定 位错线 柏氏矢量
从柏氏回路可知:螺型位错的柏氏矢量与其位错线相平行
—螺位错的重要特征
柏氏矢量的特征:
⑴ 可判定位错性质: 位错线⊥柏氏矢量—刃型 位错线∥柏氏矢量—螺旋型 ⑵ 描述了晶格畸变总量的大小b与晶体滑移的方向,即指 出了滑移后晶体上下部相对位移的大小与方向。 ⑶ 一条位错线的柏氏矢量是恒定不变的。 ⑷ 对于一个位错来说,同时包含位错线和柏氏矢量的晶面 是潜在的滑移面。
压应力,滑移面之下受到拉应 力。负刃型位错与此相反。 ③ 位错线与晶体的滑移方向相垂直,位错线运动的方向垂直于 位错线。 注意:额外半原子面不一定是平面,可以是曲面。但是位错线一
定是垂直于滑移方向的,这是刃型位错的特征之一。
2 螺型位错
形成及定义:晶体在外 加切应力 τ 作用下,沿 ABCD 面 滑 移 , 由 于 位 错线EF周围的一组原子 面形成了一个连续的螺 A 旋形坡面,故称为螺型
(1)外部介质的性质
(3)晶体表面的曲率
介质不同,表面能不同
曲率半径越小,表面能越大
(2)裸露晶面的原子密度 密排晶面,表面能小
2 晶界
晶界与界面能:晶界是成分结构相同的同种晶粒间的界面。界面上的 原子处在断键状态,具有超额能量。在界面单位面积上平均的超额能 θ 量叫界面能。
⑴小角度晶界 晶界的结构和性质与相邻晶粒的取向差有 关,当取向差θ小于10o 时,称为小角度 晶界。它由两个晶粒各倾斜θ/2构成的一
金属中的亚晶组织
亚晶界通常由位错构成
亚晶界模型
