第十三章含氮化合物(6学时)
《含氮化合物》课件

硝基化合物具有特征的紫外-可见光谱 和红外光谱,可用于鉴别和检测。
硝基化合物的溶解性
硝基化合物一般难溶于水,但可溶于 有机溶剂。溶解度受温度、压力、溶 剂类型等因素影响。
硝酸盐的物理和化学性质
01
02
03
硝酸盐的稳定性
硝酸盐在常温下稳定,但 在高温或酸性条件下可能 发生分解。
硝酸盐的溶解性
硝酸盐易溶于水,也是植 物生长所需的氮肥来源之 一。
硝基有机化合物
定义
结构特点
分类
性质
硝基有机化合物是一类含硝基 官能团的有机化合物,通常以 C-NO2形式存在。
硝基有机化合物的结构特点是 含有硝基官能团,硝基中的氮 原子与两个氧原子相连,形成 一个稳定的电子结构。
硝基有机化合物可以分为脂肪 族硝基化合物和芳香族硝基化 合物两类,根据硝基连接的碳 原子数,又可以分为一元硝基 化合物、二元硝基化合物和多 元硝基化合物。
氮气的物理和化学性质
物理性质
无色、无味、无毒的气体,标准 状况下密度为1.25g/L,沸点为195.8°C,熔点为-209.8°C。
化学性质
氮气是一种惰性气体,不易与其 他物质发生反应,但在高温、放 电等条件下可以与氧气、氢气等 发生反应。
氮气的制备和用途
制备方法
工业上主要采用分离液态空气法来制备氮气,实验室中可以用金属镁和氮化物 反应制备氮气。
用途
氮气是合成氨、尿素等含氮化合物的重要原料,也是工业上常用的保护气体, 可用于填充灯泡、食品保鲜、医疗麻醉等领域。此外,氮气也是一种无色无味 的惰性气体,可用于制作氮肥、硝酸、炸药等。
02 氨和铵盐
氨的物理和化学性质
物理性质
氨是一种无色、易挥发、有刺激性气 味的气体,沸点为-33.5℃,极易溶 于水,形成氨水。
有机化学 含氮有机化合物
第十三章含氮有机化合物名称结构式名称结构式氨NH3胺RNH2,ArNH2R2NH (Ar)2NHR3N (Ar)3N氢氧化铵NH4OH季铵碱R4N+OH-铵盐NH4Cl季铵盐R4N+Cl-硝酸HO-NO2硝基化合物R-NO2 Ar-NO2亚硝酸HO-NO亚硝基化合物R-NO Ar-NO13.1硝基化合物由硝酸和亚硝酸可以导出四类含氮的有机物,即硝酸酯、亚硝酸酯、硝基化合物和亚硝基化合物H O NO2 R O NO2R NO2硝酸硝酸酯(补充)硝基化合物H O N O R O N O R N O亚硝酸亚硝酸酯亚硝基化合物一、 硝基化合物的命名和结构硝酸酯和亚硝酸酯的命名与有机酸酯的命名相同,如CH 3ONO 2CH 2CH 2ONO硝酸甲酯 亚硝酸乙酯(补充)2 硝基和亚硝基化合物中将硝基和亚硝基看作为取代基CH 3NO 2NO 2CH 3NO硝基甲烷 邻硝基甲苯 对亚硝基甲苯CH 3硝酸酯和芳香多硝基化合物都有爆炸性,常被用做炸药,如CH2ONO2CHONO2CH2ONO2O2NCH3NO2NO2三硝基甘油酯2,4,6-三硝基甲苯(TNT)硝基化合物的结构,可表示为由一个N=O和一个N→O配位键组成。
OR NO电子衍射法证明,硝基中两个氮氧键长是完全相同的,CH3NO2 分子中的两个N—O键的键长均为0.122nm。
原因:硝基中氮原子以sp2杂化,三个原子形成共平面的σ键。
二、硝基化合物的性质1、物理性质颜色多为淡黄色沸点比相应的卤代烃高, 常温下为高沸点的液体或结晶固体溶解性不溶于水,易溶于有机溶剂,液体的硝基化合物是有机化合物的良好的溶剂但是因为硝基化合物有毒性,可透过皮肤被机体吸收,生产上很少采用它,例如硝基苯有剧毒;多硝基化合物有爆炸性, 如2,4,6-三硝基甲苯(TNT)为烈性炸药2、脂肪族硝基化合物的化学性质(1)脂肪族硝基化合物的酸性硝基为吸电子基团,脂肪族硝基化合物中的-氢原子很活泼,显弱酸性,可与碱作用生成盐从而溶于碱中O R CH2NOOH R CH NORCH NO NaOH [ RCHNO ] - +H O2 2 + 2 Na + 2(2)与羰基化合物的缩合反应:有α-氢的硝基化合物,在碱性条件下可与醛或酮发生缩合反应,类似于羟醛缩合。
第十三章 有机含氮化合物

弱酸性,能溶于碱,仲胺生成的苯磺酰胺,氮上无氢原子
,不显酸性,不能溶于碱。苯磺酰胺都具有一定的熔点。 。
4. 与亚硝酸反应
伯胺与亚硝酸反应
R NH2 + HO N O
NH2 + HNO2
HCl
0~ 5℃
R OH + N2 + H2O
N2 Cl + H2O
+
室温
重氮化反应
OH + N2 + HCl
伯胺与亚硝酸反应,产物为醇或酚,并能放出氮气,可鉴别 伯胺。
4. 生源胺
HO HO
担负神经冲动传导作用的化学介质
CH CH2 NH2 OH
HO HO H CH CH2 N CH2 OH
去甲肾上腺素
肾上腺素
三、重氮化合物和偶氮化合物
(一)取代反应(放氮反应)
N2 SO4H H2SO4+H2O
+
OH + H2SO4 + N2
C C C
C C C
·
N
N · ·
苯重氮正离子的结构
莨菪碱等。
代后的产物。
O C NH2
苯甲酰胺
O CH3 C NH
乙酰苯胺
二、酰胺的化学性质 (一)酸碱性
氮上的未共用 电子对与羰基的 π键形成共轭体系
O .. H R C N H
由于酰胺分子中氨基与羰基直接相连,氮上的未共用
电子对与羰基的 π键形成共轭体系,电子云向氧原子转移, 降低了氮原子的电子云密度,使结合质子的能力减弱,碱 性减弱,接近于中性。
第十三章
教学目标
有机含氮化合物
1· 了解硝基化合物、胺、重氮化合物的物理性质
华中科技有机化学第十三章 含氮化合物
重氮盐在铜作用下,还可与NaNO2,Na2SO3置换,得到硝基芳烃 和芳烃磺酸盐。
重氮盐与氢的置换实际上是去胺化反应,它在合成上极为重要。 例如,由苯合成1,3,5-三溴苯,直接溴化是得不到的。但由苯胺进 行溴化得2,4,6-三溴苯胺,再进行去胺化,则很容易得到:
(2) 重氮偶合反应 芳香族重氮盐是弱的亲核试剂,它们可以和高度活化的芳香族化合 物发生偶合得到偶氮化合物。这种反应称为重氮偶合反应,最常用于合 成偶氮染料。高度活化的芳香可得很好产率的对氨基苯磺酸。
(4) 酰化反应。N,N-二取代苯胺与乙酰苯胺不能进行N-酰化,可用温和 条件进行C-酰化。而且,N,N-二烷基苯胺可用二甲基甲酰胺与POCl3进 行酰化,在苯环上引入醛基。但此反应在一般苯环上是不进行的,因为 它需强活化的苯环。此反应叫Vilsmeier反应:
该反应历程实际是甲醛与二甲胺先形成亚铵离子,然后亚铵离 子加到苯乙酮烯醇式的双键上,最后得到-氨基酮,又称Mannich 碱,是很有用的合成中间体,它经加热蒸馏可得乙烯基酮与2o胺:
若将酮与Mannich碱共热,再经酸水解可得酮与,-不饱和酮的迈 克尔加成产物。
11.5 芳香族重氮盐、重氮甲烷与叠氮化合物的反应 1. 芳香族重氮盐的反应 芳香族重氮盐是由1o芳香胺在强酸溶液中,与NaNO2(立即产生 HNO2)在5℃以下低温反应制得。由于重氮基与芳环发生共轭,所以 它比脂肪族重氮盐稳定。重氮盐溶于水,并完全电离。干的重氮盐极 易爆炸,但水溶液无此危险,所以在水溶液中制得的重氮盐就不再分 离,直接用于下步反应。
2o胺与H2O2反应形成羟胺,有些产率较高,可在合成中应用。如
3o胺与H2O2或过乙酸反应, 可以得到高产率的N-氧化物。
6. 胺的消除反应 季铵碱与3o胺的N-氧化物可以在100oC以上温度发生消除反应。 季铵碱的消除反应又称为霍夫曼(Hofmann)消除反应, 它属E2反应, 但消 除取向不同于卤代烷的E2反应, 即所得主要产物具有最少取代的烯烃。如
有机化学 含氮有机化合物
第十三章含氮有机化合物
⑵芳环上的亲核取代反应
(i)芳环的特征反应是亲电取代反应
邻位或对位被硝基取代的芳香卤代物,由于强吸电子基硝基的影响,使苯环上的电子云密度降低,不利于亲电试剂的进攻,容易发生亲核取代反应。
Cl
NO 2
O 2N
NO 2
2NH 3
NH 2
O 2N
NO 2
NO 2
NH 4Cl
氮原子与脂肪烃基相连的是脂肪胺(R-NH 2),与芳香环直接相连的为芳香胺(Ar-NH 2)
按照分子中所含氨基的数目,有一元、二元或多元胺
注意“氨”、“胺”、“铵”字的用法,在表示基时,如氨基、亚氨基,用“氨”;表示NH 3的烃基衍生物时,用“胺”;而季铵类化合物则用“铵”。
-NH 2(氨基)、-NH-(亚氨基)
(CH3CH2)2NH CH3CH2NH CH3
N CH3N
CH3
CH3
①气相:(CH 3)3N
(CH 3)2NH CH 3NH 2NH 3
>>>(CH 3)3N (CH 3)2NH CH 3NH 2NH 3
>>>②水溶液相:
3°2°
1°3°
2°1°原因:CH 3的+I 效应使N 上电子云密度增加,与H +
的结合力增加,碱性增强。
K b ×10
5
59.542.5 6.73 1.8
(教材错误)。
第十三章 含氮有机化合物ppt课件

3.了解 重要的胺、酰胺及其衍生物。
4.能力要求 用化学方法鉴别伯胺、仲胺和叔胺。
5.素质要求 理解胺、酰胺类化合物在医学上的应用。
第十三章 含氮有机化合物
第十三章 含氮有机化合物
1
2 3
第一节 胺 第二节 酰胺
基础与临床
学习要点
4
第一节 胺
一、胺的概念、分类与命名
二、胺的结构 三、胺的化学性质 四、重要的胺
第十三章 含氮有机化合物
第一节 胺
第一节 胺
3.叔胺与亚硝酸的反应 脂肪叔胺与亚硝酸作用生成易溶 于水的亚硝酸盐。该盐不稳定,遇强碱则重新析出叔胺。
R N + H N O 3 2 R N H N O 3 2
+
N a O H
R N + N a N O + H O 3 2 2
芳香叔胺与亚硝酸发生芳环上的亲电取代反应,生成C亚硝基类化合物,该取代反应发生在苯环的邻位和对位。
N H 2 + N a N O H C l 2+
0 ~ 5 ℃
+
N N C l + N a C l H O + 2
2.仲胺与亚硝酸的反应 脂肪仲胺和芳香仲胺与亚硝酸作 用均生成N-亚硝基胺。
( C H ) N H + H N O 3 2 2
N H C H 3 +H N O 2
( C H ) N N O + H O 3 2 2
二、胺的结构
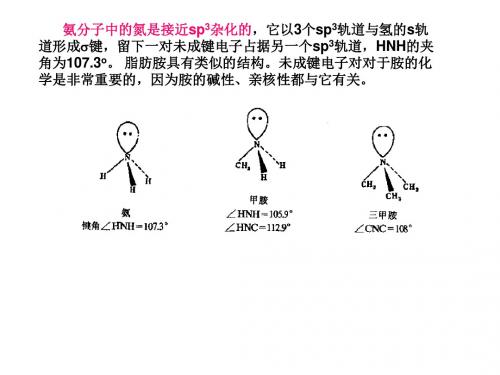
胺具有棱锥形空间构型,氮原子为sp3不等性杂化,一对 孤对电子处于棱锥体的顶端,类似于第4个“基团”。
图13-1 氨、甲胺、三甲胺的结构示意图 第十三章 含氮有机化合物 第一节 胺
13-有机含氮化合物(药学)

烯醇式中连在氧原子上的氢相当活泼,反映了 分子的酸性,称假酸式。所以含α-氢的1°和2°脂 肪族硝基化合物能逐渐溶于强碱的水溶液中并形成 盐,表现出明显的酸性。
第二节 胺
(一)分类和命名
1. 分类:
NH3 R—NH2 R—NH—R’
R’’ R—N—R’
CH3 + CH BrCH3—N— 3 CH3
一硝基化合物 多硝基化合物
(3)结 构
氮原子上的 p 轨道和两个氧原子上的 p 轨道互相重 叠,形成包括三个原子在内的的分子轨道,所以硝基 中的两个氮氧键的键长均等,两个氧原子是等同的。
或
其结构可用共振式表示:
命名
CH3
CH3CHCH3
CH3
C CH3
CH3CH2NO2 硝基乙烷
NO2 2 硝基丙烷
[2H] NH NH H+ H2N NH2 2 NH2
多硝基苯的部分还原: 多硝基芳烃在Na2Sx、NH4SH、(NH4)2S、(NH4)2Sx 等硫化物还原剂作用下可以进行部分还原,即还原一 个硝基。
NO2 NO2
NO2
NH2
(三) α-氢酸性
(了解)
脂肪族硝基化合物中, α-氢受硝基的影响,较 为活泼,可发生类似酮-烯醇互变异构。
+ R-N
H H H :O
H H
+ R2N
H H
+ R3N—H
:O
H
H
溶剂化效应使其碱性强弱顺序为:伯胺>仲胺>叔胺
②电性效应 脂肪胺中的烷基是供电子基,它使 N 上的电子 云密度增大,而且连接的烃基越多,电子云密度就 越高,接受质子的能力越强,碱性增强。 芳胺 N原子上的未共用电子对与苯环共轭,使电子云 向苯环分散,结果使 N原子的电子云密度减少,故碱 性减弱。
含氮化合物ppt课件

NHCH3 CH3 CH CH3 CH CH2 CH CH3
2-甲基-4-氨基戊烷
18
也可将胺作为母体,用阿拉伯数标明氨基的位次。
CH3 CH CH CH2CH3 CH3 NH2
2-甲基-3-戊胺
CH3 CH CH2CH2CH3 NHCH3
N-甲基-2-戊胺
CH3(CH2)3OH CH3(CH2)3NH2 CH3(CH2)3CH3
分子量
74
73
72
沸点(oC)
117.7
77.8
36.1
25
1o 、2o、 3o 胺,由于H的数目不同,分子间形成氢 键能力不同,b.p.随之改变。叔胺中N原子上无活泼氢, 不能形成分子间氢键,所以其沸点最低。
CH3CH2CH2NH2 CH3CH2NHCH3 (CH3)3N
2. 据取代的烃基类型的不同,可分为:
脂肪胺
芳香胺
RCH2NH2 ArNH2
3. 根据氨基的数目还可分为:一元胺、二元胺、多元胺
14
注意:伯、仲、叔胺是按NH3中H被取代的数目来分类。而 伯、仲、叔醇以及不同级数的卤代烷是按与-OH或X
相连的碳的级数来分类的。
CH3 H3C C NH2
CH3
叔丁基胺:1o 胺
(CH3)3N+Cl- + NaOH
(CH3)3N + NaOH + NaCl
NH3+HSO4- + 2NaOH
NH2 + Na2SO4 + 2H2O
利用此性质,可从混合物中分离出并提纯胺。 也可用于胺的定性鉴别。
29
CH2NH2
OH
HCl
CH3 CH2OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章含氮化合物(6学时)目标要求1.掌握硝基化合物的性质2.了解硝基化合物的制备3.掌握季铵盐的性质及霍夫曼规则4.了解胺的制法5.掌握重氮化合物和偶氮化合物的结构6.掌握重氮盐的取代反应和偶联反应及其在有机合成上的应用7.掌握各类分子重排机理教学重点:硝基化合物、胺类化合物、重氮化合物,分子偶联反应、分子重排机理教学难点:硝基化合物、胺类化合物、重氮化合物,分子重排机理主要内容1.硝基化合物的性质及制备2.胺的分类、结构和重要的化学性质3.季铵盐的性质及霍夫曼规则4.胺的制法5.重氮化合物和偶氮化合物的结构6.重氮盐的取代反应和偶联反应及其在有机合成上的应用7.各类分子重排机理胺可以看作是氨中的氢被烃基取代的衍生物。
胺类和它们的衍生物是十分重要的化合物,其与生命活动有密切的关系。
第一节胺的分类和命名一、胺的分类1、根据胺分子中氮上连接的烃基不同,分为脂肪胺与芳香胺。
2、根据胺分子中与氮相连的烃基的数目,可分为一级、二级或三级胺。
3、根据胺分子中所含氨基的数目,可以有一元、二元或多元胺。
胺盐或氢氧化胺中的四个氢被烃基取代而生成的化合物称为季铵盐或碱。
NH2 CH3NH2甲胺苯胺CH2CH2NH2NH2乙二胺[R4N]+ X-[R4N]+OH-季胺盐季胺碱二、胺的命名1、简单的胺的命名可以用它们所含的烃基命名。
2、比较复杂的胺的是以烃基作为母体,氨基作为取代基来命名。
3、胺盐可看作是铵的衍生物。
(CH 3)2CHCH CH 32CH 3CH 2CH CHCH 32H 5)2CH 32-氨-3-甲基丁烷2-(N,N-二乙氨基)-3-甲基戊烷第二节 胺的物理性质氨和胺分子具有四面体棱锥形结构。
状态:甲胺、二甲胺、三甲胺是气体。
低级胺是液体。
高级胺是固体。
有氨的刺激性气味及腥臭味。
芳胺的毒性很大。
伯、仲胺能形成分子间氢键,也能与水形成氢键。
一、 溶解性低级易溶于水,随烃基的增大,水溶解度降低。
二、 熔沸点沸点:比相应的醇、酸低,并且伯胺 > 仲胺 > 叔胺;芳胺是高沸点液体或低熔点固体。
三、 光谱性质(1)、红外光谱:N-H 键:在3500~3600cm-1有伸缩吸收峰。
叔胺没有N-H 键,所以在该区域没有吸收峰。
C-N 键:1350~1000 cm-1有伸缩吸收峰。
(2)、核磁共振谱 :胺的核磁共振特征类似于醇和醚。
氨基质子: δ 0.6~5.0,可变,不易鉴定。
α-碳上质子:δ 2.7~3.1 β-碳上质子:δ 1.1~1.7第三节 胺的反应 一、 碱性♣路易斯酸碱的定义:碱是电子对的给予体,酸是电子对的接受体。
N 原子有未共用的电子对,能接受质子,胺是路易斯碱,是亲核试剂。
胺是弱碱,所以胺盐遇强碱则释放出游离胺,可分离提纯胺。
RNH 2+RNH 3Cl -H 2O NaCl +NaOHRNH 2++ 1、 胺的碱性:(1)Kb 值越大,或pKb 越小,碱性越强。
(2)从电子效应考虑,烷基愈多碱性愈强。
(3)从溶剂化考虑,烷基愈多碱性愈弱。
(4)还有立体效应的影响。
2、碱性秩序: (1) 脂肪胺气态: Me 3N > Me 2NH > MeNH 2 > NH 3水溶液中:Me 2NH > MeNH 2 > Me 3N > NH 3 (2)芳胺 < NH 3 < 脂肪胺 (3)芳胺:NH 2NHN>>(4)取代芳胺:NH 2Ga.G 为吸电基,则碱性减弱 。
b.G 为供电基,则碱性增强。
c.邻位吸电基降低碱性要比在间或对位大得多。
二、 烷基化1、 脂肪胺:3RNH 2R 2NH R 3++R-Br R NH 32NH 2R 34NBr -+OHR NH 2第一胺+R-BrR-Br R-BrR 2NH 3N +++OH OH 季胺盐第二胺第三胺特点:(1)产物是混合物给分离提纯带来了困难。
(2)卤代烃一般用伯卤代烃。
(3)控制条件:使用过量的氨,则主要制得伯胺;使用过量的卤代烃,则主要得叔胺和季铵盐。
2、季铵盐与强碱作用,则生成季铵碱:R 4+KOHR 4NOH +KCl3、季铵碱加热到100o C 则分解生成三级胺和含末端双键的烯烃,如:R CH 2CH 2NH 3 CH 3I R CH 2CH 2N(CH 33R CH 2CH 2N(CH 33AgOHR CH CH 2+N(CH 3)3反应为E2消除 。
定义:用过量的碘甲烷处理胺,最后把生成的季胺碱降解为烯的反应,叫霍夫曼(Hofmann)彻底甲基化反应。
霍夫曼(Hofmann)彻底甲基化反应--霍夫曼降解生成的烯烃成为霍夫曼烯烃,即取代基较少的烯烃,成为霍夫曼规则,如:2 CH 3IN HCH 3OH -NCH 3H 3C CH 3NH 3C CH3OH -CH 3I2 CH 3IN HOH -N H 3C CH 3NH 3C CH3OH -CH 3ICH 3CH 3OHCH 3CH 3三、 酰基化H 3C CXO +RNH 2R 2NH R 3N3R 2NCOCH 3R 3NH H+-)应用:⑴ 用于鉴定胺。
通常用对甲苯磺酰氯(TsCl)来鉴别伯、仲、叔胺。
⑵保护氨基。
⑶ 降低苯环上氨基的活性。
⑷ 磺酰化(Hinsberg )反应。
R NH 2R 2NHR 3NSO 2NR 2SO 2NHR(-)NaOH SO 2NR -NaOH(-)四、 与亚硝酸的反应1、脂肪胺 : (1)、脂肪族一级胺:与亚硝酸作用生成重氮盐。
H 3CH 2CH 2C NH 2+NaNO 2N 2↑X -CH 3CH 2CH 2+H 3CH 2CH 2C NNX -++重氮盐,极不稳定++CH 3CH 2CH 2+H 2OX -H CH 3CH 2CH 2OH CH 3CH 2CH 2X CH 3CH=CH 2CH 3CHCH 3(2)、脂肪族二级胺:与亚硝酸作用生成黄色油状或固体状的N-亚硝基化合物。
R 2NH HNO 2H 2O+R2N-N=O +△R 2NHH +(3)、脂肪族三级胺:在同样条件下与亚硝酸不发生类似的反应。
2、芳香胺: (1)、芳香族一级胺:芳香族一级胺与亚硝酸在低温下反应,生成重氮盐。
它较脂肪族重氮盐稳定。
(2)、芳香族二级胺:芳香族二级胺与亚硝酸作用,生成亚硝基胺。
(3)、芳香族三级胺:芳香族三级胺,若对位没有取代基,在同样条件下,与亚硝酸作用,则生成对亚硝基胺。
五、 胺的氧化三级胺被过氧化氢氧化,生成氧化叔胺,氧化叔胺在加热时消除生成烯烃,成为科普(Cope)反应:N(CH 3)2H 2O 2N(CH 3)2Oor 3)2H CH 23)2O -160℃CH 298%(CH 3)2NOH+C3)2(CH 3)2NOH+O +C C氧化叔胺的消除为顺式消除。
六、 芳胺的特性1、氧化反应:NH 2OO MnO 2H 2SO 42、 卤代:NH 2NH 2BrBrBrHBr+白色↓要得到一卤代物,必须降低氨基的活性:NH 2NH 2Br H 2OHOH -Br 2NH 2Br OH3、磺化作用:NH 2NH 2NH 23H邻、间、对混合物以两性离子结构出现NH 3SO 2O -+或SO 3NH 2NH 2SO 3H 2重排H SO NH 3HSO 4 -+NHSO 3H4、硝化作用:浓NHNHCOCH3NH3OSO2OH+OH -HNO3NH2NO222七、满尼期反应CH3CH3CO+H2C=O+CH3CH2CH2N(C2H5)2CO+H2OHCl(C2H5)2NH反应机理取决于反应物和反应条件,在中性或酸性介质中进行的反应机理如下:+ R2NH+C=OHHCHHCHHR2NH=CH2O H++H2O-(1)(2)CH3CH3CO OH3C CH3CH2CH2NR2COH+CH=NHR2R2N R N第四节胺的制法一、氨的烃基化在一定压力下,卤烃与氨发生亲核取代反应,通常反应的最后产物是一级、二级、三级胺和季胺盐的混合物。
当三级胺和伯卤代烷反应时,则可以得到很好的产率:R3+2R3N CH2RBr -- NH2Br -Br+液NH3NH2+二、含氮化合物的还原1、硝基化合物的还原:(1)催化氢化:CH3NO2H2PtCH3NH2(2)化学还原:NO2Sn + HCl NH2NO2LAH4NH2OH OH2、二硝基化合物的选择性还原——用较弱的还原剂如Na 2S ,NaSH ,(NH 4)2S 等:NO 2NO 2NaSHNH 2NO 23、腈、酰胺、肟的还原: (1)、腈的还原:RCNRCH 2NH 2(2)、酰胺的还原:R NH 2O R H 2C NH 2LiAlH 4(3)、肟的还原:CH 3CH 2CH 2CCH 3N OHCH 3CH 2CH 23NH 2H 2/Ni3、 盖布瑞尔(Gabriel)合成法——合成伯胺:N C 4H 9NH 24H 9KOH49三、 醛酮等化合物的还原C C NHNRN 2R HCH 2/ 催化剂CH NH 2CH NHR CHN 2R H 2C叔胺仲胺伯胺N CH 3CH 3HNO 2+NMe 2NO 对亚硝基-N ,N-二甲基苯胺 (绿色叶片状)小结: ① 0℃时,有N2↑为脂肪伯胺。
② 有黄色油状物或固体,则为脂肪和芳香仲胺。
③ 无可见的反应现象为脂肪叔胺。
④ 0℃时无N2↑,而室温有N2↑,则为芳香伯胺。
⑤ 有绿色叶片状固体为芳香叔胺。
第五节 个别重要的化合物——烯胺及烯胺反应定义:氨基直接与双键相连的化合物称为烯胺:结构:C CN一、 烯胺1、互变异构体:NHNN O+NH2、烯胺β-C 原子具有亲核性:NR2NR2+3、胺可作为中间体:3N+C OCH 3Cl-OC OCH 3Cl -H 2ON++HH第六节 重氮化反应1、芳胺与亚硝酸在低温下生成稳定的重氮盐的反应叫重氮化反应。
NH 2+NaNO 2NaCl +2Cl ++2H 2O2、重氮盐的结构 :N N+Cl -N N+Ar +或第七节 重氮盐的性质 一、 取代反应N 2++Y -Y1、羟基取代 :N 2SO4H+H 2OH +△OHH 2SO 4++N 22、H 原子取代:NaNO 20~5℃HCl+N 2↑HCl+NH 2N 2Cl +HNO 3H 2SO 4△Fe+HClBr 2NaNO 2H 2SO 40~5℃H 3PO 2+H 2OBrBrBr2、 卤原子取代:N 2Cl -+G.Schiemann 反应Gattermann 反应如催化剂为:CuCl-HCl CuBr-HBr 称为Sandmeyer 反应注意:(1)可制备氟苯和碘苯。
(2)亲电取代生成的是邻、对位混合物,而此法可得纯品。
