(完整版)第二章化学反应速率练习题及答案
第二章 化学反应速率与化学平衡 分层习题2022—2023学年上学期高二化学

第二章化学反应速率与化学平衡分层习题含答案2022—2023学年上学期高二化学人教(2019)选择性必修一一、选择题。
(18题)1、在四种不同条件下测得反应2SO2+O22SO3的反应速率如下表所示:编号(1) (2) (3) (4)v(SO2) v(O2) v(SO3) v(O2)0.4 0.25 0.5 0.3其中反应速率最大的是()A.(1)B.(2)C.(3)D.(4)2、A2(g)+B2(g)=2AB(g),ΔH >0。
下列因素能使活化分子百分数增加的是()A. 降温B. 使用催化剂C. 增大反应物浓度D. 增大气体的压强3、下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是( )A. Cu能与浓硝酸反应,但不能与浓盐酸反应B. Fe与浓盐酸反应比与稀盐酸反应快C. N2与O2在常温、常压下不反应,放电时可反应D. Cu与浓硝酸反应比与稀硝酸反应快4、对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是() A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少B.化学反应速率关系是:2v正(NH3)=3v正(H2O)C.达到化学平衡时,4v正(O2)=5v逆(NO)D.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态5、在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其发生反应CO(g)+H2O(g)CO2(g)+H2(g)并达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是()A.平衡后CO的体积分数为40%B.平衡后CO的转化率为25%C.平衡后水的转化率为50%D.平衡后混合气体的平均相对分子质量为246、下列措施或事实不能用勒夏特列原理解释的是()A.H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2+I22HI) B.红棕色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)N2O4 (g)) C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率D.滴加酚酞的氨水中加入氯化铵固体后红色变浅7、配制硫酸铝溶液时,为得到澄清的溶液经常在配制过程中加入少量的()A. H2OB. NaOH溶液C. H2SO4溶液D. Na2SO4溶液8、二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,也是未来实现低碳经济转型的重要环节。
第二章 化学反应速率与化学平衡 测试题 2022-2023学年高二上学期化学
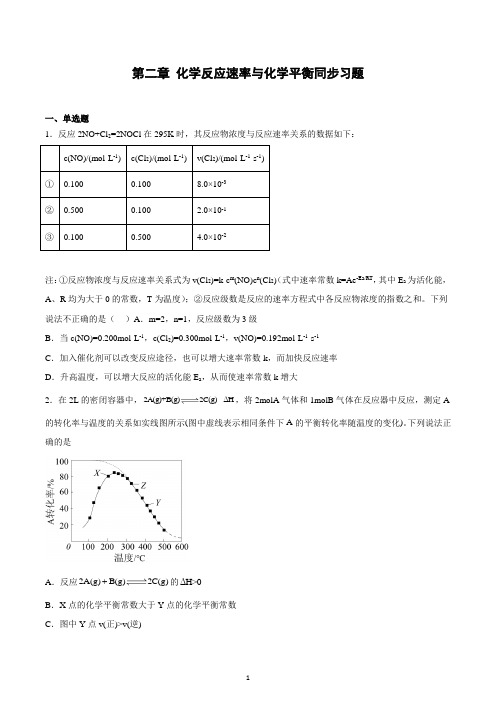
第二章化学反应速率与化学平衡同步习题一、单选题1.反应2NO+Cl2=2NOCl在295K时,其反应物浓度与反应速率关系的数据如下:注:①反应物浓度与反应速率关系式为v(Cl2)=k·c m(NO)c n(Cl2)(式中速率常数k=Ae-Ea/RT,其中E a为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程式中各反应物浓度的指数之和。
下列说法不正确的是()A.m=2,n=1,反应级数为3级B.当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=0.192mol·L-1·s-1C.加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率D.升高温度,可以增大反应的活化能E a,从而使速率常数k增大2.在2L的密闭容器中,2A(g)+B(g)2C(g)ΔH,将2molA气体和1molB气体在反应器中反应,测定A 的转化率与温度的关系如实线图所示(图中虚线表示相同条件下A的平衡转化率随温度的变化)。
下列说法正确的是的ΔH>0A.反应2A(g)B(g)2C(g)B.X点的化学平衡常数大于Y点的化学平衡常数C.图中Y点v(正)>v(逆)D .图中Z 点,增加B 的浓度不能提高A 的转化率3.100mL6mol/LH 2SO 4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量。
可向反应物中加入适量的 A .碳酸钠(固体)B .水C .硫酸铜溶液D .硫酸铵(固体)4.化学反应进行的方向是一个比较复杂的问题。
下列有关说法正确的是 A .反应3224SO (g)H O(1)H SO (l)+=的ΔS>0B .1mol 2CO 在不同状态时的熵值:[][]22S CO (g)<S CO (s)C .反应25222N O (g)4NO (g)O (g)=+H 0∆>能否自发进行与温度有关D .H 0∆<或ΔS>0的反应一定能自发进行 5.合成氨反应为223N (g)+3H (g)2NH (g) 1ΔH=92.4kJ mol --⋅。
第二章化学反应速率与化学平衡同步练习-高二上学期化学人教版(2019)选择性必修1

第二章化学反应速率与化学平衡(同步练习)一、单选题1.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)⇌C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,n(H2O)=n(C2H4)=1mol,容器体积为2L】。
下列分析正确的是A.乙烯气相直接水合反应的ΔH>0B.图中压强的大小关系为p1>p2>p3C.图中a点对应的平衡常数K=58D.达到平衡状态a、b所需要的时间:a<b2.H2与ICl的反应分①、①两步进行,其能量曲线如图所示,下列有关说法错误的是A.反应①、反应①均为放热反应B.反应①、反应①均为氧化还原反应C.H2与ICl的总反应速率快慢取决于反应①D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-13.N2分子在催化剂的作用下发生的一系列转化如图所示。
下列叙述正确的是A.催化剂a的表面有极性键的断裂和非极性键的形成B.催化剂a能提高该反应的平衡转化率C.催化剂a、b增大了该历程中的最大能垒(活化能)D.催化剂b表面发生的反应为4NH3+5O2催化剂b4NO+6H2O4.下列叙述及解释正确的是A.2NO2(g)(红棕色)⇌N2O4(g)(无色)ΔH<0,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅B.H2(g)+I2(g)⇌2HI(g)ΔH<0,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变C.2C(s)+O2(g)⇌2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动D.N2(g)+3H2(g)⇌2NH3(g),在达到平衡后,保持压强不变,充入O2,平衡向左移动5.下列实验操作能达到实验目的或得出相应结论的是A.A B.B C.C D.D6.我国学者采用量子力学法研究了钯基催化剂表面吸附CO和H2合成CH3OH的反应,其中某段反应的相对能量与历程的关系如图所示,图中的TS1~TS5为过渡态,吸附在钯催化剂表面上的物种用*标注。
高二化学化学反应速率试题答案及解析

高二化学化学反应速率试题答案及解析1.在2 L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数。
在0~3 min内,各物质物质的量的变化如下表所示:物质已知2 min内v(Q)=0.075 mol·L-1·min-1,,(1)试确定以下物质的相关量:起始时n(Y)=,n(Q)=。
(2)方程式中m=,n=,p=,q=。
(3)用Z表示2 min内的反应速率。
【答案】(1)2.3 mol 3 mol;(2)1423;(3)0.05 mol·L-1·min-1【解析】本题考查化学反应速率的简单计算。
解题时明确化学反应速率与化学计量数的关系以及化学计算的方法。
对比X的起始量和2 min末的量,可知反应逆向进行。
Δn(Q)=v(Q)·V·Δt=0.075 mol·L-1·min-1×2 L×2 min=0.3 mol对反应过程作“三段式”法分析如下:mX(g)+ nY(g)pZ(g)+qQ(g)始/mol 0.7 n(Y) 1 n(Q)变/mol Δn(X)Δn(Y)Δn(Z) 0.32 min末/mol 0.8 2.7 0.8 2.7故Δn(X)=0.8 mol-0.7 mol=0.1 molΔn(Z)="1" mol-0.8 mol=0.2 moln(Q)=0.3 mol+2.7 mol="3" mol(1)因,故,v(Y)=0.075 mol·L-1·min-1×=0.1 mol·L-1·min-1Δn(Y)=0.1 mol·L-1·min-1×2 min×2 L=0.4 moln(Y)=2.7 mol-0.4 mol=2.3 mol(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)=0.1 mol∶0.4 mol∶0.2 mol∶0.3mol=1∶4∶2∶3(3),v(Q)=0.075 mol·L-1·min-1,故v(Z)=0.05 mol·L-1·min-1。
人教版高中化学选修四 第二章 化学反应速率和化学平衡 章末测试题含答案及详细解析

绝密★启用前人教版高中化学选修四《第二章化学反应速率和化学平衡》章末测试题本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分第Ⅰ卷一、单选题(共20小题,每小题3.0分,共60分)1.增大压强对下列反应的速率无影响的是()A. CO2(g)+Ca(OH)2===CaCO3↓+H2OB. H2(g)+I2(g)2HI(g)C. NaCl+AgNO3===AgCl↓+NaNO3D. N2(g)+3H2(g)2NH3(g)2.在体积和温度不变的密闭容器中充入a mol X和足量Y,发生反应:2X(g)+Y(s)Z(g)+W(g),建立平衡后,若再加入b mol X,下列判断不正确的是()A.平衡正向移动B. X的转化率不变C. Y的转化率增大D. X的转化率减小3.一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)H2(g)+I2(g);则下列有关说法正确的是()A.如改变体系温度,体系颜色一定发生变化B.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移C.继续充入HI气体,则HI的转化率将减小D.温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小4.某一反应物的浓度是1.0 mol·L-1,经过20 s后,它的浓度变成了0.2 mol·L-1,在这20 s内用该物质浓度变化表示的化学反应速率为()A. 0.04B. 0.04 mol·L-1·s-1C. 0.08 mol·L-1·s-1D. 0.04 mol·L-15.在2A+B3C+5D反应中,表示该反应速率最快的是()A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1C.v(C)=0.6 mol·L-1·s-1D.v(D)=1 mol·L-1·s-16.一定温度下,可逆反应a X(g)+b Y(g)c Z(g)在一密闭容器内达到平衡后,t0时刻改变某一外界变化,化学反应速率(v)随时间(t)的变化如图所示。
化学反应速率练习题及

化学反应速率练习题及答案解析一、选择题1. (C) 分子碰撞频率增加,碰撞能量增加,有效碰撞频率增加。
2. (D) 移除产品,改变反应物浓度,改变温度。
3. (A) 温度升高。
4. (D) 活化能较高的反应物浓度增加,活化能较低的反应物浓度减少。
二、解答题1. 反应速率的表达式:r = k[A]m[B]n其中,r为反应速率;[A]和[B]分别为反应物A和B的浓度;k为速率常数;m和n为反应物A和B的反应级数。
2. a) 反应速率与浓度之间的关系可通过一级反应速率方程(r = k[A])进行解释。
当反应物浓度[A]增加时,反应速率也会随之增加。
当反应物浓度[A]减少时,反应速率也会随之减少。
b) 反应速率与温度之间的关系可通过阿伦尼乌斯方程进行解释。
阿伦尼乌斯方程:k = A * e^(-Ea/RT)其中,k为速率常数,A为阿伦尼乌斯因子,Ea为反应的活化能,R为气体常数,T为温度。
当温度T增加时,e^(-Ea/RT)的值增加,导致速率常数k增加,反应速率也会随之增加。
当温度T减少时,e^(-Ea/RT)的值减少,导致速率常数k减少,反应速率也会随之减少。
3. 反应速率与表面积之间的关系可通过催化剂的作用进行解释。
催化剂可以提高反应速率,其中一个重要原因是催化剂能够增大反应物的有效碰撞频率。
催化剂通常是以固体颗粒的形式存在,增大了反应物的表面积,使得更多的反应物分子处于活性位点上,增加了反应物之间的碰撞几率,也提高了反应速率。
4. 反应速率与反应物浓度之间的关系可通过比较反应级数进行解释。
若反应物浓度与反应速率的关系为一次方关系(m = 1),则反应级数为一级反应。
若反应物浓度与反应速率的关系为二次方关系(m = 2),则反应级数为二级反应。
若反应物浓度与反应速率的关系为三次方关系(m = 3),则反应级数为三级反应。
根据反应级数的不同,可以判断反应速率与反应物浓度的关系。
5. 反应速率与活化能之间的关系可通过阿伦尼乌斯方程进行解释。
高二化学选修4第二章《化学反应速率与平衡》同步测试题——《化学反应速率》(1)

高中化学选修4第二章第一节《化学反应速率》测试题(1)第二节《影响化学反应速率的因素》一选择题(每小题1-2个答案)1.在下列过程中,需要加快化学反应速率的是A.钢铁腐蚀B.食物腐烂C.工业炼钢D.塑料老化2.在已达到平衡的可逆反应2SO2+ O22SO3,充入由18O组成的氧气一段时间后,18O存在下列物质中的A.多余的氧气中B.生成的三氧化硫中C.氧气和二氧化硫中D.二氧化硫、氧气和三氧化硫中3.下列措施肯定能使化学反应速率增大的是A.增大反应物的量B.增加压强C.升高温度D.使用催化剂4.下列说法正确的是A.增大压强,活化分子百分数增加,化学反应速率一定增大B.升高温度,活化分子百分数增加,化学反应速率一定增大C.分子间所有的碰撞为有效碰撞D.加入反应物,使活化分子百分数增加,化学反应速率增大5.100mL浓度为2mol·L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是A.加入适量的1mol·L-1的盐酸B.加入数滴硝酸锌溶液C.加热D.加入适量的氯化钠溶液6.燃烧硫铁矿产生SO2,为了提高SO2的生成速率,下列措施可行的是A.把铁矿石碾成粉末B.增大O2压强,向炉内喷吹氧气C.使用Fe2O3作催化剂D.降低温度7.在2A+B=3C+4D反应中,表示该反应速率最快的数据是A.v A=0.5 mol /(L·s)B.v B=0.3 mol/(L·s)C.v C=0.8 mol /(L·s)D.v D=1 mol /(L·s)8.NO和CO都是汽车尾气里的有害物质,它们能缓慢起反应,生成N2和CO2。
对此反应,下列叙述正确的是A.使用催化剂不改变反应速率B.降低压强能加大反应速率C.升高温度能加快反应速率D.改变压强对反应速率无影响9.把镁条投入到盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度④Cl-的浓度,影响反应速率的因素是A.①④B.③④C.①②③D.②③10.不同的化学反应,具有不同的反应速率,决定化学反应速率的主要因素是A .温度B .浓度C .催化剂D .反应物的性质11.能增加反应物分子中活化分子百分数的是A .升高温度B .使用催化剂C .增大压强D .增加浓度12.下列反应中,加压后(其它条件不变)化学反应速率加快的是A .2NO +O 22NO 2B .H 2SO 4+BaCl 2=BaSO 4↓+2HClC .2SO 2+O 22SO 3D .CH 3COOH +C 2H 5OH 24H SOΔ浓CH 3COOC 2H 5+H 2O13.把稀H 2SO 4倒在亚硫酸钠粉末上能使反应的最初速率加快的是A .增大亚硫酸钠粉末的量B .硫酸浓度增加一倍而用量减少至原来的一半。
(完整版)化学反应速率习题

影响化学反应速率的因素1.下列说法正确的是( )A .化学反应速率通常用单位时间内反应物或生成物的质量变化来表示B .用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比C .化学反应速率的单位由浓度单位决定D .在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值2.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )A .Cu 能与浓硝酸反应,而不与浓盐酸反应B .Cu 与浓硝酸反应比与稀硝酸反应快C .N 2与O 2在常温、常压下不反应,放电时可反应D .Cu 与浓硫酸能反应,而不与稀硫酸反应3.下列措施对增大反应速率明显有效的是( )A .Na 与水反应时增大水的用量B. Fe 与稀硫酸反应制取H 2时,改用浓硫酸C .在K 2SO 4与BaCl 2两溶液反应时,增大反应容器体积D .Al 在氧气中燃烧生成Al 2O 3,将Al 片改成Al 粉4.(双选)反应C(s)+H 2O(g)CO(g)+H 2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A .增加C(s)的量B .将容器的体积缩小一半C .保持体积不变,充入N 2使体系压强增大D .保持压强不变,充入N 2使容器体积变大5.在2 L 密闭容器中,投入5 mol N 2、8 mol H 2,在催化剂存在的条件下发生反应,2 min 时,测得容器内生成4 mol NH 3,若将容器的体积减小为原来的一半,其他条件不变,同样生成4 mol NH 3所花费的时间( )A .小于2 minB .大于2 minC .等于2 minD .无法确定6.下列关于催化剂的说法,正确的是( )A .催化剂能使不发生反应的物质发生反应B .催化剂在化学反应前后,化学性质和质量都不变,故催化剂没有参加化学反应C .催化剂能改变化学反应速率垐?噲?D.任何化学反应,都需要催化剂7.下列说法正确的是( )A.一定条件下,增加反应物的量,必定加快反应速率B.升高温度会使放热反应速率减慢,吸热反应速率加快C.缩小体积,增大压强,对于有气体参加的反应都会加快反应速率D.使用催化剂一定会加快化学反应速率8.下列不同条件下的化学反应A+B===C+D,反应速率由大到小顺序正确的一组是( )①常温下20 mL含A和B各0.001 mol②常温下100 mL含A和B各0.01 mol③常温下浓度均为0.05 mol·L-1的A、B溶液各10 mL再加入蒸馏水20 mL④常温下80 mL含A 0.01 mol和20 mL含B 0.005 molA.①②③④B.④③②①C.②④①③D.②①④③化学反应速率与化学平衡正误判断题(一)化学反应速率正误判断1.决定化学反应速率的内在因素是反应物本身的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章化学反应速率练习题一、填空题1.某反应,当升高反应温度时,反应物的转化率减小,若只增加体系总压时,反应物的转化率提高,则此反应为热反应,且反应物分子数(大于、小于)产物分子数。
2.对于反应,其反应级数一定等于反应物计量系数,速度常数的单位由决定,若k的单位为L2·mol-2·S-1,则对应的反应级数为。
3.可逆反应A(g)+ B(g)⇌C(g)+Q达到平衡后,再给体系加热正反应速度,逆反应速度,平衡向方向移动。
4.在500K时,反应SO2(g)+1/2O2(g)⇌SO3(g)的K p = 50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的K p =。
5.反应:HIO3+3H2SO3→HI+3H2SO4,经实验证明,该反应分两步完成;(1)HIO3+H2SO3 → HIO2+H2SO4(慢反应),(2)HIO2+2H2SO3 →HI+2H2SO4(快反应),因此反应的速度方程式是。
6.在298K温度下,将1摩尔SO3放入1升的反应器内,当反应2SO3(g)⇌2SO2(g)+O2(g)达到平衡时,容器内有0.6摩尔的SO2,其K C是,K p是。
(R = 8.314 kPa·L·K-1·mol-1)。
7.已知下列反应的平衡常数:H2(g)+S(s)⇌H2S(g),K c=1.0 ×10-3;S(s)+O2(g)⇌SO2(g),K c= 5.0 ×106;H2(g) + SO2(g)⇌H2S(g) + O2(g)的平衡常数K c为。
8.简单反应A= B + C,反应速度方程为,反应级数为,若分别以A、B两种物质表示该反应的反应速度,则V A与V B。
9.阿仑尼乌斯公式中e-Ea/RT的物理意义是。
10.催化剂能加快反应速度的原因是它改变了反应的,降低了反应的,从而使活化分子百分数增加。
二、判断题(正确的请在括号内打√,错误的打×)11.某温度下2N2O5= 4NO2 + O2该反应的速度和以各种物质表示的反应速度的关系为:V = 1/2V N2O5= 1/4V NO2= V O2 。
()12.化学反应平衡常数K值越大,其反应速度越快。
()13.因为平衡常数和反应的转化率都能表示化学反应进行的程度,所以平衡常数即是反应的转化率。
()14.在2SO2+ O2⇌2SO3的反应中,在一定温度和浓度的条件下,无论使用催化剂或不使用催化剂,只要反应达到平衡时,产物的浓度总是相同的。
()15.增加温度,使吸热反应的反应速度加快,放热反应的反应速度减慢,所以增加温度使平衡向吸热反应方向移动。
()16.化学平衡常数K c等于各分步反应平衡常数K c1,K c2……之和。
()17.催化剂可影响反应速度,但不影响热效应。
()18.化学反应平衡常数K值越大,其反应速度越快。
()19.在一定温度下反应的活化能愈大,反应速度亦愈大。
()20.催化剂将增加平衡时产物的浓度。
()21.一个气体反应的标准自由能变△GΘ298,是指反应物和产物都处于298.15K且混合气体的总压力为100kPa时反应的自由能变。
()22.体系由状态1→状态2的过程中,热(Q)和功(W)的数值随不同的途径而异。
()23.体系发生化学反应后,使产物温度回到反应前的温度时,体系与环境交换的热量称为反应热。
()24.用等温方程式△G=RTln(Q P/K P)判断自发反应的方向时,必须求出△G的数值。
()25.催化剂对可逆反应的正、逆两个反应速度具有相同的影响。
()26.速度定律表达式中,v =k c m A c n B,(m + n)称为反应级数。
()27.反应级数和反应分子数都是简单整数。
()28.化学平衡是化学体系最稳定的状态。
()29.零级反应的反应速度与速度常数二者关系为v = k,表明反应速度与浓度无关。
()30.不同的反应其反应速度常数k的单位不同。
()31.反应速度常数k的单位由反应级数决定。
()32.任何可逆反应在一定温度下,不论参加反应的物质的起始浓度如何,反应达到平衡时,各物质的平衡浓度相同。
()33.反应A + B⇌ C + 热,达平衡后,如果升高体系温度,则生成物C的产量减少,反应速度减慢。
()三、选择题(下列各题只有一个正确答案,请将正确答案填在括号内 )34.2N2O5(g)⇌ 4NO2(g)+ O2(g)分解反应的瞬时速度为( ) 。
A. V N2O5(g) =-2d C N2O5/dtB. V N2O5(g) =dC N2O5/dtC. V N2O5(g) = 4d C N2O5/dtD. V N2O5(g) =-dC N2O5/dt35.CO (g)+ NO2(g) = CO2 (g)+ NO(g)为基元反应,下列叙述正确的是()。
A. CO和NO2分子一次碰撞即生成产物B. CO和NO2分子碰撞后,经由中间物质,最后生成产物C. CO和NO2活化分子一次碰撞即生成产物D. CO和NO2活化分子碰撞后,经由中间物质,最后生成产物36. A + B C + D为基元反应,如果一种反应物的浓度减半,则反应速度将减半,根据是();A. 质量作用定律B. 勒夏特列原理C. 阿仑尼乌斯定律D. 微观可逆性原理37.Br2(g)+ 2NO(g)= 2NOBr(g),对Br2为一级反应,对NO为二级反应,若反应物浓度均为2mol·L-1时,反应速度为3.25 ×10-3mol·L-1·S-1,则此时的反应速度常数为()L2·mol-2·S-1。
A. 2.10 ×102B. 3.26C. 4.06 ×10-4D. 3.12 ×10-738.在气体反应中,使反应物的活化分子数和活化分子百分数同时增大的条件是()A.增加反应物的浓度B.升高温度C.增大压力D.降低温度39.对一个化学反应来说,反应速度越快,则()。
A. △H越负B. E a越小C. △G越大D. △S越负40.A + B ⇌C + D反应的K c=10-10,这意味着()。
A. 正反应不可能进行,物质C不存在B. 反应向逆方向进行,物质C不存在C. 正逆反应的机会相当,物质C大量存在D. 正反应进行程度小,物质C的量少41.在mA(g) + nB(s)⇌pC(g) + Q的平衡体系,加压将导致A的转化率低,则()A. m>pB. m<pC. m = pD. m>p + n42.N2H4(l)⇌ N2(g)+ 2H2(g), 对此平衡来说成立的等式是()。
A. K p= K c(RT)3B. K c=C N2H4 C N2C H2C. K p= K c(RT)-3D. K p= K c(RT)243.某反应△HΘ<0,当温度由T1升高到T2时,平衡常数K1和K2之间的关系是()A. K1>K2B. K1<K2C. K1= K2D. 以上都对44.达到化学平衡的条件是()。
A. 反应物与产物浓度相等B. 反应停止产生热C. 反应级数大于2D. 正向反应速度等于逆向反应速度45.1mol化合物AB与1mol化合物CD,按下述方程式进行反应,AB+CD AD+CB,平衡时,每一种反应物都有3/4 mol转变为AD和CB(体积没有变化),反应的平衡常数为( )。
A. 9/16B. 1/9C. 16/9D. 946. A(g)+B(g) = C(g)为基元反应,该反应的级数为( )。
A. 一B. 二C. 三D. 047.能使任何反应达平衡时,产物增加的措施是( )。
A. 升温B. 加压C. 加催化剂D. 增大反应物起始浓度48. 800℃时,CaCO3(s)⇌CaO(s) + CO2(g)的K c=3.6×10-3 ,此时,CO2的平衡浓度是( )mol·L-1。
A. 3.6×10-3B. 1/3.6×10-3C. (3.6×10-3)1/2D. (3.6×10-3)249.在763.15K时,H2(g) + I2(g)⇌2HI(g)的Kc = 45.9,当各物质的起始浓度c H2=0.0600 mol·L-1c I2=0.4000 mol·L-1,和c HI=2.00 mol·L-1进行混合,在上述温度下,反应自发进行的方向是()。
A. 自发向右进行B. 自发向左进行C. 反应处于平衡状态D. 反应不发生50.在某温度下,反应N2(g)+ 3H2(g)⇌2NH3(g),Kp=0.60,平衡时若再通入一定量的H2(g),此时,则浓度商Q p、平衡常数K p和△G的关系是()。
A. Q p>K p,△G>0B. Q p>K p,△G<0C. Q p<K p,△G<0D. Q p<K p,△G>051.某温度时H2(g) + Br2(g)⇌2HBr(g)的Kp=4×10-2,则反应HBr(g)⇌ 1/2H2(g) +1/2 Br2(g)的Kp是()。
A. 1/4 ×10-2B. 1/[(4×10-2)1/2]C. (4×10-2)1/2D. 2×10-152.电子构型为[Ar]3d64s0的离子是()。
A. Mn2+B. Fe3+C. Co3+D. Ni2+53.某反应的速度常数的单位是mol·L-1·S-1该反应的反应级数为()。
A. 0B. 1C. 2D. 354.有可逆反应:C(s)+ H2O(g)⇌CO(g) + H2(g),△H=133.9 kJ·mol-1,下列说明中,对的是()。
;A. 达平衡时,反应物和生成物浓度相等B. 由于反应前后,分子数目相等,所以增加压力时对平衡没有影响C. 增加温度,将对C(s)的转化有利D. 反应为放热反应55.升高温度,反应速度增大的主要原因是()。
A. 降低反应的活化能B. 增加分子间的碰撞的频率C. 增大活化分子的百分数D. 平衡向吸热反应方向移动56.反应CO(g)+H2O(g)⇌H2(g)+CO2(g)在温度为T时达平衡时,则平衡常数K p与K c的关系是()。
A. K p>K cB. K p<K cC. K p=K cD. K p与K c无关57.对于任意可逆反应,下列条件,能改变平衡常数的是()。
A. 增加反应物浓度B. 增加生成物浓度C. 加入催化剂D. 改变反应温度58.反应A(s)+B(g)→C(g),△H<0,今欲增加正反应的速率,则下列措施中无用的为()。
A. 增大B的分压B. 升温C. 使用催化剂D. B的分压不变,C的分压减小四、计算题59.基元反应:N2O5(g)⇌N2O4(g)+1/2O2(g)⑴写出该反应的速度方程式。
