卟啉的生物合成途径与化学合成方法的比较
卟啉合成机理

卟啉合成机理卟啉是一种广泛存在于自然界中的生物发色素,它在许多重要的生物作用中发挥着重要作用。
在生物体内,卟啉的合成过程十分复杂,涉及到多种酶的协同作用。
而人工合成卟啉的研究也日趋成熟,其机理也被逐渐揭示。
现代合成卟啉的方法主要有两种:一种是通过有机合成方法,另一种是通过生物合成方法。
无论是哪种方法,卟啉的合成机理都很复杂。
下面我们分别来看一下这两种合成卟啉的方法及其机理:有机合成法此法合成卟啉,主要是通过对合成步骤、反应条件和催化剂等进行优化来提高反应的效率和选择性。
具体方法如下:首先,在有机溶剂中将芳香烃硝化,然后用孟加拉醇还原,得到α,β-二硝基芳香烃。
接着,将α,β-二硝基芳香烃在碱性条件下裂解,生成间位甲酸。
此时,间位甲酸自身与芳香氨基结合,形成卟啉。
从反应机理看,其中一个关键步骤是裂解反应,通过裂解反应来生成间位甲酸,因此选择合适的催化剂及反应条件,对提高反应效率具有重要意义。
生物合成法采用生物合成法合成卟啉,主要是将天然的酵母或其他真菌,以及一些原代细胞培养在适宜的条件下,加入咖啡因等有机化合物后,通过酶的催化作用,使血红素原转变成卟啉。
母细胞中咖啡因及相关有机化合物还可以在生长过程中维持卟啉的产量。
从反应机理看,生物合成法中的酶是起到了至关重要的作用。
青霉素和乳酸菌激酶等多种酶的协同作用,非常关键,保证了反应的正常进行。
总之,卟啉的合成机理是非常复杂的,无论是有机合成法还是生物合成法都需要采用复杂的化学和生物工程技术,以实现合成卟啉的目标。
此外,随着科学技术不断的更新和改进,人工合成卟啉的效率和成本都将得到进一步提高,对卟啉及其衍生物的研究也会进一步深入,为人类发展带来更多的机遇和挑战。
卟啉分子式

卟啉分子式
卟啉(porphyrin),大环共轭化合物,分子式C20H14N4。
由四个吡咯通过单原子桥在α位相连构成。
很容易从氯仿和甲醇的混合溶剂中得到深红色有金属光泽的片状卟啉结晶。
高温不熔化但变黑分解(360℃),易溶于吡啶、二氧六环,微溶于氯仿、冰醋酸,不溶于丙酮、醇和醚。
卟啉的衍生物,如四苯基卟啉、八乙基卟啉等在有机溶剂中的溶解性要好得多。
卟啉的合成方法主要有两类:①室温下将吡咯、苯甲醛的二氯甲烷溶液在三氟乙酸或三氟化硼乙醚催化的条件下搅拌,再加入二氯二氰基对苯二醌(DDQ)脱氢即得,反应的产率可达35%~40%。
②以二吡咯甲烷为基础的[2+2]合成法,用酸催化缩合形成大环,再经空气氧化脱氢生成。
此法使不对称卟啉的合成变的容易得多。
卟啉化合物的合成及物理化学性质
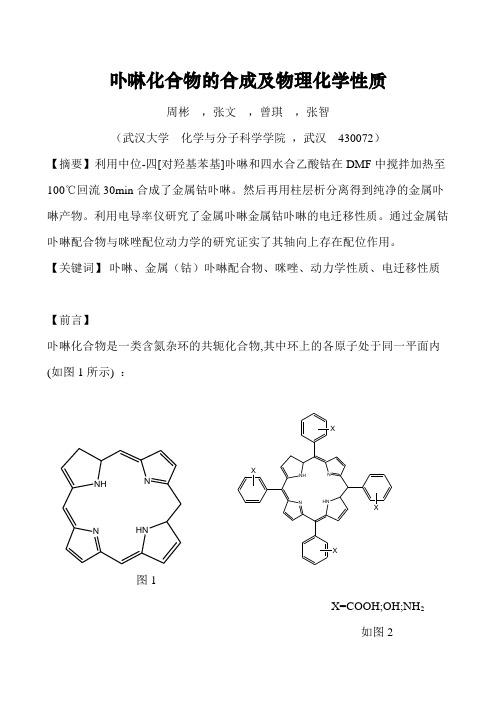
卟啉化合物的合成及物理化学性质周彬 ,张文 ,曾琪 ,张智(武汉大学 化学与分子科学学院 ,武汉 430072)【摘要】利用中位-四[对羟基苯基]卟啉和四水合乙酸钴在DMF 中搅拌加热至100℃回流30min 合成了金属钴卟啉。
然后再用柱层析分离得到纯净的金属卟啉产物。
利用电导率仪研究了金属卟啉金属钴卟啉的电迁移性质。
通过金属钴卟啉配合物与咪唑配位动力学的研究证实了其轴向上存在配位作用。
【关键词】 卟啉、金属(钴)卟啉配合物、咪唑、动力学性质、电迁移性质【前言】卟啉化合物是一类含氮杂环的共轭化合物,其中环上的各原子处于同一平面内(如图1所示) :NHNHNNNHNHNNXXXX图1X=COOH;OH;NH 2如图2卟啉环中含有四个吡咯环,每两个吡咯环在2位与5位之间由一个次甲基桥连,在5,10,15,20,位上也可键合四个取代苯基(如图2),形成四取代苯基卟啉。
卟啉环中有交替的单键和双键,有18个π电子组成的共轭体系,具有芳香性。
当两个氮原子上的质子电离后,其形成的空腔中可以容纳Fe,Co,Mg,Cu,Zn,等金属离子而形成金属配合物,并且这些金属配合物都具有一些生理上的作用。
卟啉化合物具有对光,热的良好稳定性。
它的这种稳定性,大的可见光消光系数和它在电荷转移过程中的特殊作用,使得它在光电领域中的应用受到高度重视,它被用于气体传感器,太阳能的贮存,生物模拟氧化反应的催化剂,生物大分子探针,还可以作为模拟天然产物的母体,金属卟啉配合物被广泛的应用于微量分析等领域。
本实验合成并提纯了卟啉配合物,采用电导仪测定金属配合物在溶液中的电迁移性质,还就其与有机碱的轴向配位反应进行动力学的测定。
【实验部分】⒈试剂与仪器:1.1试剂卟啉,醋酸钴,DMF(二甲基甲酰胺),无水乙醇,无水乙醚,二氯甲烷,丙酮,环己烷,薄层层析硅胶,柱层析硅胶,氢氧化钠,咪唑,1.2仪器紫外-可见分光光度仪,傅立叶变换红外光谱仪,DD3001电导率仪,分析天平,电磁搅拌器,减压蒸馏装置,旋转蒸发仪,抽滤装置,真空干燥器.⒉实验步骤:2.1金属(钴)卟啉配合物的合成与分离在25 ml两口烧瓶中加入0.1540g中位-四(对羟基苯基)卟啉与8mlDMF,搅拌加热,至100o C时加入卟啉量的10倍摩尔量的四水和乙酸钴(0.5606g),继续加热至回流,并保持回流状态20-30min。
卟啉类化合物的应用及其前景

在光催化领域,卟啉类化合物可以作为催化剂在可见光条件下促进有机反应。 例如,在环己烷的液相氧化反应中,卟啉类化合物可以吸收可见光,激发电子, 并促进氧气与环己烷的电子转移,从而实现氧化反应。此外,卟啉类化合物还 可以应用于光催化降解污染物,例如在污水处理中,通过光催化反应可以有效 地降解有机污染物。
2、金属卟啉的制备
将四苯基卟啉和金属盐按照1:1的摩尔比例混合,加入适量的溶剂,搅拌均匀。 将混合物加热至适宜温度,保持一定时间,然后冷却至室温。经过滤、洗涤、测定产物的吸光度,对比标准曲线,确定产物中四苯基卟啉和 金属卟啉的含量。进一步分析实验结果可知,反应条件和溶剂用量对四苯基卟 啉和金属卟啉的合成具有重要影响。优化反应条件和溶剂用量可提高产物收率 和纯度。
根据现有的研究成果和实验验证,卟啉类化合物的应用前景非常广阔。首先, 由于卟啉类化合物具有优异的光电性能和良好的生物相容性,其在太阳能电池、 光催化反应和生物医学领域的应用潜力巨大。其次,通过结构优化和分子设计, 可以进一步提高卟啉类化合物的性能,从而拓展其应用范围。此外,随着绿色 化学和可持续发展的理念日益受到重视,卟啉类化合物的合成方法也将得到进 一步改进,提高其生产效率并降低成本。
参考内容
基本内容
卟啉类试剂是一类具有特殊化学结构的有机化合物,其在化学、生物学、材料 科学等领域具有广泛的应用。近年来,随着科学技术的不断进步,卟啉类试剂 的合成方法与技术也得到了长足的发展。本次演示将简要介绍卟啉类试剂合成 的进展,以期让读者了解其未来的发展方向。
一、卟啉类试剂概述
卟啉类试剂是指由四个吡咯环组成的环形化合物,其具有独特的物理和化学性 质,如大环共轭体系、较强的吸电子能力、高稳定性等。这些特性使得卟啉类 试剂在很多领域都具有重要的应用价值,如光电器件、生物传感器、药物开发 等。
卟啉化合物的合成及光电性能

卟啉化合物的合成及光电性能卟啉是一种重要的天然有机化合物,其分子结构为四个吡啶环通过甲烷桥相连而成,是许多生物体内重要的分子构建块。
因其具有独特的光电性能,广泛应用于光电领域。
本文主要探讨卟啉化合物的合成方法以及其在光电领域的性能表现。
首先,卟啉化合物的合成可通过多种途径实现。
其中,自然界中往往通过生物合成途径产生,而在实验室中,化学合成是常见的方法之一。
通过闭环合成法,可以较为高效地合成卟啉化合物。
闭环合成是指通过碳环的闭合反应,在不断逐步构建分子骨架的过程中,最终合成目标产物。
这种方法具有较高的选择性和效率,是实验室合成卟啉化合物的常用手段之一。
其次,卟啉化合物在光电领域中表现出色的性能。
由于其分子结构的特殊性质,卟啉具有较好的光吸收和电子传输性能。
在太阳能电池中,卟啉化合物可以作为光敏染料,吸收阳光的能量转化为电能。
此外,在光导纤维和光合成中也起到重要作用。
卟啉还可以通过与不同金属配合形成卟啉金属络合物,拓展了其在光电领域的应用领域。
最后,通过对卟啉化合物的研究和合成,可以不断拓展其在光电领域的应用。
通过调控卟啉分子结构,改善其光电性能,提高其在光伏和光催化领域的效率。
同时,进一步研究卟啉与金属的配合反应,探索新的卟啉金属络合物的光电性能,为光电材料的开发提供新的思路和途径。
总的来说,卟啉是一种重要的有机化合物,其在光电领域的应用潜力巨大。
通过合成方法的不断改进和性能研究的深入探索,将为卟啉化合物在光电领域的应用提供更为广阔的前景。
希望未来能够有更多的研究者加入到这一领域,共同推动卟啉化合物的应用与发展。
卟啉类化合物的合成与性质研究

卟啉类化合物的合成与性质研究卟啉类化合物是一类具有特殊结构和重要应用价值的有机化合物。
它们由四个吡咯环通过共享碳原子构成,并且在一个或多个环上含有金属原子。
卟啉类化合物在生物学、材料科学和光电子学等领域具有广泛的应用。
本文将探讨卟啉类化合物的合成方法和性质研究。
一、卟啉类化合物的合成方法卟啉类化合物的合成方法多种多样,其中最常见的方法是通过酸催化的缩合反应合成。
这种方法利用吡咯环上的氨基和醛基或酮基之间的反应,生成卟啉环。
此外,还可以通过金属催化的反应合成卟啉类化合物。
金属催化反应的优势在于反应条件温和,产率高,适用范围广。
二、卟啉类化合物的性质研究卟啉类化合物具有许多独特的性质,其中最引人注目的是它们的光学性质。
由于卟啉环中的共轭双键结构,卟啉类化合物具有很强的吸收和发射光谱。
这使得它们在光电子学领域有着广泛的应用,如光敏染料、光电转换器件等。
此外,卟啉类化合物还具有良好的电子传输性质。
由于卟啉环中的共轭结构,电子在分子内可以自由传输,使得卟啉类化合物成为一种优良的电子传输材料。
这一性质使得卟啉类化合物在有机电子器件中有着广泛的应用,如有机太阳能电池、有机场效应晶体管等。
此外,卟啉类化合物还具有较强的配位性质。
由于卟啉环上的氮原子可以与金属形成配位键,卟啉类化合物可以与金属离子形成稳定的配合物。
这些配合物在生物学和催化领域有着重要的应用,如血红素和维生素B12等。
三、卟啉类化合物的应用前景卟啉类化合物由于其独特的结构和多样的性质,具有广泛的应用前景。
在生物学领域,卟啉类化合物被广泛应用于光动力疗法、荧光探针和生物传感器等。
在材料科学领域,卟啉类化合物可用于制备光电材料、催化剂和分子电子器件等。
在光电子学领域,卟啉类化合物可用于制备光电转换器件、光敏染料和有机发光二极管等。
总之,卟啉类化合物的合成与性质研究对于推动生物学、材料科学和光电子学等领域的发展具有重要意义。
通过不断深入研究,我们可以进一步了解卟啉类化合物的结构与性质之间的关系,为其应用提供更加可靠的理论基础。
卟啉配合物

卟啉配合物
卟啉配合物是一类含有卟啉结构的配合物,其中卟啉是一种含有四个吡啶环并通过共轭连接的大环分子。
卟啉配合物在自然界中广泛存在,包括生物体内的血红蛋白和叶绿素等。
此外,在化学合成和材料科学领域,也可以合成许多具有卟啉结构的配合物,并且它们具有多种不同的性质和应用。
以下是卟啉配合物的一般特点和性质:
1.结构特点:
卟啉结构是由四个吡啶环通过共轭连接而成的大环分子。
在卟啉结构中,通常会有一个中心金属离子与卟啉的氮原子形成配位键,形成卟啉配合物的基本结构。
2.颜色:
许多卟啉配合物在溶液中具有鲜艳的颜色,这是由于卟啉结构中的π电子的共轭结构导致的吸收和发射可见光的能力。
不同金属离子和配体的选择会影响卟啉配合物的颜色。
3.配合键:
卟啉结构的氮原子通过配位键与中心金属离子形成配合物。
配位键的形成使得卟啉配合物具有稳定的结构和特定的化学性质。
4.生物学功能:
在生物体内,卟啉配合物具有重要的生物学功能。
例如,血红蛋白和肌红蛋白中的血红素就是一种卟啉配合物,它们在氧气的运输和储存中起着关键的作用。
叶绿素是另一个重要的卟啉配合物,它在光合作用中起着捕获光能和催化光合反应的作用。
5.合成方法:
合成卟啉配合物通常涉及到有机合成和配位化学技术。
常见的合成方法包括静态反应、动态反应和模板合成等。
通过选择不同的金属离子和配体,可以合成具有不同结构和性质的卟啉配合物,从而拓展其在材料科学和生物医学领域的应用。
总的来说,卟啉配合物具有多种重要的性质和应用,包括生物学功能、光学性质和化学反应活性等,因此受到了广泛的研究和应用。
卟啉化合物的合成

化 学 进 展
PROGRESS IN CHEMISTRY
Vol . 19 No. 4 Apr. , 2007
卟啉化合物的合成 3
王周锋 邓文礼 3 3
(华南理工大学材料科学与工程学院 广州 510640)
摘 要 卟啉化合物在自然界中广泛存在 ,它作为辅基普遍存在于血色素 、肌球素 、细胞色素 、接触酶 素 、过氧物酶 、叶绿素和细胞叶绿素中 。本文主要介绍吡咯与醛酮缩合环化合成卟啉化合物的两种方法 :吡 咯与醛酮直接缩合环化法和模块法 ,分别论述近年来四苯基卟啉型 ( meso2取代) 和八乙基卟啉型 (β2取代) 合 成方面的研究进展 。对模块法中模块单体的合成制备给予较为详细的介绍 。
© 1994-2007 China Academic Journal Electronic Publishing House. All rights reserved.
第4期
王周锋等 卟啉化合物的合成
·521 ·
图 1 不同种类的卟啉化合物 Fig. 1 Different kinds of porphyrins
收稿 : 2006 年 5 月 , 收修改稿 : 2006 年 6 月 3 国家自然科学基金项目 (No. 20643001) 资助 3 3 通讯联系人 e2mail :wldeng @scut. edu. cn
发展非常迅速 ,关于卟啉的著名专著就有 Porphyrins and Metalloporphyrins [3 , 4] 、The Porphyrin Handbook [5] 和 The Porphyrins[6] 等 。在过去的二十年间 ,卟啉化学 经历了一个飞速发展阶段 ,其主要的突破口就是卟 啉类化合物种类的增多和合成方法的改进 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第27卷第6期2012年12月 大学化学UNIVERSITY CHEMISTRY Vol.27No.6Dec.2012 卟啉的生物合成途径与化学合成方法的比较*苏优拉1 张逸2 李嘉宾3** 陆军农3 (1中国药科大学2010届基地班本科生;2中国药科大学2010届制药工程专业本科生;3中国药科大学无机化学教研室药学基础化学实验中心 江苏南京211198) 摘要 对卟啉的生物合成途径和化学合成方法进行简要介绍,并尝试通过比较分析,寻找它们之间的联系,以期对卟啉化学合成方法的改进提供一些有益的信息㊂ 关键词 卟啉 化学合成 生物合成 在自然界的生命体中,有一些化合物发挥着非常重要的作用,比如:叶绿素,其介导的光合作用将光能转化为化学能储存于植物体中,是地球上有机体生存和发展的源泉;细胞色素C,能促进氢与氧的结合,加强体内的氧化供能反应,是细胞呼吸过程中电子传递体的主要组成部分;血红素,作为血红蛋白和肌红蛋白的核心结构域,负责氧气和二氧化碳的转运,在生物体的新陈代谢中起着举足轻重的作用㊂令人惊奇的是,这些化合物虽然在生物体中所处部位不同㊁所起作用迥异,但是,它们都含有一个共同的核心结构 卟啉㊂ 卟啉是在卟吩环上拥有取代基的一类大环化合物的总称㊂卟吩是由4个吡咯环和4个次甲基桥联起来的大π共轭体系,其结构如图1所示㊂天然卟啉类化合物一般是卟吩的吡咯环上的氢被不同基团取代所形成的,例如图1中的血红素㊁叶绿素和细胞色素C㊂卟啉的化学合成方法虽然早在1935年就被首次报道,近年来也进行了一系列的改进,但仍存在产率低㊁产物分离困难㊁能合成的卟啉种类有限等缺点㊂本文介绍卟啉的生物合成途径以及近年来的一系列文献报道的化学合成方法,并尝试通过比较分析,找寻它们之间存在的联系㊂图1摇重要的卟啉类化合物1 卟啉的生物合成途径 卟啉的生物合成几乎存在于所有真核细胞中,可分为6步(图2),即:①δ⁃氨基⁃γ⁃酮戊酸(ALA)的* **基金资助:2009年国家大学生创新训练计划项目通讯联系人,E⁃mail:jbli@2大学化学第27卷 形成;②吡咯单元(PBG)的形成;③尿卟啉原Ⅲ(含HMB中间体)的形成;④尿卟啉原Ⅲ的氧化;⑤粪卟啉原Ⅲ的氧化;⑥原卟啉原Ⅸ的氧化㊂其中,第②步缩合㊁第③步环合和第⑥步氧化涉及卟啉环骨架的构建,而第④步和第⑤步只是对卟啉环上侧链的修饰㊂图2 卟啉类化合物的生物合成途径[1⁃2]1.1 ALA的形成 ALA的形成是卟啉生物合成中的第一步,也是限速步骤[2]㊂在生物体中,ALA可由两条途径形成(图3)㊂Shemin途径[4]由David Shemin于1945年首次发现并逐步完善,主要存在于不进行光合作用的真核生物中,如动物和真菌[5]㊂ALA合成酶末端含一个赖氨酸(Lys)残基,当没有底物时,辅基磷酸吡哆醛(pyridoxal⁃5′⁃phosphate,PLP)与其形成Schiff碱,存在底物甘氨酸(Gly)时,Gly与PLP形成Schiff 碱再和琥珀酰CoA缩合形成ALA的同时释放CO2[3]㊂Beale等于20世纪70年代中期发现了以谷氨酸(Glu)为起始原料的C5途径[6]㊂它存在于植物㊁大多数细菌和所有古细菌中㊂C5途径主要依赖3种酶,连接酶通过形成谷氨酰基⁃1⁃t RNA激活1位羧基,还原酶将羧基还原为醛基,再经转氨酶的作用形成ALA[3]㊂在少数几种生物中也发现两条途径都存在[5]㊂图3 ALA形成的两种途径[3]1.2 PBG 的形成 两分子ALA 之间不对称缩合产生第一个吡咯衍生物 PBG(porphobilinogen)[5](图4)㊂反应机制与Knorr 吡咯缩合反应相似,首先,2个ALA 分子与酶活性部位的保守Lys 残基形成Schiff 碱,P 位ALA 分子的C 4和A 位ALA 分子的C 3进行Aldol 缩合形成C C 键,接着P 位ALA 分子的氨基进攻羰基碳原子形成C N 键[7]㊂图4 两分子ALA 缩合形成PBG1.3 HMB 的形成及其转化为尿卟啉原Ⅲ 4分子PBG 缩合形成尿卟啉原Ⅲ(uroporphyrinogen Ⅲ)是卟啉环生成的一个关键步骤,很多人对其具体过程提出了不同的猜想[8⁃10]㊂1980年Battersby A.R.等通过同位素标记证明了HMB(1⁃hydroxym⁃ethylbilane,羟甲基胆色烷)是尿卟啉原Ⅲ合成过程中的中间体;1987年他们又发现了新型辅基 二吡咯甲烷(dipyrromethane,DPM)[11],为阐明具体步骤奠定了基础㊂尿卟啉原Ⅲ的形成由两种酶共同完图5 尿卟啉原的形成(HMB 中间体)[3,10,13]成(图5)㊂首先,脱氨酶将4个PBG 组装形成开链HMB;在此过程中,先合成出二吡咯甲烷辅助因子,与脱氨酶末端的半胱氨酸巯基以硫醚键相结合,DPM 再和4分子底物相连接;当DPM 上连有4个吡咯单体时,a 环和DPM 之间的键断裂形成HMB㊂第二步,HMB 被转运到尿卟啉原Ⅲ合成酶上,在环合的同时,d 环重排生成尿卟啉原Ⅲ[12]㊂在无尿卟啉原Ⅲ合成酶时,HMB 在酸催化下迅速形成有毒性的不被代谢的尿卟啉原Ⅰ㊂值得注意的是,编码两种酶的基因位于同一操纵子内,两个基因协同表达[5],但3 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较尿卟啉原Ⅲ合成酶的表达量远远超过脱氨酶,以保证在生理条件下总是生成尿卟啉原Ⅲ[8]㊂1.4 尿卟啉原Ⅲ 粪卟啉原Ⅲ 原卟啉原Ⅸ 尿卟啉原脱羧酶(uroporphyrinogen Ⅲdecarboxylase,UROD)和粪卟啉原氧化酶(coproporphyrinogen Ⅲoxidase,CPOs)催化卟啉环侧链的修饰(图6)㊂在生理底物浓度下,4个环的脱羧作用是按d →a →b →c 的顺序发生;当底物浓度超过生理浓度时,脱羧作用以随机方式发生[5]㊂脱羧后生成的粪卟啉原Ⅲ(coproporphyrinogen Ⅲ)在哺乳动物中,经过位于线粒体外膜的依赖O 2的CPOs 催化,最终把电子传递给O 2㊂此过程不需要金属和辅助因子辅助[2],CPOs 的催化机理至今仍不清楚[5],详细过程见文献[14]㊂图6 卟啉环侧链的修饰[2]1.5 原卟啉原Ⅸ的氧化[15] 原卟啉原氧化酶(protoporphyrinogen Ⅸoxidase,PPOs)位于线粒体内膜的外表面,以O 2作为最终的电子受体,以FAD 为辅助因子,催化原卟啉原Ⅸ(protoporphyrinogen Ⅸ)的氧化,最终形成完全共轭的大环体系(图7)㊂生成的原卟啉Ⅸ(protoporphyrin Ⅸ)被直接转运到亚铁螯合酶上,以避免其对细胞的损害(原卟啉Ⅸ对光高度敏感,在O 2存在下,经光照射会产生自由基)㊂图7 原卟啉原Ⅸ的氧化2 卟啉的化学合成方法总结 目前,卟啉的化学合成方法主要有两种:①4个吡咯单体直接缩合环化生成卟啉(简称四吡咯合成法);②模块法㊂合成方法和路线的选择取决于目标卟啉分子的结构特点,中位对称取代的卟啉主要用四吡咯合成法,而不对称卟啉㊁天然卟啉及其类似物主要采用模块法合成㊂2.1 四吡咯合成法2.1.1 Rothemund 法 卟啉类化合物最早由Rothemund 合成[16]㊂Rothemund 法以醛类化合物(甲醛㊁乙醛㊁苯甲醛等)和吡咯为原料,以吡啶和甲醇为溶剂在封管中反应,90~95℃下反应24~48h(图8)㊂该法反应时间长,所需反应条件苛刻,而且后处理非常麻烦,产率很低;在此条件下,能用来作反应物的取代苯甲醛极少[17]㊂4大学化学第27卷 图8 Rothemund 法2.1.2 Adler⁃Longo 法及其改进 Adler 和Longo 等以有机质子酸作催化剂成功地制备了卟啉,并在1964年提出了卟啉生成的反应机理[18]㊂该法采用苯甲醛和吡咯在丙酸中回流反应30min,经冷却㊁过滤㊁洗涤及真空干燥,得到四苯基卟啉,产率达20%(图9)㊂此法的优点是操作比较简单,实验条件不算苛刻,产率较高㊂但由于反应条件的限制,一些带敏感基团的取代苯甲醛不能用作原料,带有强吸电子基的苯甲醛为底物时产率特别低;反应极易产生大量焦油状物,导致纯化非常困难;另外反应中的副产物四苯基二氢卟啉与四苯基卟啉分离较困难[17]㊂图9 Adler⁃Longo 法 潘继刚等[19]对Adler⁃Longo 法作了进一步调整,他们采用催化量的有机酸和极性溶剂代替丙酸介质,反应过程中产生的杂质明显减少,四苯基卟啉的产率最高达到50%㊂研究溶剂和催化剂对反应的影响,发现H +在反应过程中起催化剂的作用,p K a 2.0~4.0的酸作催化剂,合成产率较高㊂以二甲苯㊁甲苯㊁氯苯㊁硝基苯㊁苯甲醚为溶剂,四苯基卟啉产率较高,可达30%~50%㊂2.1.3 Lindsey 法及其改进 Lindsey 等[20]进一步改进了四苯基卟啉的合成,采用苯甲醛和吡咯在氮气保护下,在二氯甲烷中,以三氟化硼和乙醚络合物催化,整个反应分两步进行,先得到卟啉合成的中间体卟啉原(porphyrinogen),然后,以二氯二腈基苯醌(DDQ)或四氯苯醌(TCQ)将卟啉原氧化得到最终产物卟啉,从而使反应可以在常温下进行㊂近20年来,Lindsey 小组进一步研究了此一锅两步合成法的影响因素,发现酸催化剂的种类和用量㊁醛和吡咯上的取代基以及反应物浓度均会影响反应产率,并对主要副产物 链状聚合物的组成进行了分析[22⁃24]㊂由于Lindsey 法的反应温度较低,较少产生焦油状副产物,目标产物的分离提纯较容易;同时较低的反应温度也允许反应物先经过化学修饰,连接上一些敏感基团,平均产率可达45%~50%(图10)㊂但该反应浓度低,且最大反应容积为1L,放大后效果不好[21]㊂反应条件较苛刻,需要无水无氧操作,且反应还不能一步生成四苯基卟啉,必须在反应过程中另外加入氧化剂㊂ 郭灿城等[25]采用N ,N ⁃二甲基甲酰胺为溶剂,无水AlCl 3为催化剂,苯甲醛和吡咯缩合生成四苯基卟啉,产率可达30%,高于Adler 法㊂反应过程中不需氮气保护,产物不含副产物四苯基二氢卟啉,并且反应时间也较短,为2h㊂该方法的应用范围较广,对于以取代苯甲醛为原料的合成反应,产率在25%~30%之间㊂缺点是催化剂AlCl 3易与水反应,给产物的分离造成困难㊂5 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较6大学化学第27卷 图10 Lindsey法 Adler⁃Longo法和Lindsey法是目前应用比较广泛的两种方法㊂它们的主要区别在于所用的催化剂不同,Adler⁃Longo法用有机质子酸作为催化剂,而Lindsey法则用Lewis酸作为催化剂㊂2.1.4 微波催化合成法 1986年,Gedye等[26]发现微波可显著加快有机合成反应速率㊂从此,微波在合成化学领域迅速得到重视㊂以二甲苯为溶剂,对硝基苯甲酸为催化剂使苯甲醛和吡咯在微波炉内反应20min,可以得到卟啉,产率为9.5%[27]㊂微波辅助合成卟啉在我国发展较快,研究表明微波作用的时间与强度㊁溶剂及催化剂的选择㊁反应试剂的组成及用量等均对卟啉的合成有较大的影响㊂此法避免了传统加热合成方法的反应时间较长(一般需回流2~3h)㊁副反应多㊁产率不高且产物难提纯等缺点,且符合节能环保㊁绿色化学的发展趋势[28]㊂2.2 模块法 模块法主要包括[2+2]和[3+1]两种方法㊂ [2+2]合成亦称MacDonald方法[29],即两分子二吡咯甲烷缩合产生卟啉母核㊂该法可方便地合成具有C2对称轴的四苯基卟啉,也称为trans⁃卟啉,还可合成中位是4个不同芳基取代的卟啉㊂近年来,随着原料二吡咯甲烷衍生物合成方法的逐步改进和优化,可以合成的衍生物种类逐渐增多,产率也得到了提高,使[2+2]法的应用范围越来越广[30]㊂ [3+1]法是由MacDonald方法衍生出来的,将一个由两个桥碳原子连接的3个吡咯环组成的胆色素分子和一分子a,a′⁃二甲酰基吡咯环合得到卟啉的合成方法㊂此方法总产率较低,能合成一些结构复杂且较为特殊的卟啉,主要用于扩充卟啉的种类[31]㊂ 关于卟啉化学合成方法更详细的总结可参考文献[32]㊂3 化学合成和生物合成之间的联系3.1 起始原料 化学合成和生物合成两种途径都以单个吡咯环作为合成卟啉环的起始原料㊂不同的是,化学合成通常以吡咯或取代吡咯以及醛类为原料,而生物合成途径中由两个ALA分子通过类似Knorr吡咯缩合产生的带亚甲氨基侧链的吡咯单元(PBG)作为起始原料㊂3.2 单体吡咯的聚合方式 在生物合成和化学合成过程中,吡咯都是通过质子化㊁脱氨或脱水㊁再去质子的3步循环逐步加成形成聚合物㊂在此过程中都会产生活泼烯键,以促进吡咯的聚合(图11)㊂在生物合成中,吡咯单元(PBG)自身带有亚甲氨基侧链(来自甘氨酸),侧链脱氨之后形成烯键而被活化;而在化学合成中则是吡咯进攻醛基,产生带羟基的侧链,羟基质子化脱水后形成烯键而被活化㊂图11 单体吡咯聚合的可能机理(a )生物合成;(b )化学合成3.3 链状吡咯聚合物环合形成卟啉原 两种途径都是单体吡咯先聚合成链状吡咯聚合物,然后4个吡咯单体经亚甲基桥再进一步环合成卟啉原(图12)㊂在生物合成途径中,PBG 脱氨酶与辅助因子DPM 和吡咯聚合物形成复合物,当连有4个吡咯时,环a 和酶之间的键会水解断裂形成链状HMB㊂其原因至今仍是一个谜,可能与酶的空间结构和新型辅助因子二吡咯甲烷有关;可能类似于生物体内多糖和多肽的形成过程㊂ 根据Adler 等提出的机理,化学合成时吡咯和醛类先形成长短不一的链状聚合物,推测反应中形成的焦油状副产物很可能是吡咯和醛类的链状聚合物或者吡咯自身的聚合物㊂主要生成环状四聚体可能与卟啉独特的空间结构的稳定性有关㊂ 在环合时,生物合成途径有一步特有的环翻转过程,HMB 的亚甲基被活化后,进攻与其距离较远的C 16,与C 16环合形成螺中间体,d 环翻转,碳链在另一处断裂再环合形成尿卟啉原Ⅲ㊂而化学合成没有环的翻转过程,活泼烯键直接与C 19环合形成卟啉环,与体内尿卟啉原Ⅰ的形成过程类似㊂3.4 卟啉原氧化形成大环共轭的卟啉 在生物合成中,原卟啉原Ⅸ在PPOs 的催化下形成大环共轭的卟啉㊂PPOs 以二聚体形式存在,由3个结构域组成(图13),分别为FAD 结合域㊁底物结合域和膜结合域㊂原卟啉原氧化酶的辅助因子FAD 发挥重要的电子传递作用,以O 2作为最终的电子受体,因其每次只能转移两个电子,所以要经过3个独立的循环才能氧化完全,产生二氢卟啉和四氢卟啉中间体(图14)㊂当酶与底物结合时,底物带负电荷的丙酸基侧链与酶的精氨酸残基结合,使底物以一定方向被固定在酶上,只能以a 环和d 环间的亚甲基桥通过酶的狭缝与FAD 的N 5原子接触,环上的氢原子通过亚胺⁃烯胺互变异构重排并逐步被氧化㊂ 在化学合成中,4分子醛与吡咯缩合,最终环合后产生卟啉原㊂1970年,Dolphin 等证实卟啉原确实是卟啉合成过程的中间体[31]㊂卟啉原不稳定,极易被氧化,但在一般条件下氧化又不完全,产生的二氢卟吩混在卟啉中很难除去[35]㊂在反应中加入氧化剂或在反应结束后再进一步氧化能提高产率㊂硝基7 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较图12 由吡咯单体形成卟啉原的过程(a )生物合成;(b )化学合成图13 原卟啉原氧化酶的空间结构[15]8大学化学第27卷 图14 生物合成中原卟啉原Ⅸ的氧化[18,33⁃34,41]苯[36]㊁DMSO [37]㊁DDQ [20]以及最近文献报道的MnO 2[38]和SeO 2[39]等均能作为氧化剂,实现从卟啉原到卟啉的氧化,但氧化反应的具体机理至今仍不太清楚㊂ 在卟啉原的氧化过程中,生物合成和化学合成都是通过互变异构转移H N 和H C,逐步延长共轭链,产生二氢卟啉和四氢卟啉的中间体并最终形成大环共轭的卟啉㊂不同的是在生物合成过程中,底物被酶包裹,由于酶对底物的固定作用,卟啉原上所有的氢必须都转移到C 20上才能被氧化;而且由于酶蛋白对底物的稳定作用,中间体二氢卟啉和四氢卟啉可以以不太稳定的形式存在㊂而在化学合成过程中,氧化反应可以在任一亚甲基桥上发生,而且氧化后氢转移的最终结果要保证共轭链的延伸,中间体二氢卟啉和四氢卟啉要以相对稳定的形式存在㊂9 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较01大学化学第27卷 4 总结和展望 近年来,由于卟啉类化合物独特的分子结构,在仿生学㊁药物化学㊁分析化学㊁光物理与化学㊁材料化学㊁电化学㊁催化化学等领域中被广泛地研究与应用,但是较低的化学合成产率限制了进一步发展㊂本文通过比较卟啉的生物合成途径和化学合成方法,尝试寻找二者的联系,希望能为改进化学合成方法㊁提高合成产率提供一些启示㊂ 生物合成和化学合成一样,也遵循基本的化学反应规律,反应的本质是相同的㊂只不过由于酶的参与,酶的辅基或酶上的某个保守基团与底物相互作用,固定或增强底物的反应活性,稳定中间体的结构,降低反应的活化能,可使化学反应高效专一地进行㊂在化学合成中,影响产率的主要是底物的活性㊁对聚合度的控制以及卟啉原的氧化;而生物合成在这3方面的控制很精密㊂基于上述生物合成与化学合成的联系与差别,可以尝试从以下几方面对化学合成进行改进㊂ (1)在生物合成过程中,底物的反应活性较高㊂例如,吡咯聚合时,氨基被质子化后经脱氨酶作用迅速形成活泼烯键,易于被进攻㊂而在化学合成中,活泼烯键的形成要通过脱水,而在一般条件下自动脱水比较困难㊂在底物上引入其他适当的离去基团可以促进缩合,有时甚至可以省去最后一步的氧化,直接生成卟啉㊂Pierre Martin小组2010年报道的[2+2]法就是在底物上引入碘原子,缩合时消除碘化氢和水,不用加氧化剂直接在室温下生成大环共轭的卟啉[40]㊂此方法的原理若能推广至其他卟啉合成方法中,有可能显著降低反应温度,提高产率㊂ (2)生物合成途径对副产物的控制非常严格,原料利用率较高㊂吡咯聚合时一端通过巯基与酶相连,只有另一端延伸㊂当尿卟啉原Ⅲ合成酶催化链状吡咯聚合物的环合时,将聚合度严格控制在4,不会生成长链吡咯聚合物或者多元环状吡咯聚合物㊂这一点若化学合成则实现起来较困难㊂而且,目前的化学合成都需要酸催化,吡咯在酸性条件下容易因聚合而被破坏㊂抑制吡咯自身的聚合并精确控制吡咯和醛类的链状聚合物的聚合度尚有待于进一步改善㊂可以先在酸催化下不断延伸生成长链聚合物,将聚合物的一端固定,再用PBG脱氨酶和尿卟啉原Ⅲ合成酶从另一端进行切割和组装;或者在反应中加入具有空腔的材料,而空腔的大小恰好能容纳四聚体,这样就能把反应分割成多个单元,抑制聚合物的形成㊂例如,各种型号的分子筛孔径大小不同,具有一定的酸性,又能吸水,可以尝试㊂此外,既然卟啉能和金属离子形成配合物,可以模拟冠醚的合成方法,通过金属离子的模板效应来促进四聚体的形成㊂ (3)生物合成途径的最后一步为芳构化反应,在辅助因子FAD的作用下,以氧气作为最终的电子受体,实现了大π共轭体系(即卟啉环)的构建㊂在化学合成模拟生物合成时,聚合和氧化这两步分别进行,以避免在聚合过程中生成氧化的中间体,阻碍四聚体的形成㊂最近有文献报道分别以MnO2和SeO2作为氧化剂,用于卟啉原的氧化,能提高产率㊂它们虽然易于后处理,但都会污染环境㊂继续寻找价格低廉且环境友好的氧化剂,温和并高效地完成芳构化反应,符合当前绿色化学的发展趋势和要求㊂参 考 文 献[1] Scott A I.J Org Chem,2003,68(7):2529[2] Ajioka R S,Phillips J D,Kushner J P.Biochimica et Biophysica Acta,2006,1763:723[3] Porra R J.Photochem Photobiol,1997,65(3):492[4] Battersby A R.Nat Prod Rep,2000,17:507[5] Heinemann I U,Jahn M,Jahn D.Arch Biochem Biophys,2008,474:238[6] Beale S I.Proc Natl Acad Sci USA,1975,72(7):2719[7] Leeper F J.Nat Prod Rep,1985,2(1):19[8] Frydman B,Frydman R B.Acc Chem Res,1975,8(6):201[9] Scott A I,Ho K S,Kajiwara M.J Am Chem Soc,1976,98(6):1589[10] Battersby A R,Mcdonald E.Acc Chem Res,1979,12(1):14[11] Hart G J,Miller A D,Battersby A R,et al.J Chem Soc,Chem Commun,1987,23:1762[12] Battersby A R.J Nat Prod,1988,51(4):629[13] Leeper F J.Nat Prod Rep,1985,2:561[14] Jackson A H,Elder G H,Smith S G.Int J Biochem,1978,9(12):877[15] Koch M,Breithaupt C,Messerschmidt A,et al.EMBO J,2004,23:1720[16] Paul R.J Am Chem Soc,1935,57:2010[17] 郝晓伶,韩士田,刘彦钦.河北师范大学学报(自然科学版),2009,33(1):85[18] Adler A D,Longo F R,Williams H.J Am Chem Soc,1964,84(15):3145[19] 潘继刚,何明威,刘轻轻.有机化学,1993,13(5):533[20] Lindsey J S,Schreiman I C,Hsu H C,et al.J Org Chem,1987,52(5):827[21] 杨彪.精细化工,1999,16:56[22] GeierⅢG R,Lindsey J S.J Porphyrins Phthalocyanines,2002,6:159[23] GeierⅢG R,Lindsey J S.J Chem Soc,Perkin Trans2,2001(5):677[24] GeierⅢG R,Lindsey J S.Tetrahedron,2004,60:11435[25] 郭灿城,何兴涛,邹纲要.有机化学,1991,11(4):416[26] Gedye R.Tetrahedron Lett,1986,27(3):279[27] Petit A.Synth Commun,1992,22(8):1137[28] 汉玉霞,韩士田,刘彦钦.化学工程与装备,2008,6:98[29] Arsenault G P,Bullock E,Macdonald S F.J Am Chem Soc,1960,82:4384[30] Lindsey J S.Acc Chem Res,2010,43(2):300[31] 王周锋,邓文礼.化学进展,2007,19(4):520[32] akthitharan S,Edwards C,Boyle R W.Tetrahedron,2000,56:1025[33] Massey V.Biochem Soc Trans,2000,28(4):283[34] Mattevi A.Trends Biochem Sci,2006,31:276[35] 王君文,何明威.化学试剂,2001,23(1):9[36] 杨琴,冯清.中国药物化学杂志,2006,16(3):154[37] 章艳,高保娇.合成化学,2008,16(1):86[38] Bruno F O N,António M R G,Marta P.Inorg Chem Commun,2010,13:395[39] Stephanie M S L,Diogo R B D,Eugênia R D,et al.Tetrahedron Lett,2011,52:1441[40] Pierre M,Markus M,Dietmar F,et Process Res Dev,2010,14:799[41] Banerjee R.REDOX BIOCHEMISTRY.Hoboken,New Jersey:Wiley John&Sons,Inc,200811 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较。
