4、理想气体的性质与热力
热工基础 第三章.理想气体的性质与热力过程

i 1 i 1
29
k
i 1 k
i 1 k
3-4 理想气体的热力过程
1.热力过程的研究目的与方法
(1)目的: 了解外部条件对热能与机械 能之间相互转换的影响,以便合理地安排 热力过程,提高热能和机械能转换效率。
V V1 V2 Vk Vi
i 1
k
25
3. 理想混合气体的成分 成分:各组元在混合气体中所占的数量份额。 (1) 成分的分类 1)质量分数 :某组元的质量与混合气体总质量
的比值称为该组元的质量分数。
k k mi wi , m mi wi 1 m i 1 i 1 2)摩尔分数 : 某组元物质的量与混合气体总物
22
3-3
理想混合气体
1. 理想混合气体的定义 由相互不发生化学反应的理想气体组成混合 气体,其中每一组元的性质如同它们单独存在一 样,因此整个混合气体也具有理想气体的性质。 混合气体的性质取决于各组元的性质与份额。 2. 理想混合气体的基本定律 (1)分压力与道尔顿定律 分压力: 某组元i单独占有混合气体体积V并处于 混合气体温度T 时的压力称为该组元的 分压力。用 pi 表示。
10
由比定容热容定义式可得
qV u cV dT T V
(4)比定压热容
cp
q p dT
据热力学第一定律,对微元可逆过程,
q dh vdp
11
焓也是状态参数, h h(T ,
p)
h h dh dT dp T p p T 对定压过程,dp 0 ,由上两式可得 h q p dT T p
第三章__理想气体热力性质及过程

容积成分: i
Vi V
, i
1
摩尔成分: xi
ni n
, xi
1
换算关系:
i xi
i
xi M i xi M i
xi M i M eq
xi Rg,eq Rg ,i
,
xi
i Rg,i
Rg ,e q
分压力的确定:
由
piV=ni RT PVi=ni RT
ppi V Vi i ,
2
u 1 cVdT
如果取定值比热或平均比热,又可简化为
二、焓
ucVT
也可由热Ⅰ导得 d h(cVRg)dT cpdT
同理,有
2
h 1 cpdT
hcpT
结论:理想气体的u、h 均是温度的单值函数。
三、 熵变的计算
由可逆过程
ds du pd
T
ds du
cp
Rg 1
三、 真实比热容、平均比热容和定值比热容
1. 真实比热容(精确,但计算繁琐)
cpa0a 1 Ta2T2a3 T3
c V (a 0 R g) a 1 T a 2 T 2 a 3 T 3
qp
2 1
cpdt
2
q 1 cdt
2. 平均比热容(精确、简便)
cV
ln
T2 T1
Rg
ln
2 1
s
c
p
ln
T2 T1
Rg
ln
p2 p1
s
c
p
ln
2 1
cV
ln
p2 p1
理想气体的性质

理想气体的性质
理想气体是指在一定条件下具有理想行为的气体。
它是理想化的气
体模型,假设气体中分子之间没有相互作用和体积,并且分子之间的
碰撞是弹性碰撞。
以下是理想气体的主要性质:
1. 理想气体的分子是无限小的,没有体积,分子之间没有相互作用力。
这意味着气体的体积可以无限压缩,并且气体分子之间不存在任
何引力或斥力。
2. 理想气体的分子运动是完全混乱的,分子在空间中自由运动,并
且沿各个方向上的速度分布是相等的。
这被称为分子速度均分定理。
3. 理想气体的压强与温度成正比,压力与体积成反比。
这意味着如
果气体的温度升高,压强也会增加,反之亦然;如果气体的体积减小,压力也会增加,反之亦然。
这被称为理想气体状态方程或理想气体定律。
4. 理想气体的温度与体积成正比,温度与压强成正比。
这意味着如
果气体的体积增加,温度也会增加,反之亦然;如果气体的压强减小,温度也会减小,反之亦然。
这被称为理想气体的热力学性质。
需要注意的是,现实气体往往存在分子间相互作用和体积,因此它
们不完全符合理想气体模型。
然而,理想气体模型在许多实际应用中
仍然是一个非常有用的近似模型。
理想气体
热工基础与应用 第三章
五、理想气体的基本热力过程
(一) 定容过程
(二) 定压过程
(三) 定温过程 (四) 定熵过程
六、理想气体的多变过程
(一) 多变过程
(二) 计算公式表
西安交通大学热流中心
热工基础与应用 第三章
氮气, 例:初压力为 0.1MPa ,初温为 27 o C 的 1 kg 氮气,在 n = 1.25 若取比热容为定值, 的压缩过程中被压缩至原来体积的 1 5 ,若取比热容为定值,试求压缩 后的压力,温度,压缩过程所耗压缩功及与外界交换的热量。 后的压力,温度,压缩过程所耗压缩功及与外界交换的热量。若从相同初态 出发分别经过定温和定熵过程压缩至相同的体积,试进行相同的计算, 出发分别经过定温和定熵过程压缩至相同的体积,试进行相同的计算,并将 图上。 此三过程画在同一p-v图上和T-s图上。 解:(1)多变过程 :(1 对于氮气有 Rg = 0.297 kJ (kg ⋅ K)
ds =
δ qre
T
T2 T1
=
du + pdv cV dT + pdv p / T = Rg / v dT dv = ds = cV → + Rg T T T v
∆s = ∫ cV
v dT + R g ln 2 T v1
∆s = cV ln
T2 v + R g ln 2 T1 v1
∆s = ∫ c p
第二节
理想气体的热力性质和热力过程
一、理想气体及其状态方程 1、状态方程: 称为克拉贝龙状态方程。 pv = Rg T 称为克拉贝龙状态方程。 理想气体定义:凡是遵循克拉贝龙状态方程的气体称为理想气体。 理想气体定义:凡是遵循克拉贝龙状态方程的气体称为理想气体。 从微观上讲,凡符合下述假设的气体称为理想气体: 从微观上讲,凡符合下述假设的气体称为理想气体: 气体分子是不占据体积的弹性质点; (1)气体分子是不占据体积的弹性质点; 气体分子相互之间没有任何作用力。 (2)气体分子相互之间没有任何作用力。
第4章-理想气体的热力性质和热力过程

m
pRgVT1w
1
Ts
0.098MPa36m3 0.28[7kJ/(kgK)]
2
1 73K
1 308K
5.117kg
9
第二节 理想气体的比热容
10
• 热容:指工质温度升高1K所需的热量。
C Q dT
• 比热容:1kg(单位质量)工质温度升高1K所
k
nn1n2n3 ni nk ni i 1
• 第 i 种组元气体的摩尔分数 (mole fraction of a mixture):
xi
ni n
(433)
xi nni nni 1
各组元摩 尔分数之
和为1
37
换算关系
mnM
mi niMi
• 根据热力学第一定律,任意准静态过程:
q d u p d v d h v d p
u是状态参数: uf(T,v)
du(T u)vdT(uv)Tdv
q( T u)vdT[p( u v)T]dv
单位物量的物质 在定容过程中温 度变化1K时热 力学能的变化值
q u
• 定容: dv0 cv (dT)v (T)v 12
3
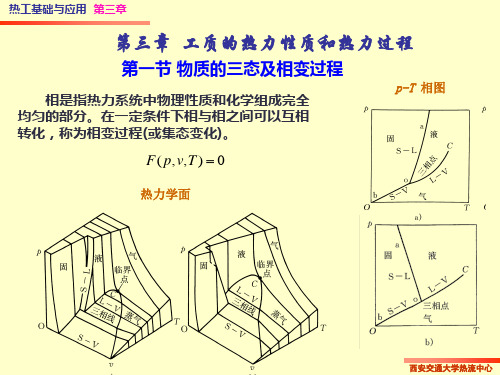
第一节 理想气体及其状态方程
4
• 理想气体 ideal gas定义:
– 遵循克拉贝龙(Clapeyron)状态方程的气体,
即基本状态参数 p、v、T 满足方程
pv 常数 T 的气体称为理想气体。
理想气体的基本假设:
• 分子为不占体积的弹性质点 uu(T)
• 除碰撞外分子间无作用力
理想气体是实际气体在低压高温时的抽象
第三章理想气体的性质与热力过程

3-1 理想气体及其状态方程
一、实际气体与理想气体 1. 理想气体: 是一种假象的气体模型,气体分子是
一些弹性的、不占体积的质点,分子之间没有 相互作用力。
2. 实际气体: 实际气体是真实气体,在工程使用范
围内离液态较近,分子间作用力及分子本身体 积不可忽略,热力性质复杂,工程计算主要靠 图表。如:电厂中的水蒸气、制冷机中的氟里 昂蒸汽、氨蒸汽等。
k cp cv
定容加热与定压加热
15
K为比热容比( 绝热指数)
对于同一物质,比热容是常数?
T 1K
(1)定容比热容
c
(2)定压比热容
q
dT
s
16
三、利用比热容计算热量的方法
实验和理论证明,不同气体的比热容要随温度的变化 而变化,一般情况下,气体的比热容随温度的升高而 升高,表达为多项式形式:
第三章 理想气体的性质
1
本章基本要求
1.掌握理想气体的概念及理想气体状态方程的各种 表达形式,并能熟练运用; 2.理解理想气体比热容的概念及影响因素,掌握理 想气体比热容的分类;能够熟练利用平均比热容 表或定值比热容进行热量的计算; 3.掌握理想气体的热力学能及焓的特点,能够进行 理想气体的热力学能、焓及熵变化量的计算; 4.掌握理想气体的四个基本热力过程(即定容、定 压、定温及绝热过程)的状态参数和能量交换特 点及基本计算,以及上述过程在p-v 图和T-s图上 的表示;
R 8314 Rg 或 R MRg M M
Rm=8314[J/kmol.K],与气体种类和状态无关, 而Rg与气体种类有关,与状态无关。
M 为气体的摩尔质量,单位为(kg/kmol)
例:空气的气体常数为
04理想气体的性质

用全微分来代 替偏微分,去 掉下标
du cV = dT
dh cp = dT
理想气体的cV 和cp也都只是温度的函数 小结:当温度一定时,理想气体的u, h,cV 和cp都是定值!
du cV = dT dh cp = dT
du = cV dT
dh = c p dT
Δu = u2 − u1 = ∫ cV (T ) dT
实际应用中,常见的气体如空气、氮气、氧 气、氢气、氦气、氩气、一氧化碳等均可视 为理想气体,在应用理想气体状态方程对这 些实际气体进行计算时,误差很小(一般在 1%以内)。 但是,对于火力发电厂装置中采用的水蒸气 或制冷装置中采用的工质氟利昂蒸汽等,不 能视为理想气体,即pv=RgT 不成立,需要借 助状态参数表(chapter9)
小结
⑴ pV = nRT (n mol) 状 ⑵ pV = mR T (m kg) g 态 方 ⑶ pv = R T (1 kg) g 程 dp dV dT dm + = + (变质量系统) ⑷ p V T m
使用状态方程时注意事项: 1、绝对压力 ,Pa 2、热力学温度 , K 3、区分: 比体积v与体积V —— m3/kg, m3 气体常数Rg与通用气体常数R—— J /(kg⋅K), J/(mol ⋅K ) 气体常数Rg与气体种类有关,与状态无关; 通用气体常数R为恒量8.3145 J/(mol ⋅K )
若不加“可逆过程”条件,按吸热量计算—— cV = q = 0
关于cV 和cp的几点说明(5)
“热容”和“比热容”的概念也较为常用 物质在可逆过程中温度升高1 K(或1℃)所吸 收的热量称为热容,单位为J/K,符号为C; 单位质量的物质在可逆过程中温度升高1 K (或1℃)所吸收的热量称为比热容,单位为 J/(K·kg),符号为c
理想气体的热力学性质

理想气体的热力学性质理想气体是热力学中常用的模型,其特点是分子之间几乎没有相互作用力,分子体积可以忽略不计。
在理想气体模型中,分子与分子之间以及分子与容器壁之间仅存在完全弹性碰撞。
本文将探讨理想气体的热力学性质,包括理想气体状态方程、内能、焓、熵等。
一、理想气体状态方程理想气体状态方程是描述理想气体状态的基本方程,它表明理想气体的物理性质与其温度、压力和摩尔数有关。
理想气体状态方程可以表示为:PV = nRT其中,P表示气体的压力,V表示气体的体积,n表示气体的物质的量,R为气体常数,T为气体的温度。
根据理想气体状态方程可以得出以下几点关于理想气体热力学性质的结论:1. 对于一定物质的量和温度下的理想气体,其压力与体积成反比,即在温度不变的情况下,当压力增加时,体积减小;反之,当压力减小时,体积增加。
2. 在一定压力和温度下的理想气体,其体积与摩尔数成正比,即在压力和温度不变的情况下,当摩尔数增加时,体积增加;反之,当摩尔数减小时,体积减小。
3. 在一定摩尔数和温度下的理想气体,其体积与绝对温度成正比,即在摩尔数和压力不变的情况下,当温度增加时,体积增加;反之,当温度减小时,体积减小。
以上是理想气体状态方程与理想气体热力学性质的基本关系。
二、理想气体的内能理想气体的内能是指气体分子的平均动能和分子间势能之和。
根据统计力学和热力学原理,可以得出理想气体的内能与温度成正比,并与摩尔数无关。
内能可以表示为:U = 3/2nRT其中,U表示理想气体的内能,n表示气体的物质的量,R为气体常数,T为气体的温度。
三、理想气体的焓理想气体的焓是指在气体过程中,单位物质的量气体所吸收或放出的热量。
对于理想气体而言,其焓与温度成正比,并与压力和体积有关。
焓可以表示为:H = U + PV其中,H表示理想气体的焓,U表示理想气体的内能,P表示气体的压力,V表示气体的体积。
四、理想气体的熵理想气体的熵是指单位物质的量气体在某一过程中所发生的无序程度的度量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析:热力学第一定律微分方程式 闭口系统: 热力学能的全微分方程: 则定容过程:
q du pdv
u u du ( )dT ( )dv v T T v
u qv ( )dT v T 比定容热容: c qV u ) ( V v dT T
开口系统 焓的全微分方程
2、理想气体状态方程 理想气体状态方程又称为克拉贝龙方程,其基本方程式为: pv= RgT 式中: p─气体的绝对压力,Pa; v─气体的比容,m3/kg; T─气体的热力学温度,K; Rg ─气体常数,J/(kg·K)。数值大小只与气体的种类有关, 与气体的状态无关。 对于mkg气体的系统,其状态方程是: mpv=pV =mRgT 用物质的量摩尔(mol)表示时,1 kmol的物质的量为Mkg。 pVm= M Rg T 令R = MRg,则 pVm= R T
p1V1 9.81104 4 m1 4.67kg RgT1 287 293
p2V2 0.475104 4 m1 0.226kg RgT2 287 293
所以:Δm=m1-m2 =4.67-0.226=4.44 kg
3-2 理想气体的热容、热力学能 、焓和熵
1、热容的定义 定义:物体温度升高1K(1 ℃ )所需要的热量,称热容量。 热容的大小取决于工质的性质、物量、过程。计算式: C = δQ/dT = δQ/dt 分类:1)按单位物量分类 比热容(质量热容):1kg物质的热容量。符号c, c=δq/dT = δq/dt J/(kg· K)或kJ/(kg· K) 摩尔热容:1摩尔物质的热容,符号Cm。 Cm =M c 2)按过程分类 比定容热容:定容过程的热容量。cv= δqv/dT 比定压热容:定压过程的热容量。cp= δqp/dT
比热容比:指cp与cv的比。用符号γ表示。 γ = cp / cv 可得: cp= γRg/( γ-1) cv= Rg/( γ-1)
例题:理想气体的比热容比γ =1.40,比定压热容cp =1.042 kJ/(kg· ,求该气体的摩尔质量。 K) 解;由迈耶公式: Rg = cp – cv= cp - cp / γ =1.042-1.042/1.4= 298 J/(kg· K) M=R/ Rg =8.3145/298 27.9 (g/mol)
式中:Vm—千摩尔体积, R─摩尔气体常数J/(mol·K)。 由阿佛加得罗定律推论得到:在相同压力和温度下,1kmol 的各种理想气体占有相同的容积。因此所有气体的R都相 等,且与状态无关。 在 物 理 标 准 状 态 下 , p0=760mmHg=101325Pa、t0=0℃ 时 , Vm0=22.4Nm3,利用理想气体状态方程式: R=(p0 Vm0)/T0 =8.314 J/(mol·K) 已知通用气体常数及气体的分子量可求得气体常数: Rg= R/M
例题:一体积为4m3的容器内充有p=9.81×104Pa, t=20 ℃ 的空气,抽气后容器的真空度pv=700mmHg,当地大气压 pb=735.6mmHg。若抽气前后温度保持不变,求: (1)抽气后容器内空气的绝对压力为多少(bar)? (2)必须抽走多少空气才能满足题目的要求(kg)?
解:用1、2分别表示抽气前后的状态。 (1)抽气后的压力: pb = pb - pv = ( 735.6-700 )mmHg=35.6mmHg=0.0475bar (2)设抽走的气体质量为Δ12 c |tt12 t2 t1 t2 t1
t2
热量
q12 c |tt12(t2 t1) c |t02 t2 c |t01 t1
从表上查得相应得数值,可以进行计算。 定值比热容:原子数目相同的气体具有相同的摩尔热容。 热量计算:q =c(t2-t1)
q dh vdp
定压过程 比定压热容
h u dh ( )dT ( )dp p T T p h q p ( )dT p T q p h cp ( ) p dT T
2、理想气体的比热容 (1)比定压热容与比定容热容 理想气体的内能和焓都只是温度的单值函数。所以: 比定压热容 cp= dh/dT 比定容热容 cv= du/dT 比定压热容与比定容热容的关系 cp= dh/dT =d(u+pv)/dT=du/dT +d(RgT)/dT = cv+Rg 即 cp – cv=Rg 此公式称为迈耶公式。 由此可见;气体的比定压热容大于比定容热容。 原因分析:定容过程 定压过程
第四节 理想气体的性质与热力过程
1 理想气体状态方程
1、理想气体与实际气体 气体是热力过程中常用的工质,如:空气、水蒸气等。 理想气体:1)分子之间的平均距离很大 2)分子之间无作用力,分子之间的碰撞以及分 子与器壁之间的碰撞皆为弹性碰撞。 适用条件:气体的压力不太高,温度不太低,分子之间 的作用力与分子本身的体积皆可忽略时。如:O2、 N2、H2、CO及大气中含有的少量水蒸汽。 实际气体:不符和上述条件的气体,如:水蒸汽,制冷剂 蒸汽等。
(2)热量计算 由比热容的定义可以求的热量的计算公式: δq= c dt 则过程热量 q=∫ δq= ∫ c dT 比热容的确定方法: 真实比热容:真实的反映比热容与温度的关系。如: cp=a0+a1T+a2T2+ a3T3 定压过程热量 q= ∫ cpdT= ∫ (a0+a1T+a2T2+ a3T3 )dT 这样的计算非常复杂。 平均比热容:气体从温度t1升高到t2需要的热量与温差的 c |tt12 商。用 表示。 则
