碳酸钠和碳酸氢钠的性质 实验报告
碳酸钠和碳酸氢钠

俗称
类别 同温度下的溶解度 同浓度溶液的酸碱性 热稳定性 与同浓度酸反应速率 与CaCl2溶液的反应
与CO2反应
NaHCO 固体 Na2CO33受热不分解,NaHCO3受热易分解
装置 Na2CO3固体 △ 化学方程式:2NaHCO3 Na2CO3+H2O+CO2↑ 结论
A B 澄清石灰水
思考题:你知道几种可以区别Na2CO3和NaHCO3的 方法?并指出现象?
① 加热 ②滴入CaCl2 或BaCl2溶液 ③逐滴滴入 稀盐酸
CO32-+2H+ 与稀HCl反应的速率 H2O+CO2↑ 结论:NaHCO
装置
3
HCO3-+H+ 与HCl反应的速率快 比Na2CO3 H2O+CO2↑ A B
结论
探究实验三
分别向Na2CO3和NaHCO3溶液中滴加稀盐酸
现象
Na2CO3
开始无明显现象,后有气泡冒出
NaHCO3
有大量气泡冒出
结论
Na2CO3与稀HCl反应是分步进行的: Na2CO3+HCl= NaCl+NaHCO3 NaHCO3+HCl =NaCl+H2O+CO2↑ 可用此反应鉴别Na2CO3和稀盐酸
探究实验四
Na2CO3和NaHCO3的热稳定性 Na2CO3 NaHCO3
操作 取等量的碳酸钠和碳酸氢钠(约1g)分别置 和现 于两支试管,同时加热,烧杯A和烧杯B的现 象(内装有澄清石灰水)。 象 现象: . 烧杯A无变化,烧杯B中溶液变浑浊
碳酸氢钠的化学性质

实验现象
实 两支试管都生成了白色 验1 沉淀 实 碳酸钠溶液先无现象, 验2 后有大量气泡产生 而碳酸氢钠溶液马上有 气泡产生,比碳酸钠 的 反应剧烈 实 pH值都大于7,且碳酸 验3 钠溶液的pH值更大 实 铜片上的油污褪去 验4
解释与说明
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Na2CO3+CaCl2=CaCO3 ↓+2NaCl
【实验3】演示碳酸氢钠受热
碳酸 氢钠
澄清石灰水
3、碳酸钠与碳酸氢钠的转化
现象:澄清石灰水变浑浊,试管内壁有水珠. 2NaHCO3==Na2CO3+H2O+CO2 ↑ 说明:碳酸氢钠受热易分解成碳酸钠,水和 二氧化碳。碳酸氢钠受热转化为碳酸钠,同 时说明了碳酸纳的热稳定性大于碳酸氢钠。 同时,碳酸钠也可以转化为碳酸氢钠 Na2CO3+H2O+CO2= 2NaHCO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
溶液都显碱性,但碳酸钠的碱性 大于同浓度的碳酸氢钠 碳酸钠具有去污的作用
归纳:
二、碳酸钠的化学性质 1、与碱(与Ca(OH)2,Ba(OH)2)反应生成新盐和新碱: Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH 2、与盐(含Ca2+,Ba2+的盐)反应生成2种新盐: Na2CO3+CaCl2=CaCO3 ↓+2NaCl 3、与酸(盐酸,硫酸,硝酸等)反应生成新盐和新酸: Na2CO3+2HCl=2NaCl+H2O+CO2↑ 4、碳酸钠的水溶液都显碱性,能除油污。
化学碳酸钠与碳酸氢钠

2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分 别跟过量稀盐酸反应,下列说法中正确的是( ②⑥ ) ①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多 ③Na2CO3放出CO2多 ④NaHCO3放出CO2多 ⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快
2NaHCO3= Na2CO3+H2O+CO2
HCO3-+H+=H2O+CO2↑ NaHCO3+NaOH=Na2CO3+H2O
反应速率:Na2CO3<NaHCO3 Na2CO3+NaOH 不反应
Na2CO3+Ca(OH)2=CaCO3↓ +2NaOH
NaHCO3+Ca(OH)2=CaCO3↓ +NaOH+H2O
注意:在水溶液中HCO3—不能与H+ 大量共存也不能与OH—大量共存
二、化学性质
3、与盐反应
Na2CO3+CaCl2=CaCO3 +2NaCl CO32-+Ca2+=CaCO3 与可溶性的钙盐、钡盐反应生成沉淀
Na2CO3
NaHCO3
可与NaHSO4反应
二、化学性质
4、热稳定性
问题3:如果要同时判断碳酸钠和碳酸氢钠的稳定性强弱,请 问如何设计一整套实验装置进行验证?
问题4:为什么与小试管连接的烧杯中的溶 液由无色变浑浊,最后又变澄清?试用化学 方程式解释其原因。
CO2+Ca(OH)2=CaCO3 +H2O CaCO3 + CO2 + H2O= Ca(HCO3)2
问题5:碳酸钠与碳酸氢钠在什么条件下可 以相互转化。
最新碳酸钠和碳酸氢钠性质探究实验
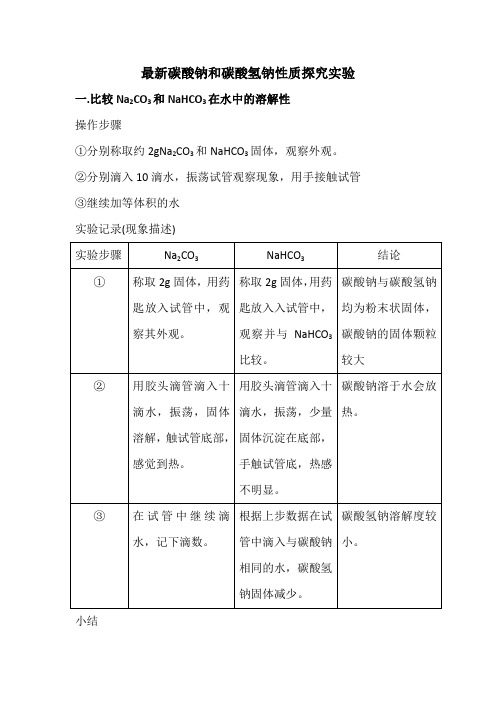
实验记录
实验步骤
Na2CO3
NaHCO3
结论
①
当提起球时,球中固体落入试管中,马上发生反应。
当提起球时,球中固体落入试管中,马上发生反应。
碳酸钠与碳酸氢钠能与盐酸反应
②
反应激烈,放出气体,气球胀大。
反应更激烈,放出气体,气球胀大。
碳酸氢钠与盐酸的反应比碳酸钠与盐酸激烈。
③
将气球中的气体通入澄清石灰水。
将气球中的气体通入澄清石灰水。
澄清石灰水变浑浊。
小结
①碳酸钠与碳酸氢钠能与盐酸反应。
②碳酸氢钠与盐酸的反应比碳酸钠的反应激烈。
称取2g固体,用药匙放入入试管中,观察并与NaHCO3比较。
碳酸钠与碳酸氢钠均为粉末状固体,碳酸钠的固体颗粒较大
②
用胶头滴管滴入十滴水,振荡,固体溶解,触试管底部,感觉到热。
用胶头滴管滴入十滴水,振荡,少量固体沉淀在底部,手触试管底,热感不明显。
碳酸钠溶于水会放热。
③
在试管中继续滴水,记下滴数。
根据上步数据在试管中滴入与碳酸钠相同的水,碳酸氢钠固体减少。
最新碳酸钠和碳酸氢钠性质探究实验
一.比较Na2CO3和NaHCO3在水中的溶解性
操作步骤
①分别称取约2gNa2CO3和NaHCO3固体,观察外观。
②分别滴入10滴水,振荡试管观察现象,用手接触试管
③继续加等体积的水
实验记录(现象描述)
实验步骤
Na2CO3
NaHCO3
结论
①
称取2g固体,用药匙放入试管中,观察其外观。
碳酸氢钠溶解度较小。
小结
①碳酸钠与碳酸氢钠均为粉末状固体,碳酸钠的固体颗粒较大
②碳酸钠与碳酸氢钠都能溶于水,碳酸钠溶于水会放出热量,而碳酸氢钠则不明显。
纯碱的性质实验报告(3篇)

第1篇一、实验目的1. 探究纯碱(碳酸钠)的化学性质。
2. 了解纯碱在酸碱反应、沉淀反应和气体生成反应中的表现。
3. 熟悉实验操作技能,提高实验观察和分析能力。
二、实验原理纯碱(碳酸钠,Na2CO3)是一种可溶性碱,具有以下性质:1. 与酸反应生成盐、水和二氧化碳气体。
2. 与某些金属离子反应生成沉淀。
3. 与强酸反应时,溶液的pH值会发生变化。
三、实验用品1. 纯碱(Na2CO3)固体2. 稀盐酸(HCl)3. 硫酸铜溶液(CuSO4)4. 氢氧化钠溶液(NaOH)5. 氯化钡溶液(BaCl2)6. 无色酚酞试液7. 试管、烧杯、滴管、玻璃棒、滤纸等四、实验步骤1. 取少量纯碱固体放入试管中,加入少量水溶解,观察溶解情况。
2. 向溶解后的纯碱溶液中滴加几滴酚酞试液,观察溶液颜色变化。
3. 分别向溶解后的纯碱溶液中加入稀盐酸、硫酸铜溶液、氢氧化钠溶液、氯化钡溶液,观察反应现象。
4. 记录实验现象,分析反应原理。
五、实验现象与结论1. 纯碱固体易溶于水,溶解后溶液呈碱性,酚酞试液变红。
2. 向溶解后的纯碱溶液中加入稀盐酸,产生气泡,说明纯碱与酸反应生成二氧化碳气体。
反应方程式:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑3. 向溶解后的纯碱溶液中加入硫酸铜溶液,无明显现象。
4. 向溶解后的纯碱溶液中加入氢氧化钠溶液,无明显现象。
5. 向溶解后的纯碱溶液中加入氯化钡溶液,产生白色沉淀,说明纯碱与钡离子反应生成碳酸钡沉淀。
反应方程式:Na2CO3 + BaCl2 → 2NaCl + BaCO3↓六、实验讨论与分析1. 实验结果表明,纯碱与酸反应时会产生二氧化碳气体,这是纯碱的典型性质之一。
2. 纯碱与硫酸铜溶液、氢氧化钠溶液、氯化钡溶液反应时,没有明显的现象,说明纯碱与这些物质在常温下不发生反应。
3. 实验过程中,观察到酚酞试液在纯碱溶液中变红,说明纯碱溶液呈碱性。
七、实验总结通过本次实验,我们了解了纯碱的化学性质,包括与酸反应、沉淀反应和气体生成反应。
碳酸钠和碳酸氢钠的性质实验报告

碳酸钠和碳酸氢钠的性质实验报告实验报告:碳酸钠和碳酸氢钠的性质一、实验目的:1.了解碳酸钠和碳酸氢钠的化学性质;2.学习通过实验方法鉴别碳酸钠和碳酸氢钠。
二、实验原理:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为碱性物质,广泛应用于化学实验和工业生产中。
碳酸钠是白色结晶粉末,易溶于水,在潮湿空气中吸湿;碳酸氢钠也为白色结晶粉末,溶于水,但不易溶于醇类。
本实验通过一系列的实验操作和分析,来鉴别这两种碱性物质。
三、实验步骤:1.鉴别外观:将碳酸钠和碳酸氢钠分别放在两个干燥的试管中,观察外观。
发现两种物质外观相似,都为白色结晶粉末。
2.鉴别溶解性:取两个试管分别加入少量蒸馏水,并用玻璃棒搅拌溶解。
发现碳酸钠完全溶解,而碳酸氢钠溶解度较差,部分悬浮在水中。
3.鉴别酸碱性:将两个试管中分别加入几滴酚酞指示剂。
观察到碳酸钠试管中液体变为橙红色,而碳酸氢钠试管中液体仍为无色。
4.鉴别热分解性:将碳酸钠和碳酸氢钠分别放在干燥的坩埚中,放入烧杯中,使用酒精灯进行加热。
观察到碳酸钠在加热过程中失去结晶水,呈现白色粉末,同时有气泡的产生;碳酸氢钠在加热过程中,产生有臭酸(二氧化碳)气体,同时有气泡的产生。
5.鉴别与酸反应性:将两种试剂单独放入两个试管中,分别加入稀盐酸。
观察到碳酸钠试管中有大量气泡产生,呈现剧烈的反应,而碳酸氢钠试管中气泡较少。
反应后,将两个试管中产生的气体分别用湿润的蓝色红石蕊试纸接触,观察到碳酸钠试管中红石蕊试纸变蓝,而碳酸氢钠试管中无明显变化。
四、实验结果和结论:通过一系列的实验操作和观察,我们得到以下结论:1.碳酸钠和碳酸氢钠在外观上相似,都为白色结晶粉末;2.碳酸钠在水中完全溶解,而碳酸氢钠溶解度较差;3.碳酸钠为碱性物质,碳酸氢钠为中性物质;4.碳酸钠和碳酸氢钠在加热过程中有不同的反应:碳酸钠失水变为白色粉末,碳酸氢钠分解产生臭酸气体;5.碳酸钠与稀盐酸有剧烈的反应,产生大量气泡,而碳酸氢钠反应较为缓慢。
碳酸钠与碳酸氢钠的性质实验.doc

碳酸钠与碳酸氢钠的性质实验实验原理:碳酸钠、碳酸氢钠分别与强酸或强碱的反应;碳酸钠、碳酸氢钠溶液的弱碱性;碳酸氢钠的不稳定性。
实验(1):碳酸钠、碳酸氢钠分别与盐酸反应实验操作:各取少量碳酸钠、碳酸氢钠固体于两试管中,分别滴入盐酸,观察实验现象。
各取饱和碳酸钠溶液、碳酸氢钠溶液5mL放入两根试管中,分别向其中逐滴慢慢地加入0.05mol/L的稀盐酸溶液,观察反应现象。
实验现象及结论:碳酸钠、碳酸氢钠固体加入盐酸均产生无色气体,碳酸氢钠遇到盐酸放出气体比碳酸钠剧烈得多。
饱和碳酸钠溶液、碳酸氢钠溶液逐滴滴入盐酸,碳酸氢钠溶液就有气体生成,饱和碳酸钠溶液先无现象后生成气体。
说明碳酸钠、碳酸氢钠都能与盐酸等酸反应产生CO2气体。
碳酸氢钠与盐酸反应放出CO2比碳酸钠与盐酸反应放出快,是因为加入盐酸后,HCO3-直接与H+结合生成不稳定的H2CO3分解生成CO2。
而碳酸钠溶液中存在大量CO32-,加入盐酸后,CO32-先与H+结合生成HCO3-,再与H+结合才能生成H2CO3,所以放出CO2速度慢。
Na2CO3+2HCl==2NaCl+CO2↑+H2O;NaHCO3+HCl==NaCl+CO2↑+H2O;Na2CO3+HCl==NaHCO3+NaCl;NaHCO3+HCl==NaCl+CO2↑+H2O实验(2):碳酸钠、碳酸氢钠溶液分别与澄清石灰水反应实验操作:在两支试管中分别加入2-3mL澄清石灰水,分别向其中加入少量的碳酸钠溶液、碳酸氢钠溶液,观察实验现象。
实验现象及结论:两支试管中均有白色沉淀生成。
说明碳酸钠、碳酸氢钠都能与氢氧化钙等碱反应。
Na2CO3+Ca(OH)2==2NaOH+CaCO3↓;NaHCO3+Ca(OH)2==NaOH+CaCO3↓+H2O实验(3):碳酸钠、碳酸氢钠溶液分别测pH实验操作:分别测量0.1mol/L的碳酸钠溶液、碳酸氢钠溶液的pH,比较其大小。
实验现象及结论:碳酸钠溶液、碳酸氢钠溶液的pH均大于7,且碳酸钠溶液的pH大于碳酸氢钠溶液的pH。
碳酸钠和碳酸氢钠的性质 实验报告
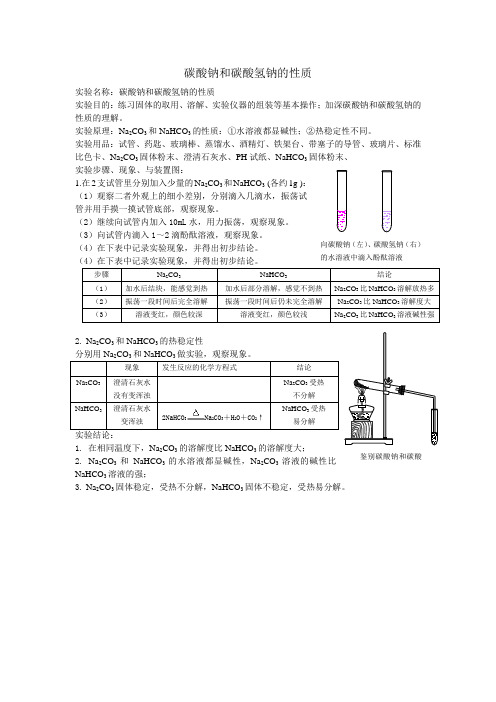
碳酸钠和碳酸氢钠的性质实验名称:碳酸钠和碳酸氢钠的性质实验目的:练习固体的取用、溶解、实验仪器的组装等基本操作;加深碳酸钠和碳酸氢钠的 性质的理解。
实验原理:Na 2CO 3和NaHCO 3的性质:①水溶液都显碱性;②热稳定性不同。
实验用品:试管、药匙、玻璃棒、蒸馏水、酒精灯、铁架台、带塞子的导管、玻璃片、标准比色卡、Na 2CO 3固体粉末、澄清石灰水、PH 试纸、NaHCO 3固体粉末、 实验步骤、现象、与装置图:1.在2支试管里分别加入少量的Na 2CO 3和NaHCO 3 (各约1g ): (1)观察二者外观上的细小差别,分别滴入几滴水,振荡试管并用手摸一摸试管底部,观察现象。
(2)继续向试管内加入10mL 水,用力振荡,观察现象。
(3)向试管内滴入1~2滴酚酞溶液,观察现象。
(4)在下表中记录实验现象,并得出初步结论。
(4)在下表中记录实验现象,并得出初步结论。
步骤 Na 2CO 3NaHCO 3结论(1) 加水后结块,能感觉到热 加水后部分溶解,感觉不到热 Na 2CO 3比NaHCO 3溶解放热多 (2) 振荡一段时间后完全溶解 振荡一段时间后仍未完全溶解Na 2CO 3比NaHCO 3溶解度大 (3)溶液变红,颜色较深溶液变红,颜色较浅Na 2CO 3比NaHCO 3溶液碱性强2. Na 2CO 3和NaHCO 3的热稳定性现象 发生反应的化学方程式结论 Na 2CO 3澄清石灰水没有变浑浊Na 2CO 3受热 不分解 NaHCO 3 澄清石灰水变浑浊2NaHCO 3Na 2CO 3+H 2O +CO 2↑NaHCO 3受热 易分解实验结论:1. 在相同温度下,Na 2CO 3的溶解度比NaHCO 3的溶解度大;2. Na 2CO 3和NaHCO 3的水溶液都显碱性,Na 2CO 3溶液的碱性比NaHCO 3溶液的强;3. Na 2CO 3固体稳定,受热不分解,NaHCO 3固体不稳定,受热易分解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸钠和碳酸氢钠的性质
实验名称:碳酸钠和碳酸氢钠的性质
实验目的:练习固体的取用、溶解、实验仪器的组装等基本操作;加深碳酸钠和碳酸氢钠的 性质的理解。
实验原理:Na 2CO 3和NaHCO 3的性质:①水溶液都显碱性;②热稳定性不同。
实验用品:试管、药匙、玻璃棒、蒸馏水、酒精灯、铁架台、带塞子的导管、玻璃片、标准比色卡、Na 2CO 3固体粉末、澄清石灰水、PH 试纸、NaHCO 3固体粉末、 实验步骤、现象、与装置图:
1.在2支试管里分别加入少量的Na 2CO 3和NaHCO 3 (各约1g ): (1)观察二者外观上的细小差别,分别滴入几滴水,振荡试管并用手摸一摸试管底部,观察现象。
(2)继续向试管内加入10mL 水,用力振荡,观察现象。
(3)向试管内滴入1~2滴酚酞溶液,观察现象。
(4)在下表中记录实验现象,并得出初步结论。
(4)在下表中记录实验现象,并得出初步结论。
步骤 Na 2CO 3
NaHCO 3
结论
(1) 加水后结块,能感觉到热 加水后部分溶解,感觉不到热 Na 2CO 3比NaHCO 3溶解放热多 (2) 振荡一段时间后完全溶解 振荡一段时间后仍未完全溶解
Na 2CO 3比NaHCO 3溶解度大 (3)
溶液变红,颜色较深
溶液变红,颜色较浅
Na 2CO 3比NaHCO 3溶液碱性强
2. Na 2CO 3和NaHCO 3的热稳定性
现象 发生反应的化学方程式
结论 Na 2CO 3
澄清石灰水没有变浑浊
Na 2CO 3受热 不分解 NaHCO 3 澄清石灰水
变浑浊
2NaHCO 3
Na 2CO 3+H 2O +CO 2↑
NaHCO 3受热 易分解
实验结论:
1. 在相同温度下,Na 2CO 3的溶解度比NaHCO 3的溶解度大;
2. Na 2CO 3和NaHCO 3的水溶液都显碱性,Na 2CO 3溶液的碱性比NaHCO 3溶液的强;
3. Na 2CO 3固体稳定,受热不分解,NaHCO 3固体不稳定,受热易分解。
向碳酸钠(左)、碳酸氢钠(右)
的水溶液中滴入酚酞溶液
鉴别碳酸钠和碳酸。
