荧光显微镜检测细胞凋亡
细胞凋亡检测方法
细胞凋亡的检测方法一、细胞凋亡概念:细胞凋亡是指为维持内环境的稳定,有基因控制的细胞自主的程序性死亡。
细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用;它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。
细胞凋亡与胚胎发育、自身免疫耐受、肿瘤发生、病毒感染等生理、病理过程密切相关,近年来一直是生物医学领域各专业的研究热点。
选择合适的凋亡检测方法是研究细胞凋亡研究的关键。
二、细胞凋亡的检测方法:1. 磷酯酰丝氨酸(PS)外翻法(Annexin V 法)在凋亡细胞中,磷酯酰丝氨酸 (PS) 从质膜内侧转移到外侧,暴露在细胞外环境中。
荧光基团或荧光蛋白标记的膜联蛋白V 可与暴露在质膜外侧的PS 结合,用于识别凋亡细胞。
碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核红染。
因此将Annexin-V 与PI 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
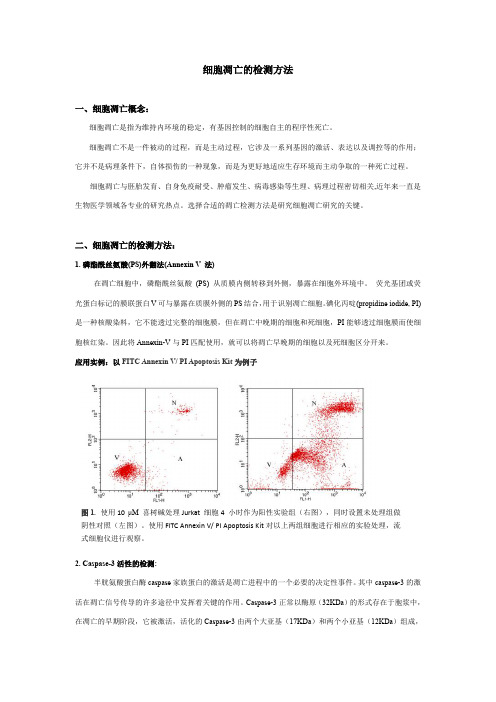
应用实例:以FITC Annexin V/ PI Apoptosis Kit 为例子2. Caspase-3活性的检测:半胱氨酸蛋白酶caspase 家族蛋白的激活是凋亡进程中的一个必要的决定性事件。
其中caspase-3的激活在凋亡信号传导的许多途径中发挥着关键的作用。
Caspase-3正常以酶原(32KDa )的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17KDa )和两个小亚基(12KDa)组成,图1. 使用10 μM 喜树碱处理Jurkat 细胞4 小时作为阳性实验组(右图),同时设置未处理组做阴性对照(左图)。
使用FITC Annexin V/ PI Apoptosis Kit 对以上两组细胞进行相应的实验处理,流式细胞仪进行观察。
细胞凋亡检测方法

细胞凋亡检测方法细胞凋亡是一种重要的细胞死亡方式,它在维持机体内稳态、发育和疾病发生中起着重要作用。
因此,准确、可靠地检测细胞凋亡是细胞生物学和生物医学研究中的重要课题。
本文将介绍几种常用的细胞凋亡检测方法,希望能为相关研究提供一些参考。
首先,细胞凋亡的形态学特征是细胞体积缩小、细胞核浓缩、细胞膜破裂和细胞内出现凋亡小体等。
因此,通过显微镜观察细胞形态变化是最直观的方法之一。
在实验中,可以使用荧光染料(如荧光素酶、荧光素酶底物等)标记细胞核和细胞膜,然后观察细胞形态的改变。
这种方法简单直观,但不够精确,需要结合其他方法进行验证。
其次,细胞凋亡过程中,细胞内的DNA发生断裂和片段化,产生特征性的DNA ladder。
因此,DNA ladder检测是一种常用的细胞凋亡检测方法。
实验中,可以通过DNA提取、电泳等技术,检测细胞内DNA的片段化情况。
这种方法对于凋亡细胞的检测比较准确,但需要较多的细胞样本和专业的实验操作技术。
另外,细胞凋亡过程中,细胞膜上的磷脂会外翻,暴露磷脂酰丝氨酸(PS)在细胞表面。
因此,PS外露检测是一种常用的细胞凋亡检测方法。
实验中,可以使用PS结合蛋白标记或荧光染料标记PS,然后通过流式细胞术或显微镜观察PS的表达情况。
这种方法对于凋亡细胞的检测比较灵敏,但需要较为昂贵的试剂和设备。
最后,细胞凋亡过程中,细胞内的一些蛋白酶活性会发生改变,如半胱氨酸蛋白酶(caspase)的活化。
因此,caspase活性检测是一种常用的细胞凋亡检测方法。
实验中,可以使用荧光染料标记caspase活性底物,然后通过荧光显微镜或流式细胞仪检测caspase的活化情况。
这种方法可以直接反映细胞内凋亡信号通路的活性,但需要较为复杂的实验操作和数据分析。
综上所述,细胞凋亡的检测方法多种多样,各有优缺点。
在实际研究中,可以根据具体的研究目的和条件选择合适的方法进行细胞凋亡检测。
希望本文介绍的方法能够为相关研究提供一些帮助,推动细胞凋亡机制的深入研究,为疾病的防治提供新的思路和方法。
细胞凋亡的几种检测方法

细胞凋亡的几种检测方法Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】细胞凋亡的几种检测方法1、形态学观察方法(1)HE(苏木精—伊红染色法)染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
(2)丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(3)台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
(4)透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
2、 DNA凝胶电泳细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带3、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体’3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’4、加酶的底物,测光吸收制。
用途该法敏感性高,可检测5*100/ml个凋亡细胞。
简述细胞凋亡的检测方法

简述细胞凋亡的检测方法
下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!
Download Tip: This document has been carefully written by the editor. I hope that after you download, they can help you solve practical problems. After downloading, the document can be customized and modified. Please adjust and use it according to actual needs. Thank you!
细胞凋亡检测方法简述如下:
①形态学检测:利用光学显微镜、荧光显微镜乃至透射电子显微镜观察细胞形态变化,如细胞收缩、核染色质浓缩等。
②Annexin V标记:利用Annexin V与磷脂酰丝氨酸特异性结合的特性,荧光标记的Annexin V可检测早期凋亡细胞膜外翻的磷脂酰丝氨酸,结合PI可区分早晚期凋亡与坏死细胞。
③TUNEL染色法:检测细胞DNA断裂情况,通过标记末端脱氧核苷酸转移酶介导的DNA缺口,荧光显微镜下观察凋亡细胞的DNA片段化。
④Hoechst染色:使用荧光染料如Hoechst 33342染色细胞核,观察凋亡细胞核形态的改变,如浓缩、碎裂。
⑤DNA Ladder电泳:提取细胞DNA进行凝胶电泳,凋亡细胞DNA呈现特征性的梯状条带,反映DNA在核小体间的特定位置断裂。
AOEB双荧光染色法检测细胞凋亡

AOEB双荧光染⾊法检测细胞凋亡悬浮细胞AO/EB双染步骤
1.调整细胞密度为106/ml,将细胞种⾄6孔板,每孔2ml细胞;
2.向每孔加⼊相应浓度药物,培养⾄不同时间点;
3. 1000转/min离⼼10min收集细胞,PBS洗涤1次;
4. PBS重悬细胞,使悬浮细胞浓度达106/L左右;
5.取100µl受检细胞悬液,各加5µl AO和EB;
6.取上述染⾊液⼀滴,滴在洁净玻⽚上,加盖玻⽚后⽴即置荧光显微镜下观察。
注:
1. AO/EB染料配制:精确称取AO(Fluka产品)、EB(Fluka产品 )各1mg,分别溶于10ml pH7.2 PBS中,使之配
成100µg/ml的储备液, 4℃保存,⽤前等量混合;
2.可以省略上述步骤3、4,以避免离⼼造成细胞物理性损伤,直接取细胞悬液加AO/EB孵育观察;
3. AO/EB有毒,可致癌,注意保护;
4.上述⽅法只适⽤于悬浮细胞,如果是贴壁细胞,可以考虑爬⽚,或者在培养板中直接染⾊,或者⽤胰酶消化后,按悬浮
细胞⽅法操作;
5. AO/EB虽然可以初步计算凋亡率,但是过于主观,最好采⽤Annexin V FITC/PI双标法进⾏定量;
6. Annexin V FITC/PI双标法对于早期凋亡⽐较敏感,因此可以先通过AO/EB形态学⽅法,摸索药物⼲预后开始出现凋亡的
时间,以确定合适的药物⼲预时间,进⾏Annexin V标记。
细胞凋亡的形态学检测1

荧光显微镜下检测细胞凋亡作者:2010级生物技术许春燕摘要:细胞凋亡是生命科学目前的一个研究热点.检测细胞凋亡的方法和技术取得了很大的进步.从早期细胞内某些基因转录表达的变化、代谢生理的变化,到晚期细胞形态的确诊、细胞内代谢物质的转变,从定性、定量到原位定性定量等,都发展了相对成熟的检测技术.相比于其他检测方法,荧光染色法检测细胞凋亡具有经济、快速、敏感等特点。
关键词:细胞凋亡荧光显微镜观察法正文:下面是荧光显微镜下检测细胞凋亡的四种方法:1、吖啶橙染色法用吖啶橙溴化乙锭混合染色法。
吖啶橙对DNA有特异的亲和力。
结果判定。
荧光显微镜下,可见到活细胞核染色质呈现均匀分布的黄绿色荧光,胞质呈橘黄色或者橘红色荧光,出现凋亡细胞时,核染色质的黄绿色荧光浓聚在核膜内侧,凋亡细胞核的特征性形态可被清晰地辨认。
坏死细胞的细胞质内黄绿色或者橘黄色荧光减弱,有的甚至消失。
具体方法如下:(1).制备活细胞悬液,浓度约为107/ml。
(2).取95μl的细胞悬液,加5μl的吖啶橙贮存液混匀。
(3).吸一滴混合液点洁净玻片上,直接用盖玻片封片。
(4).荧光显微镜选用激发滤片BG 12或BV等,阻断滤片用515nm 或。
对体外培养的活细胞经荧光素处理后,可在荧光显微镜下直接观察细胞形态的改变.结果;用吖啶橙染色后正常细胞核DNA呈黄色或黄绿色的均匀荧光,细胞质和核仁的RNA呈桔黄或桔红色荧光;凋亡细胞的细胞核或细胞质内有致密浓染的黄绿色荧光,甚至有黄绿色碎片;坏死细胞的细胞质内的荧光较弱或无。
2、Hoechst33258染色法Hoechst33258能够穿过完整的细胞膜,所以可以用来染活细胞,在活细胞中DNA聚AT序列富集区域的小沟处与DNA结合。
在荧光显微镜紫外光激发时,Hoechst-DNA发出亮蓝色荧光。
具体方法如下:(1).原代细胞培养,细胞学涂片或细胞甩片机制备的单细胞片。
(2).细胞固定液4℃固定5min。
(3).蒸馏水稍洗后,点加Hoechst33258染色液,10min。
细胞凋亡检测细胞凋亡实验步骤检测方法

细胞凋亡检测,细胞凋亡实验步骤,检测方法一、定性和定量研究只定性的研究方法:常规琼脂糖凝胶电泳、脉冲场倒转琼脂糖凝胶电泳、形态学观察(普通光学显微镜、透射电镜、荧光显微镜)进行定量或半定量的研究方法:各种流式细胞仪方法、原位末端标记法、ELISA 定量琼脂糖凝胶电泳。
二、区分凋亡和坏死可将二者区分开的方法:琼脂糖凝胶电泳,形态学观察(透射电镜是是区分凋亡和坏死最可靠的方法),Hoechst33342/PI双染色法流式细胞仪检测,3) Telemerase Detection (端粒酶检测)3、生化检测:1)典型的生化特征:DNA 片段化2)检测方法主要有:琼脂糖凝胶电泳、原位末端标记(TUNEL)等3)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)4)通过DNA末端转移酶将带标记的dNTP (多为dUTP)间接或直接接到DNA 片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。
可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。
4、LM-PCR Ladder (连接介导的PCR检测)当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。
通过LM-PCR,连上特异性接头,专一性地扩增梯度片段,从而灵敏地检测凋亡时产生梯度片段。
此外,LM-PCR 检测是半定量的,因此相同凋亡程度的不同样品可进行比较。
如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移酶(TdT)使DNA标记,然后进行电泳和放射自显影,观察凋亡细胞中DNA ladder的形成。
上述两种方法都针对细胞凋亡晚期核DNA断裂这一特征,但细胞受到其它损伤(如机械损伤,紫外线等)也会产生这一现象,因此它对细胞凋亡的检测会受到其它原因的干扰。
需结合其它的方法来检测细胞凋亡。
)境,这可能导致了凋亡早期细胞线粒体膜电位的降低,从而使细胞色素C(三羧酸循环中的重要组分)从线粒体内转移到细胞液中,启动凋亡效应器caspase的级联反应。
常见细胞凋亡检测的方法与注意事项

大家常把细胞凋亡和细胞坏死混淆,其实两者是不同的细胞死亡形式,大家可以在死亡细胞的形态、生化和分子指标上将二者区分开来,细胞凋亡检测的方法不少,这里就总结下几种常用的检测方法。
细胞凋亡检测更多详情,点击查看不可不知的细胞检测方法——MTT
一、细胞凋亡的形态学检测
根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。
参考文献Brown,D.G., Sun, X.M., and Cohen, G.M.(1993) Dexamethasone-induced apoptosis involves cleavage of DNA to large fragments prior to internucleosomal fragmentation. J. Biol.Chem. 268, 3037-3039
线粒体跨膜电位的存在,使一些亲脂性阳离子荧光染料如Rhodamine 123、3,3-Dihexyloxacarbocyanine iodide[DiOC6(3)]、Tetrechloro-tetraethylbenzimidazol carbocyanine iodide[JC-1]、Tetramethyl rhodamine methyl ester(TMRM)等可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。
2贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。
3爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。
结果:
注意事项
1.整个操作动作要尽量轻柔,勿用力吹打细胞。
2.操作时注意避光,反应完毕后尽快在一小时内检测。
三、线粒体膜势能的检测
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验报告五(2015.5.27)
荧光显微镜检测细胞凋亡(Hoechst 33258 染色)
姓名:王亚斌 班级:生物技术12(1) 学号:2012332860026
实验五:荧光显微镜检测细胞凋亡(Hoechst 33258 染色)
一 实验目的:
1 了解荧光显微镜的构造并且学会使用荧光显微镜;
2 通过荧光显微镜学会分析数据图片。
二 实验原理:
Hoechst 33258,分子式为C25H24N6O ·3HCl ,分子量为533.88, 水溶解度可达10mg/ml 。
Hoechst 33258是一种可以穿透细胞膜的蓝色荧光染料,对细胞的毒性较低。
Hoechst 33258为特异性DNA 染料,与 A-T 键结合,这种染料对死细胞或经70%冷乙醇固定的细胞可立即染色。
而活细胞的着色是渐进性的,在10min 内可达饱和。
在荧光显微镜下,活细胞核呈弥散均匀荧光,出现细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒块状荧光。
三 实验器材:
1ml 移液枪及枪头,荧光显微镜,培养贴壁细胞,PBS 缓冲液,Hoechst 33258 染色液 六孔板,培养箱
四 实验步骤和方法:
1:加入适当量Hoechst 33258 染色液,注意必须充分覆盖住待染色样品。
通常六孔板加1ml/孔,96孔板加100μl/孔。
2:放入37°C 培养箱中培养30min 。
3:小心吸去染色液,用1ml PBS 洗涤2-3次。
4 :置于荧光显微镜下,选用340nm 的激发光观察:在荧光显微镜下,活细胞呈弥散均匀荧光,凋亡细胞核或细胞质内可见浓染致密的颗粒块状荧光。
如果见到3个或3个以上的DNA 荧光碎片被认为是凋亡细胞。
五 实验结果
成绩 优秀 良好 中等 及格 不及格
防己诺林碱浓度为0uM 防己诺林碱浓度为2uM
防己诺林碱浓度为2uM防己诺林碱浓度为4uM
防己诺林碱浓度为6uM
防己诺林碱浓度为8uM
防己诺林碱浓度为10uM
在上图可以看出,在防己诺林碱浓度为2um/ml的时候出现了染致密的颗粒块状荧光,也就是说在这个浓度下,细胞开始放生了凋亡,而且,在不断提高防己诺林碱浓度的情况下,视野里的凋亡细胞开始变多了,而且凋亡细胞数目要多于活细胞数目。
六.分析与讨论
在荧光显微镜下,用340nm的激发光观察活细胞呈弥散均匀荧光,凋亡细胞核或细胞质内可见浓染致密的颗粒块状荧光。
如果见到3个或3个以上的DNA荧光碎片被认为是凋亡细胞,图中,随着防己诺林碱浓度的升高,凋亡细胞数目逐渐增多,当浓度在10um/ml 的时候,视野中几乎看不到有活细胞的存在,可以说,在这个浓度下,抑制细胞数目增殖的作用是最强的。
