二理想溶液中各组分的化学势
2.6、2.7化学势与标准态

§ 2-7 溶液中各组分的化学势
一. 稀溶液的两个实验定律
1. 拉乌尔(Raoult)定律 拉乌尔( ) 定律内容: 在一定温度下, 定律内容 在一定温度下 稀溶液中溶剂的蒸气压等于 该温度时纯溶剂的饱和蒸气压与溶液中溶剂 的物质的量分数的乘积 物质的量分数的乘积. 的乘积
m1=0.057g/1kg m2=?
练习题:乙醇水溶液含乙醇的质量分数 含乙醇的质量分数m 练习题:乙醇水溶液含乙醇的质量分数 乙醇=0.03。 。 在97.11℃时溶液的总蒸气压为 ℃时溶液的总蒸气压为101.325kPa,在该温度 在该温度 下纯水的蒸气压为91.326kPa。试计算在该温度下、 下纯水的蒸气压为 。试计算在该温度下、 乙醇的物质的量分数为0.02的溶液上方与其平衡的 乙醇的物质的量分数为 的溶液上方与其平衡的 稀溶液) 乙醇、水的蒸气分压(假设上述溶液为稀溶液 乙醇、水的蒸气分压(假设上述溶液为稀溶液)
△mixS>0 >
理想溶液的混合过程与理想气体的混合过 程相类似,分子的排列从有序到无序 分子的排列从有序到无序,因而 程相类似 分子的排列从有序到无序 因而 是一熵增过程 是一熵增过程
△mixG<0 <
因为在定温定压下的理想溶液混合过程是 一自发过程, 所以此过程的∆ 小于零 小于零. 一自发过程 所以此过程的∆G小于零
练习题: ℃ 纯乙醚的饱和蒸气压为58.95kPa,今在 练习题:20℃时,纯乙醚的饱和蒸气压为 , 0.1000kg的乙醚中加入 的乙醚中加入0.01kg某非挥发性有机物,形成稀溶液 某非挥发性有机物, 的乙醚中加入 某非挥发性有机物 乙醚的蒸气压下降到56.79kPa。求该有机物的摩尔质量。 后,乙醚的蒸气压下降到 。求该有机物的摩尔质量。 思路:稀溶液中溶剂符合 思路:稀溶液中溶剂符合Raoult定律 定律 利用Raoult定律 乙醚= P乙醚*x(乙醚)求出x(乙醚) 利用 定律P (乙醚)求出 (乙醚) 定律
大学物理化学 第三章 多组分系统热力学习指导及习题解答

RT Vm p A Bp
积分区间为 0 到 p,
RT
p
d ln
f=
(p RT
A Bp)dp
0
0p
RT p d ln( f )= (p A Bp)dp Ap 1 Bp2
0
p0
2
因为
lim ln( f ) 0 p0 p
则有
RT ln( f )=Ap 1 Bp2
为两相中物质的量浓度,K 为分配系数。
萃取量
W萃取
=W
1
KV1 KV2 V2
n
二、 疑难解析
1. 证明在很稀的稀溶液中,物质的量分数 xB 、质量摩尔浓度 mB 、物质的量浓度 cB 、质量分数 wB
之间的关系: xB
mBM A
MA
cB
MA MB
wB 。
证明:
xB
nA
nB nB
nB nA
)pdT
-S
l A,m
dT
RT xA
dxA
-S(mg A)dT
-
RT xA
dxA =
S(mg A)-S
l A,m
dT
Δvap Hm (A) T
dT
-
xA 1
dxA = xA
Tb Tb*
Δvap Hm (A) R
dT T2
若温度变化不大, ΔvapHm 可视为常数
- ln
xA =
Δvap Hm (A) R
真实溶液中溶剂的化学势 μA μ*A(T, p) RT ln γx xA =μ*A(T, p) RT ln aA,x
真实溶液中溶质 B μB μB* (T, p) RT ln γx xB =μ*A(T, p) RT ln aB,x
理想稀溶液溶剂和溶质的化学势溶剂

lim x 1
x 1
E
• x, i 为组分 i 对 Raoult 定律的
偏差校正(不论溶质或溶剂)
G RT ni ln x , i
i
E i
RT ln x , i
1、正规溶液
SE = 0
E
将 G RT n i ln i 代入上式:
G S ( ) p 0 T
B = B*+ RT ln a x, B
假想态
亨利定律稀溶液:pB = kmmB
非理想 : pB = kmmB m,B
B = B + RT ln (mBm,B / m)
= B (T, p) + RTln am,B
m am m m
m0
lim m 1
四、超额函数
• 考虑一般的非理想液态混合物
• 衡量实际液态混合物的非理想程度
• 定义为实际非理想液态混合物混合过程 中热力学函数的变化值与理想液态混合 物变化值的差值 • 用XE表示,XE = mixXre mixXid
• 已知:理想溶液
mix V 0
id
mixH 0
id
(iii)渗透压:
RT ln aA = Vm*(A) P
3. 由 Gibbs-Duhem 公式,从溶质 (或溶剂) 的
活度因子求溶剂 (或溶质) 的活度因子 • 二组分T,p一定: xA d A + xB d B = 0
xA d ln aA + xB d ln aB = 0
d ln x , B
mixS R n i ln x i
id
mixG RT n i ln x i
多组分系统热力学(2)
xB
(3.29)
解释:加入的溶质分子占据了原溶剂的位置和减少了单位表
面上溶剂分子的数目,因而也减少了离开液面进入气相的溶
剂分子数目,即减少了溶剂的蒸气压;蒸气压的减少量与溶
质分子占据液面的比率(即xB)成正比。
2
二、亨利定律
溶液热力学
亨利定律:在一定温度和平衡状态下,气体在液体里的溶解度 (用摩尔分数表示)和该气体的平衡分压成正比。
B,m
(T
,
p)
RT
ln
mB m
(3-41)
化学势
B
B* ,m(T ,
p)
RTln
mB mθ
(m =1 mol/kg)
标准态:温度T,浓度m = 1mol/kg,压力为该浓度按亨利定 律推算的蒸气压km时的化学势。 (这是一个假想的标准态)
17
溶液热力学
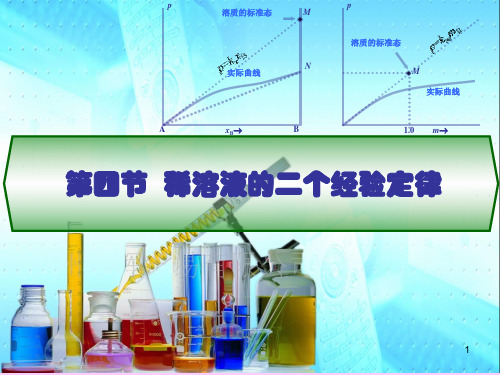
表示式3 pB = kccB (c:mol/L)
p
p
溶质的标准态
M
实际曲线
溶质的标准态
N
M
实际曲线
A
xB
B
1.0 m
第四节 稀溶液的二个经验定律
1
一、拉乌尔定律
溶液热力学
拉乌尔定律:一定温度下,稀溶液溶剂的蒸气压等于纯溶剂的 蒸气压乘以溶液中溶剂的摩尔分数
pAA 1 xB
p*A pA p*A
(3-44)
* B,m
(T
,p)
RT
ln
aB,m
(3-45)
21
B
* B,c
(T
,p)
RT
ln
热力学中的理想溶液的化学势与活度

热力学中的理想溶液的化学势与活度在热力学中,理想溶液是指满足理想混合规律的溶液。
理想溶液具有很多简化的特点,比如组分之间没有相互作用、溶液的体积等于组分的体积之和、理想溶液中的溶质呈现无限稀释的状态等。
在研究理想溶液时,化学势和活度是两个重要的概念。
一、理想溶液的化学势在热力学中,化学势是描述物质在不同条件下的稳定性和运动特性的物理量。
对于理想溶液而言,化学势可以通过混合各组分的化学势来计算。
以二元理想溶液为例,其中溶质1的化学势为μ1,溶质2的化学势为μ2。
根据理想溶液的特性,我们可以得出以下关系式:μ1 = μ1^0 + RT ln(a1)μ2 = μ2^0 + RT ln(a2)其中μ1^0和μ2^0为溶质1和溶质2在标准状态下的化学势,a1和a2分别是溶质1和溶质2的活度。
活度是描述溶液中分子或离子浓度与标准状态下理想溶液浓度之比的无量纲量。
根据以上关系式,我们可以得出理想溶液中溶质1和溶质2的化学势与活度之间的关系。
通过计算化学势的差值,可以得到相应的反应热和平衡常数,从而研究溶液的稳定性和反应动力学特性。
二、理想溶液的活度在理想溶液中,活度可以通过溶液中的分子浓度与标准状态下的浓度之比来计算。
对于二元理想溶液而言,活度可以表示为以下形式:a1 = γ1 * x1a2 = γ2 * x2其中γ1和γ2分别是溶质1和溶质2的活度系数,x1和x2分别是溶质1和溶质2的摩尔分数。
活度系数是考虑到溶液中溶质间相互作用的修正项,它影响着溶质在溶液中的浓度和化学势。
对于理想溶液而言,活度系数为1,即溶质间不存在相互作用。
但在实际溶液中,由于溶质间的相互作用,活度系数会发生变化,需要通过实验测定或者使用活度系数模型来计算。
三、理想溶液的热力学性质理想溶液的化学势和活度给出了研究溶液平衡和反应动力学的基本工具。
通过计算化学势和活度的变化,可以得出理想溶液中的各种物理量,比如溶解度、浓度、摩尔分数等。
此外,对于理想溶液而言,溶液的物理和化学性质可以通过理想溶液的熵以及熵变来描述。
化学势计算

化学势是单相多组分系统中一种典型的偏摩尔量,对正确理解诸如“自发性”、“化学平衡”等重要的热力学概念有一定意义。
本文拟结合化学势的新定义(μB=G B/n B)及热力学基本方程,重新推导单相多组分系统中化学势的表示式。
1.气相物质的化学势1.1 单组分理想气体的化学势对于单组分理想气体,μ=G/n=G m(1)d G m=dμ=-S m dT+V m dp+δW'(2)式(1)、(2)中G m、S m及V m分别代表单组分理想气体的摩尔吉布斯自由能、摩尔熵及摩尔体积。
恒温下,单组分理想气体由标准压力(pθ)变化至实际压力(p)时,有效功δW'≡0;此时式(2)可化简为:dμ=V m dp积分可得:μ(T,p)- μ(T,pθ)=RT▪ln(p/pθ)整理:μ(T,p)=μθ(T)+ RT▪ln(p/pθ)(3)式(3)即为单组分理想气体的化学势表示式。
1.2 理想气体中某一组分B的化学势理想气体中组分B的化学势表示式推导方法与1.1相同。
由式(3)可得:μB(T,p)=μθB(T)+ RT▪ln(p B/pθ)(4)将分压定律“p B=x B▪p“代入式(4)可得:μB(T,p)=μθB(T)+ RT▪ln(p/pθ)+RT▪lnx B整理:μB(T,p)=μ*B(T, p)+RT▪lnx B(5)式(5)为理想气体某一组分B的化学势;式(5)中:μ*B(T, p)=μθB(T)+ RT▪ln(p/pθ)1.3 非理想气体的化学势计算非理想气体化学势时,需用逸度代替压强,具体表示式分别为:μ(T,p)=μθ(T)+ RT▪ln(/pθ)(7)μB(T,p)=μθB(T)+ RT▪ln(B/pθ)(8)式(7)、(8)中的及B分别代表非理想气体及某一组分B的逸度,其中:=f▪p, f 称逸度因子;B=f B▪p B,f B称为非理想气体中B组分的逸度因子。
备注:逸度因子f通常可由图解法、近似法或对比状态法获取[1]。
《物理化学(上)》作业

µ2; µ4 D. µ3>µ4=µ1>µ2
上述各状态化学势大小的顺序为 C. µ2<µ1=µ3<µ4
第 1 页 共 6 页 在您完成作业过程中,如有疑难,请登录学院网站“辅导答疑”栏目,与老师进行交流讨论!
12.设 NaCl 在水中完全电离,则 0.15mol·kg 为 1.86 K·kg·mol ) A. 272.6K A. 电解质 B. 273.2K B. 气体溶质 C. 挥发性溶质
《物理化学(上) 》作业
一.单选题 1.下列物理量中属于强度性质的是 A. H B. S C. p D. G 2.298.2K 时,1mol 的氧气(可视为理想气体)经等温可逆膨胀后,体积胀大 10 倍,对于该过程来说, 其ΔH 和 W 分别为 A. ΔH=0, W=0 C. ΔH=5708.6 J, W=-5708.6 J
Θ -1
B.ΔS = –108.78J·K , ΔG = 0 D.ΔS =0, ΔG = – 40.6kJ
-1
T, V, n j
i
B. (S/ni)
T, p, nji
C. (H/ni)S, p, nji
D. (µi/ni)T, p, nji
9.在恒温封闭的容器中有 a.b 两杯稀盐水溶液,盐的浓度分别为 ca 和 cb (ca>cb) ,放置足够长的时间 B. a 杯液体量减少,b 杯液体量增加 D. a.b 两杯中盐的浓度会同时增加 C.ΔmixF=0
Θ
10.在 298.2K, p 压力下, A.B 两种液体混合形成理想溶液,对于该混合过程下列关系正确的是 A.ΔmixH=0 11.设有下列各状态 373.2K.p 的 H2O(l) 373.2K.p 的 H2O(g) A. µ1>µ2=µ4>µ3
2液、固相化学势表达式纯液体(或固体)物质B的标准状…

2 液、固相化学势表达式 纯液体(或固体)物质B 的标准状态规定为同温度,标准压力时纯液体(或固体)物质B 的状态。
即O Bμ(l, T )= *B μ(l, T, O p ) (2—23a) 于是纯液体(或固体)物质B 的化学势为*B μ(l, T , p ) =O B μ(l, T )+p V pp d )l (O m B,⎰ (2—23b) 实际上,在处理液体(或固体)问题时常用与液相平衡的气相化学势来表示。
考虑纯物质气-液、气-固两相平衡系统,根据两相平衡时化学势相等的关系,可以用气相的化学势来表示液相或固相的化学势。
如果将气体视为理想气体其化学势为O Oln ) (g,), (g,p p RT T p T **+=μμ 与之平衡的液相或固相的化学势为=*), (l ,p T μO Oln ) (g,),(g,p p RT T p T **+=μμ (2—24a ) =*), (s ,p T μO Oln ) (g,), (g,p p RT T p T **+=μμ (2—24b ) 上式中p *是与液(或固)相平衡的蒸气的压力,称为饱和蒸气压,此两相平衡系统中在液体(或固体)上面除了其蒸气外别无他物,这时系统的压力就是蒸气压p *。
3* 外压对蒸气压的影响 如果气相中混有其它惰性气体,这时系统的压力p >p *,由于μ(T , p , l) -μ(T , p *, l)=⎰*pp p V (l)d m若以*e p 表示外压为p 时的饱和蒸气压,则利用上面液相化学势表达式可得**pp RT e ln =⎰*p p p V (l)d m , 如果V m (l)与p 无关则 )((l)ln m ***-=p p RT V p p e (2—25) 由于V m (l)很小,所以在外压增加时,液体(或固体)的蒸气压会略有上升。
二 两相平衡时温度与压力的关系1 Clapeyron 方程 在T 、p 一定的条件下,纯物质两相平衡系统 , βμ=αμ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章多组分系统热力学及其在溶液中的应用本章要求:1.熟悉多组分系统的组成表示法及其相之间的关系;2.掌握偏摩尔量和化学势的定义,了解它们之间的区别和在多组分系统中引入偏摩尔量和化学势的意义。
3.掌握理想气体化学势的表示式及其标准态的含义,了解逸度的概念。
4.掌握Roul定律和Henry定律的用处,了解它们的适用条件和不同之处。
5.了解理想液态混合物的通性及化学势的表示方法,了解理想稀溶液中各组分化学势的表示法。
6.熟悉稀溶液的依数性及利用依数性计算未知物的摩尔质量,了解活度的概念。
§4.1 引言一、溶液:1.定义:两种或两种以上的物质在分子级别上呈均匀混合状态,通常将其中含量多者称为溶剂,含量少者称为溶质。
2.分类:a.按相态分:液态溶液、固态溶液。
b.电离情况分:电解质溶液、非电解质溶液。
二、 受力与热效应的关系:(f 1.2溶剂与溶质间的作用,f 1.1溶剂分子间的作用f 2.2溶质间作用)。
1. 若f 2.2> f 1.1 ,系统放热; 2. 若f 1.2< f 1.1 ,系统吸热;3. 若f 1.2= f 1.1= f 2.2 ,系统无热效应。
稀溶液主要是溶剂分子间的相互作用。
§4.2 多组分系统的组成表式法对多组分系统,描述其状态,除使用温度压力和体积外,还应标明各组分的浓度.12(...)i Z f T P n n n =⋅⋅⋅。
一、 混合物中任一组分B 的浓度:1. 质量浓度:用物质的质量除以混合物的体积,以符号B ρ表示。
即()/B B m V ρ=,单位:3.Kg m -.2. 质量分数:组分B 的质量m (B)与混合物总质量之比以符号()B ω表示。
即()/B B A Am m ω=∑ ,单位为1.3. 物质的量浓度:组分B 的物质的量除以混合物的体积V ,以符号C (B) 表示。
即C B =n (B)/V.单位mol.m -3或mol.dm -3.4. 摩尔分数(物质的量分数):组分B 的物质的量与混合物总的物质的量之比。
以符号x (B)或y (B)表示。
()()/B B A Ax n n =∑, 单位为1.二、 溶液组成表示:1.质量摩尔浓度,溶质B 的物质的量除以溶剂的质量m (A).以符号m B 或b B 表示:()BB A n m m =,单位:mol.Kg -1. 由于B 的质量摩尔浓度与温度无关,在热力学处理中比较方便。
在电化学中也采用该浓度表示电解质的浓度。
2.浓度B 的摩尔比:溶质B 的物质的量n B 与溶剂A 的物质的量n A 之比。
以符号r B 表示。
r B =n B /n A .单位为1。
§4.3 偏摩尔量前面学习了热力学定律,讨论的热力学系统大多数都是纯物质,称为单组分系统。
描述单组分密闭系统的状态,只需两个状态性质。
如:x=f(T,P)等。
但对于多组分均相(在分子级别上呈混合均匀状态)系统。
两个状态性质并不能确定系统的状态,还需指明系统中各组分的物质的量(或弄浓度)。
才能确定系统的状态。
因为在单组分系统中,体系的U.H.S.A.G.V 等。
容量性质具有加和性,但对多组分体系,这些容量性质则不具有简单的加和性。
即某种容量性质并不等于各纯组分的这种容量性质之和,如()1.12.2V m V m v n n **≠+溶液,()1.12.2H H m H m n n **≠+溶液(*为纯物质)。
因此,要描述一多组分均相系统的状态,除指明系统的温度和压力外,还需指明每种物质的量。
为此,引入了一个新的概念—偏摩尔量。
一、偏摩尔量的定义:多组分系统的任一种容量性质Z (Z 可分别代表V.U.H.S.A.G 等)可看作是温度T ,压力P 及各组分物质的量n 1.n 2⋅⋅⋅的函数。
如:12(...)K Z f T P n n n =⋅⋅⋅则全微分,....11..22..12()()()()()K K j j j P n T T P n T P n T P n K K KZ Z Z Z ZdZ dT n dP dn dn dn T P n n n ≠≠≠∂∂∂∂∂=++++⋅⋅⋅+∂∂∂∂∂ 式中脚标n K 表示所组分的物质的量都固定,n j 表示除指定的物质外,其它物质的量固定。
若系统在等温等压下变化,则dT=0,dP=0. 令Z B =()..()C i B T P n BZn ≠∂∂则 11221KK K B B B dZ Z dn Z dn Z dn Z dn ==++⋅⋅⋅+=∑()..()c C B B T P n BZZ n ≠∂=∂称为物质B 的偏摩尔量。
用符号Z B 或Z m.B 表示。
Z 是热力学量,是容量性质,常见的如:()..()c C B B T P n BVV n ≠∂=∂ ,()..()C C B B T P n BG G n ≠∂=∂.1.偏摩尔量的物理意义:(1)在定温定压条件下,在无限大量的系统中,保持B 以外的其他组分的数量不变(即n C (C ≠B)不变)加入1molB 所引起该系统容量性质Z 的改变。
(2)在定温定压下,在有限量的系统中加入dn B (系统的浓度可视为不变),系统容量性质改变了dZ.则Z B 即为dZ 与dn B 之比。
2.注意:(1)偏摩尔量与T.P 系统的组成有关;(2)必须满足T.P 恒定和除B 以外的其他组分的量保持不变的条件,否则不能称片摩尔量。
(3)只有容量性质才有偏摩尔量,强度性质则没有偏摩尔量。
因为只有容量性质才与系统中物质的量有关。
(4)偏摩尔量是强度性质(因为它是容量性质之比)与混合物的浓度有关,而与混合物的总量无关。
(5)偏摩尔吉布斯自由能G B 又称为化学势,并用符号B μ表示。
二、偏摩尔量的加和公式(集合公式):如A.D 组成的系统,其物质的量分别为n A .n B ,定温定压下向系统中加入dn A 和 dn B ,则系统的某个容量性质Z 的变化,()()()B A A B D D dZ Z dn Z dn =+.若保持dn A :dn D =n A : n B 连续不断地往系统中同时加入dn A ,dn D (即保证系统浓度不变)则Z B(A), Z B(D)为一常数,则系统容量性质Z 的变化为()()000A DZ n n B A A B D D dZ Z dn Z dn =+⎰⎰⎰ ,即 ()()B A A B D D Z Z n Z n =+对对组分系统,则11221KK K B B B Z n Z n Z n Z n Z ==++=∑上式则称为多组分均相体系偏摩尔量的加和公式,它表示系统中某容量性质Z 应等于各物质的量与各物质该容量性质的偏摩尔量的乘积之和,也即各物质对该容量性质的贡献之和。
如:1KB B B V n V ==∑ , 1BBKB U n u ==∑ ,11BBKKB B B B G n G n μ====∑∑ 等。
在多组分系统中,各组分的偏摩尔量并不是彼此无关的。
它们必须满足偏摩尔量的加和公式。
三、 偏摩尔量的求法:1.分析法:根据某容量性质与组成的函数关系式,直接求偏微分商即可得到偏摩尔量。
(P 211例)2.图解法:以实验为依据。
作Z —n B 图,则曲线上某点的正切..()AT P n BZn ∂∂即为该浓度的Z B 。
3.截距法:四、吉布斯—杜亥姆公式—系统中片摩尔量之间的关系: 在等温等压下,均相系统中各组分的偏摩尔量遵从偏摩尔量的加和公式,即11221KK K B B B Z Z n Z n Z n Z n ==++⋅⋅⋅+=∑.则其全微分:11K KB B B B B B dZ n dZ Z dn ===+∑∑又∵定温等压下: 1KB B B dZ Z dn ==∑ .∴ 1KB B B n dZ =∑ .即:11220KK n dZ n dZ n dZ ++⋅⋅⋅+= 两边除以混合物的总的物质的量,则11220K K x dZ x dZ x dZ ++⋅⋅⋅+= (x 1为组分1的摩尔分数).由此可见,各组分的偏摩尔量之间不是彼此无关的,而是具有一定的关系。
如系统中某些组分dZ 增大,而另一些组分dZ 则减小,符合杜亥姆公式。
例: 在288K ,大气压下,某酒窖中存在酒10.0m 3,其中含乙醇得分质量分数为0.96.今欲加水调制含乙醇的质量分数为0.56的酒,试计算:①应加入水的体积;②加水后,能得到含乙醇的质量分数为0.56的酒的体积。
已知该条件下,纯水的密度为999.1Kg.m -3,水和乙醇的偏摩尔体积为:25()C H OH W 2631()/(10)V H O m mol --⋅ 25631()/(10)V C H OH m mol --⋅⋅0.96 14.61 58.01 0.56 17.11 56.58 解: ∵加水前乙醇的质量分数为0.96 ,则 n 醇:n 水=0.9610.96:9.3914618-= ①又∵加水前水和乙醇的偏摩尔体积分别为663114.611058.0110m mol ---⨯⨯⋅和.总体积为10m 3.由偏摩尔量的加和公式:661058.011014.6110Kn n --=⨯⨯+⨯⨯醇②联立解①② ,可得 n 醇=167876.45moln 水=17876.313mol 设加入水的物质的量为2'H On ,则n 醇 (n 水+2'H On )=0.5610.56:0.4984618-= ∴ 2'H On=319208.94mol∴应加入水的体积△V=5.751m 3 加水后,酒的体积V=167876.45×56.58×10-6+(17876.313+319208.94)×17.11×10-6 =15.266m 3 . 【作业】:P 266 2、4.§4.4 化学势 一、化学式的定义:为了处理敞开系统或组成发生变化的封闭系统的热力学关系式,引进了化学势的概念。
1.热力学能:由热力学公理,对多组分系统:U=f(S.V.n 1.n 2⋅⋅⋅n K ),则...1()()().B B C B KV n S n S V B BB U U Udu dS dV n dn S V n ≠=∂∂∂=++∂∂∂∑若所有组成都不变, 则().().B B V S U U dU n dS n dV S V∂∂=+∂∂ =TdS-PdV. 若组成发生改变,则..1()C KS V B BB UdU Tds PdV n dn n =∂=-+∂∑令Bdef μ=..()C B S V BUn n ≠∂∂,则B μ称为物质B 的化学势,其意义是当熵,体积及除B 组分以外其他各物质的量(n C )均不变的条件下,若B 组分增加dn B .引起系统热力学能变化du,则du 与B d μ的比值就等于B μ.∴1KB B B dU TdS PdV dn μ==-+∑.2.Gibbs 自由能:由定义 G=U-TS+PV 或G=H-TS则dG=du-TdS-SdT+PdV+VdP.将dU 代入,则1KB B B dG SdT VdP dn μ==-++∑.若12(...)K G f T P n n n =⋅⋅⋅...1()()().B B C KP T T P B BB G G G dG n dT n dP n dn T P n =∂∂∂=++∂∂∂∑=-..1()C B KT P BB GSdT VdP n dn n =∂-++∂∑. 两式比较:则 ..()C B B T P BGn μμ≠∂=∂同理,根据H 和A 的定义,并选12(...)K H f S P n n n =⋅⋅⋅12(...)K A f T V n n n =⋅⋅⋅可得.........()()()()C B C B C B C B B S V S P T V T P B B B BU H A Gn n n n n n n n μ≠≠≠≠∂∂∂∂====∂∂∂∂ 这四个偏微商都叫做化学势,应特别注意,每个热力学函数所选择的独立变量彼此不同。
