相图-3
三元相图教程ppt课件

6
确定一点的组成
1、平行线法(三线法)
7
2、双线法确定三元组成
b
c
a
8 8
• 如果三元相图的组分已知就可以在浓度三 角形中确定相应的位置。
O的组成为: A——30% B——60% C——10% 那么O点应该 在哪里呢?
9
三、三元系统组成
C
中的一些关系
1、等含量规则
在等边三角形
B
M1+M2-M3=M
从M1+M2中取出M3愈多,则M点离M3愈远。 16
(3) 共轭位置规则
在三元系统中,物质
组成点M在的一个角顶
之外,这需要从物质M3中 取出一定量的混合物质M1 +M2,才能得到新物质M, 此规则称为共轭位置规则。
由重心规则:
M1+M2+M=M3 或:M= M3 -(M1+M2)
液相点
固相点
49
C
D
F
C .G
e4
3 E Pm
A
S
A
e1
Q
析晶路程:
液相点
e3
.B
S
(3).分析:3点在C的初晶区内,开始
析出的晶相为C,在ASC内,最终析 晶产物为A、S、C,析晶终点在E点, 结晶终产物是A、S、C。途中经过P 点,P点是转熔点,同时也是过渡点。 B L+B S+C
固相点
50
Q/
S/
A/
L+B
B/ 29
1) 几条重要规则
(1)连线规则:用来判断界线的温度走向;
定义:将界线(或延长线)与相应的组成点的连线
相交,其交点是该界线上的温度最高点;温度走
向是背离交点。在连线的同时也就划出了副三角
材料科学基础-三元相图习题

3、根据所示的投影用热分析曲线表示图中成分为I、II、III的材料 在平衡冷却过程中发生的组织转变,并写出室温下的平衡组织;
答案 I
答案 II
答案 III
1. 根据所示Fe-W-C三元系的低碳部分的液相面的投影图,试标出 所有四相反应。
图中标出了单变 量线起始温度
答案:四相反应如下: 2755~2400℃时:L+W5C3→WC+W2C, ~2400℃时:L+ W2C→WC+W, ~1700℃时:L+ WC+ W→M6C ~1500℃时:L+ W→M6C+Fe3W2 1380℃时:L+ Fe3W2→M6C+α 1335℃时:L+α→γ+ M6C ~1200℃时:L+ M6C→WC+γ 1085℃时:L→γ+Fe3C+ WC 其液相成分变温线的温度走向如图所示:
Al
Mg→ α θ ET
S
P1
Q T
P2
Eu β
γ
2013-6-17
1、根据下图,指出成分位于△mEp中(不在边、角处)的合金在 室温下可能有哪几种组织,并画出相应的冷却曲线的示意图。
答案 可能出现的组织: (1)
答案 可能出现的组织: (2)
答案 可能出现的组织: (3)
2、在所示的三元相图的垂直截面中写出三个四相平衡反应的反应 式
C1
1150℃
C2 b C3
Fe-13%Cr-2%C合金:
L + γ+ C1
— Cr12成分点c,位于γ+ C2两 相区,
作近似连线acb可求相对量。
Fe p363图8.34(a)
三元相图(2)

是三元系中的杠杆定律。
由直线法则及杠杆定律可作出下列推论:当给定材料在一定温度下处于两相平衡 状态时,若其中一相的成分给定,另一相的成分点必在两已知成分点连线的延长线 上;若两个平衡相的成分点已知,材料的成分点必然位于此两个成分点的连线上。
三元相图与二元相图比较。组元数增加了一个,即成分变量为两个,故表示成分的坐标轴 应为两个,需要用一个平面来表示,再加上一个垂直该成分平面的温度坐标轴,这样三元相 图就演变成一个在三维空间的立体图形。这里,分隔每一个相区的是一系列空间曲面,而不 是平面曲线。
要实测一个完整的三元相图,工作量很繁重,加之应用立体图形并不方便。因此,在研究 和分析材料时,往往只需要参考那些有实用价值的截面图和投影图,即三元相图的各种等温 截面、变温截面及各相区在浓度三角形上的投影图等。立体的三元相图也就是由许多这样的 截面和投影图组合而成的。
2.截面图 rs和At垂直截面如下图所示。rs截面的成分轴与浓度三角形的AC边平行,图中re
和es是液相线,相当于截面与空间模型中液相面Ae1Ee3A和Ce2Ee3C的截线;曲线 r1d′是截面与过渡面fe1Emf的截痕,de,ei和isl分别是截面与过渡面le3Eml, ke3Epk和je2Epj的交线;水平线r2s2是四相平衡共晶平面的投影。 利用这个垂直截面可以分析成分点在rs线上的所有合金的平衡凝固过程,并可确定 其相变临界温度。以合金O为例。当其冷到1点开始凝固出初晶A,从2点开始进入L +A+C三相平衡区,发生L→A+C共晶转变,形成两相共晶(A+C),3点在共晶 平面mnp上,冷至此点发生四相平衡共晶转变L→A+B+C,形成三相共晶(A+B +C)。继续冷却时,合金不再发生其他变化。其室温组织是初晶A十两相共晶(A +C)十三相共晶(A+B+C)。
2-3 NH3-CO2-H2O三元体系相图
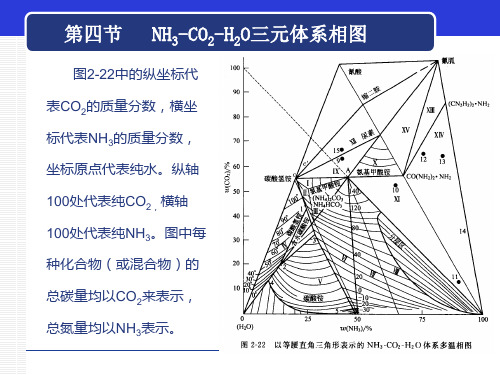
在CO2 -NH3连线以下的 区域中的化合物(或混合物) 由CO2、NH3和H2O构成,把 这类化合物称为亲水化合物。 在CO2-NH3连线以上的区域的 化合物(或混合物),则是 NH。和CO2及负水(脱水) 构成的,把它称为憎水化合物。 在CO2-NH3连线上的化合物 (或混合物)则是只由NH3和 CO2构成的。 由此可知,凡在CO2-NH3 连线以上区域的组成点,其 CO2和NH3的质量分数之和均 超过100%。
图2-29为CO2 -NH3 -H2O体系30℃的恒温相图。图上有四条
溶解度曲线,cE是NH4HCO3的溶解度曲线,EE1是2NH4HCO3•
(NH4)2CO3溶解度曲线;E1E2 是(NH4)2CO3•H2O的溶解度曲
线,E2a是NH4COONH2的溶解
度曲线。 面积AE2a为NH4COONH2
相交于M点,M点即代表此时的
液相组成。 如果开始时氨水含量高于
20%,则为了避免夹带其他杂质,
只好提高碳化度或温度,但提高 碳化度会使出塔气体中CO2含量
增高,而提高温度则又要增加氨
的损失。
四、CO2-NH3-H2O 体系(Ⅱ)相图
重点讨论与氨基甲酸铵结晶 有关联的区域,因为这是与尿素 生产过程有密切关系的区域。 1.CO2-NH3-H2O体系(Ⅱ)恒
当温度进一步降低到了
70℃时,除NH4COONH2 和NH4 HC03结晶外,又出
现P:2 NH4 HCO3•(NH4)2
CO3结晶,液相仍分层。
图2-28所示为70℃的恒温相 图。图中的P点是2NH4HCO3 •(NH4)2CO3(又名倍半碳酸铵) 的组成点(26.8%的NH3,52% 的CO2)。曲线EE1是P盐的溶解 度曲线,面积PEE1是其结晶区。 分层连接线为a'1 a'2。a'1的组成 是63%的NH3,26%的CO2;a'2 的组成是88%的NH3,2%的CO2, NH4COONH2的结晶区比100℃的 又扩大了。
物理化学三元相图详解

E(
L F
B 0,
S C L消失
)
(5)熔体M冷却析晶过程 固相:B B B B B BS w B SC M
4.液相到达低共 熔点E时,固相 组成到w点,液 相同时析出BSC, 固相由w逐渐靠 向M,到达M时,
液相消耗完毕, 析晶结束
3.到达在界线上v点后, 同时析出B β和S, F=1,液相组成沿着 界线变化,固相组成 离开B
液相消耗完毕, 析晶结束
当固相组成点达 到熔体原始组成 点时,冷却析晶
结束
v u x
w
液相在E点析晶时,固相 组成由w向M移动,刚离 开w时,L%=Mw/Ew。 到达x时,L%=Mx/Ex,
可见液相不断减少。达 到M点是L%=0
液相:M
L B F 2
u(B
L
B
)
L F
B 2
v L B S F 1
2.在多晶转变等温 线u上Bа全部转变 为Bβ后继续降温
v u
w
1.熔体M在初晶区 B内先析出Bа,液 相组成沿背向线 变化,固相组成
在B
(6)M结晶结束时各相的百分含量
结晶结束是晶相为B、S、C 利用双线法,过M做三角形 SC、SB两边的平行线Mb,
Md,可得 B:S:C=Cb:db:dB
b
d
(7)熔体N冷却析晶过程
(5)熔体1冷却析晶过程
1、由1点所在副三 角形判出1的冷却 析晶结束的无变量
点为E4
2、由1点所在初晶 区得出1首次析晶 为B,得到固相组 成点,应用背向线
规则知道液相组成 变化路径
a b
液相:1 L B a L B A E5( B L,A B ) L B A E4( L A B S1)
3-3铁碳合金相图

1.作为选材的依据 碳对铁碳合金的组织和性能有着重大的影 响。不同成分的铁碳合金在机械性能和工艺 性能等方面产生极大的差异。
2.在铸造生产中的应用 根据Fe━Fe3C相图的液相线,可以找出不 同成分的铁碳合金的熔点,从而确定合适的 溶化温度与浇注温度。
3.在锻造工艺上的应用 钢经加热后获得单相奥氏体。其强度低,塑性 好,易于塑性变形加工。因此,钢村轧制或锻 造的温度范围多选在单一奥氏体区。
Fe ━ Fe3C相图中有七个特性点及6条 特性线,当了解这些点、线的含义后, 就可以把一个看似复杂的相图分割成不 同的区域,当成分(含碳量)和温度变 化时,按一定的规律可分析出各区域产 生的组织
Fe ━ Fe3C相图中七个特性点及温度、含碳量和含义
点的符号 A C D E G S P 温度(℃) 1538 1148 1227 1148 912 727 727 含碳量(%) 0 4.3 6.69 2.11 0 0.77 0.0218 含义 纯铁的熔点 共晶点,Lc↔(A+Fe3C) 渗碳体的熔点 碳在奥氏体(γ━Fe)中的最大溶解度点 纯点的同素异构转变点, α━Fe↔γ━Fe 共析点,As↔(F+Fe3C) 碳在铁素体 (α━Fe)中的最大溶解度点
按碳的含量分类: 工业纯铁(含碳量小于0.0218%) 钢大于2.11%)
铁碳合金的室温组织都是由铁素体和 渗碳体组成的,但含碳量不同时,铁 素体和渗碳体的相对量会有变化。 铁碳合金的成分不但对其组织上有影 响,对其性能也有影响。含碳量越高, 钢的强度、硬度越高,而塑性、韧性 越低,在钢经过热处理后表现尤为明 显。
Fe-Fe3C相图中六个特性线及含义
特性线
ACD AECF GS ES ECF PSK
含义 液相线━此线之上为液相区域,线上点为对应不同成分合金的结晶 开始温度 固相线━此线之下为固相区域,线上点为对应不同成分合金的结晶 终了温度 也称A3线,冷却时从不同含碳量的奥氏体中析出铁素体的开始线 也称Acm线,碳在奥氏体(γ━Fe)中的溶解度曲线 共晶线,Lc↔(A+Fe3C) 共析线,也称A1线,As↔(F+Fe3C)
三元相图的绘制详解
三元相图的绘制本实验是综合性实验。
其综合性体现在以下几个方面:1.实验内容以及相关知识的综合本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的1.掌握相律,掌握用三角形坐标表示三组分体系相图。
2.掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理三组分体系K=3,根据相律:f=K–φ+2=5–ф式中ф为相数。
恒定温度和压力时:f=3–φ当φ=1,则f=2因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:图1图2等边三角形三顶点分别表示三个纯物质A,B,C。
AB,BC,CA,三边表示A和B,B和C,C和A 所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如点P的组成为:A%=CbB%=AcC%=Ba具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B,及A和C完全互溶,而B和C部分互溶。
三元相图
三元系统相图一、相律及组成表示法根据吉布斯相律 f = c-p+2p -相数c -独立组分数f -自由度数2 -温度和压力外界因素凝聚态系统不考虑压力的影响,相律为:f = c-p + 1(温度)(一)相律三元相图比二元相图多一个组元,根据相律,三元凝聚系统:f =c -p +1=4 -p,当p=1 时,f max=3 ( 即两个成分变量x1、x2和温度的变化)当f=0时,体系具有做多的平衡相P=4 (四相共存)在硅酸盐系统中经常采用氧化物作为系统的组分。
一元系统如:SiO2Al2O3-SiO2二元系统CaO-Al2O3-SiO2三元系统注意区分:2CaO.SiO2(C2S) ;CaO-SiO2;K2O.Al2O3..4SiO2 -SiO2f =c -p +1=4 -p•最大自由度f max=3是指两个独立的浓度变量和一个温度变量•如何用相图表示?•一般用正三棱柱•三个顶点表示三个纯组分•纵坐标表示温度•三角形中表示各种配比的混合物•由于A+B+C为一恒定值,所以三者中只有两个是独立的变量三坐标的立体图平面投影图相图图1 三元匀晶相图图2 三元共晶相图(二)三元系统组成的表示方法浓度三角形:在三元系统中用等边三角形来表示组成。
(组成的百分含量可以是质量分数,亦可是摩尔分数)。
顶点:单元系统或纯组分;边:二元系统;内部:三元系统。
图3 浓度三角形909090808080707070606060505050404040303030202020101010cEM DaABCa图4 双线法确定三元组成CABMbc a一个三元组成点愈靠近某一角顶,该角顶所代表的组分含量必定愈高。
例题1:在浓度三角形中:•定出P 、R 、S 三点的成分。
•若有P 、R 、S 三点合金的质量分别为2,4,7Kg ,将其混合构成新合金,求混合后该合金的成分。
•定出Wc=0.80,W A /W B 等于S 中的W A /W B 时的合金成分。
相平衡-三元相图
浓度三角形:平行线
A%=20% B B% 20% B%=20% 90 10 C%=60% 20 80 30 70 40 60 B%50 50C% 40 60 30 70 20 80 90 III 10 A 90 80 70 60 50 40 30 20 10 C ← A%
7
浓度三角形性质:平行线性质
42
析晶路程也可表示如下:
液相点 M LC f= 2 LC+A D f=1
E( (L C+A+B, f = 0) 固相点 C F M
43Leabharlann 冷却曲线44四、生成一个稳定的二元化合物的 三元相图的立体图 元相图的立体图
相图立体图的三个侧面是 由一个具有一致熔化物的 二元相图和两个形成低共 熔的简单二元相图组成。 在实际三元体系中经常出 现若干二元化合物和三元 化合物 如果这些化合物同 化合物,如果这些化合物同 组成熔化,则和二元体系一 样,可以分解成若干简单的 三元系来处理。
10
两条推论 ( 1 )给定组分体系在一定 温度下处于两相平衡时,若 其中 个相的成分给定 另 其中一个相的成分给定,另 一个相的成分点必然位于已 知成分点连线的延长线上。 知成分点连线的延长线上 ( 2 )若两个平衡相的成分 点已知,则体系的成分点必 然位于两个已知成分点的连 线上。
11
重心规则
39
要点
• M→D →E等:表示液相的组成变化 等 表示液相的组成变化 • 箭头上方表示析晶、熔化或转熔的反应式,箭头 下方表示相数和自由度; • 方括号内表示固相的变化,如[C,(C)]表示固相 总组成点在C点 (C)表示晶体c刚析出 [F, 总组成点在C点,(C)表示晶体c刚析出, [F A+C+(B)]则表示固相总组成点在F,固相中已有A 和C晶体析出 而B晶体刚要析出 和C晶体析出,而B晶体刚要析出
§5-6 三元相图
典型合金的凝固过程
(4)投影图
e3
A α E β B
液相区投影
l
γ
e2 A
C
A l C
C
e1
l e3 m e1 n B
固相区投影
p B
e
2
各典型区域凝固过程和室温组织
五. 三元相图的一些规律
1. 单相区 自由度是3,其形状不受温度、成分对应关系的制约, 截面可以是多种形状的平面图形。 2. 双相区
分析合金在加热和冷却过程中的转变。
四. 三元共晶相图
1. 组元在固态完全不溶的三元共晶相图
(1)相图分析
A
B
A C
B C
点:熔点 tA,tB,tC 二元共晶点 E1,E2,E3 三元E2E,E3E
面:3个液相面
1个固相面
固相面
(三元共晶面)
6个二元共晶面
杠杆定律
由二种合金合成一种合金成分
由一种合金分解成二种合金成分
PR / RQ Wq / Wp
W / W R / R
2.重心法则
合金o分解为α 、β 和L三个平衡相,a、b、c 分别是 α 、β 和L的成分点。
则
oa ' w 100% aa ' ob' w 100% bb' oc ' wL 100% cc '
3 等温截面(水平截面)
T
共轭曲线及直线规则
共轭曲线
液、固相 等温线
两相区平衡两 相的成分连线
共轭连线
在等温截面的两相区内,根据相律 F=3-2=1, 说明两个相的成分只有一个是独立可变的。两个平 衡相的成分对应关系由直线法则决定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
匀晶反应+共晶反应+脱溶转变
• 室温组织: α+βⅡ+ (α+β) 共 在共晶转变之前,从液态 中先结晶出α相。先结晶出的相叫先共晶相(pro-eutectic phase)。先共晶相和液相比例可用杠杆法则求出
2013-7-26
包晶点(D)以左合金
• 冷却曲线
•
• •
碰到DP发生包晶反应:Lc+αP =βD 为恒温反应
结晶过程:L→L+α→L+α+β→α+β→α+β+αⅡ+ βⅡ 匀晶反应 + 包晶反应 + 室温组织:α+ β+αⅡ+ βⅡ 脱溶转变
2013-7-26
c. 10.5%<ω(Ag)<42.4%的Pt-Ag合金(合金Ⅲ)
• 所谓共晶转变是在一定条件下(温度、成分),由均匀液体中 同时结晶出两种不同固相的转变,所得到两固相的混合物 称为共晶组织(体)。具有共晶转变的相图称为共晶相图。
• 属于二元共晶相图的合金有:Pb-Sn、Pb-Sb、Al-Si、 Al-Cu、Mg-Si、Al-Mg等。
2013-7-26
共晶相图分析
•
两组元在液态下无限互溶,固态下只能部分互溶并具有 包晶转变的相图称为二元包晶相图(the peritectic phase diagram)。 具有包晶转变的二元合金有:Cu-Sn、Fe-C、Cu-Zn 、Ag-Sn、Ag-Pt
•
2013-7-26
包晶相图分析
•
•
线:固相线、液相线、水平线(DPC)为包晶转变线。 包 晶转变线上的合金在该温度下发生包晶转变: Lc+αp =βD
;反之,越接近平衡状态;
• 先结晶部分总是富高熔点组元; • 非平衡凝固终结温度低于平衡凝固时的终结温度。
2013-7-26
固溶体通常以树枝状生长方式结晶,非平衡凝固导致先结晶的枝干和后结晶的 枝间的成分不同,故称为枝晶偏析。图7.18是Cu-Ni合金的铸态组织,树枝晶 形貌的显示是由于枝干和枝间的成分差异引起浸蚀后颜色的深浅不同。图7. 19是经扩散退火后的Cu—Ni合金的显微组织,树枝状形态已消失,由电子探针 微区分析的结果也证实了枝晶偏析已消除。
2013-7-26
温 度 L3 L2 t4
I
L L+α α α 2
3
B 1452℃ t1 α
1
L
L α
L1 t3 t2
L4 A 1083℃
、 3 α 4
α
α
Cu
XL X0
Xα Ni %
Ni
时间 (b)
(a)
Cu-Ni合金相图
2013-7-26
需要着重指出的是,在每一温度下,平衡凝固实质包括三个过程:①液相内 的扩散过程。②固相的继续长大。 ⑦固相内的扩散过程。现以上述合金从 小至,2 温度的平衡凝固为例,由图7.16具体描述之。
点右侧合金; 也可通过平衡凝固获得,如相图中的a点右侧合金, c点左侧合 金;
2013-7-26
离异共晶显微组织图
2013-7-26
包晶相图及其合金凝固
包晶相图概述 • 有些合金当凝固到一定温度时,已结晶出来的一定成分 的固相与剩余液相(有确定成分)发生反应生成另一种固相 的恒温转变过程称为包晶转变(peritectic reaction)。
2013-7-26
共晶合金的平衡凝固及其组织
共晶相图的概念 • 组成共晶相图(the eutectic phase diagram)的两组元,其相 互作用的特点是:液态下两组元能无限互溶,固态下只能部 分互溶(形成有限固溶体或化合物),甚至有时完全不溶,并 具有共晶转变(the eutectic reaction)。
•
结晶过程:L→L+β→L+β+(α+β)共→β+ (α +β) 共 →β+αⅡ+ (α +β) 共 室温组织: β+αⅡ+ (α +β) 共
• 匀晶反应+共晶反应+脱溶转变
•
2013-7-26
过共晶合金显微组织
成分位于E,N两点之间的合金称为过共晶合金。其平街凝固过程及 平衡组织与亚共晶合金相似,只是初生相为β 固溶体而不是α 固溶 体。室温时的组织为β 初+(α +β )。
• 结晶过程:L → L+αI→αI→αI+βⅡ 匀晶反应 + 脱溶转变
•
室温组织: α+βⅡ
2013-7-26
图7.21为ω (Sn)=10%的Pb-Sn合金平衡凝固过程示意 图。
2013-7-26
共晶合金(61.9%Sn)
该合金的冷却曲线为:
•
该合金发生共晶反应: LE→ αM +βN 这一过程在恒 温下进行,直至凝固结束。形成共晶体(α+β)。两个 相的相对量可用杠杆法则求得: αM = EN/MN βN = ME/MN
2013-7-26
共晶系合金平衡凝固特点
• 通过以上分析共晶系合金的平衡凝固可分为两类:固溶体 合金和共晶型合金。前者的结晶过程主要为匀晶相变+脱 溶转变,组织为初生固溶体和次生组织;后者的结晶过程 主要为匀晶相变、共晶相变和脱溶相变,组织为初生固溶 体、共晶体和次生组织。。 • 需要指出的是在分析显微组织时,应注意组织组成物和相 组成的区别。组织组成物是在结晶过程中形成的,有清晰 轮廓的独立组成部分,如上述组织中α、αⅡ、β、βⅡ、(α +β) 共 都是组织组成物。而相组成物是指组成显微组织的基 本相,它有确定的成分及结构但没有形态上的概念,上述 各类合金在室温的相组成物都是α相和β相。所以共晶合金 都是由α相和β相组成的机械混合物(mechanical mixture) 。
相区:三个单相区 L相区、α相区和β相区; 三个双相区 L+α相区、L+β相区、α+β相区; 三相共存于DPC线 L+α+β
•
包晶线与共晶线不同之处在于:共晶线为固相线,线上的 合金在共晶温度全部凝固完毕,其组织为两相混合物。包 晶线仅有DP为固相线,而DC为液相线。
2013-7-26
包晶相图
图7.30所示的Pt-Ag相图是具有包晶转变的相图中的典型代表。
2013-7-26
3.包晶合金的非平衡凝固
实际生产中的冷速较快,导致包晶反应的不完全性,形成包晶反应 的非平衡组织。如图7.35所示:
2013-7-26
另外,某些原来不发生包晶反应的合金,在快冷条件下,出现某些 平衡状态下不应出现的相,如图 7.36中的合金I。
2013-7-26
溶混间隙相图与调幅分解
2013-7-26
平衡凝固过程分析
• 从T1->T2温度,可采取两种方法:
– 每一步都非常缓慢,处于平衡状态;
– 一下子降温到T2温度,保温足够长时间,使其扩散均匀
• 固相成分由初始41%Ni->36%Ni,依靠固相量的增多; • 液相成分由初始30%Ni->24%Ni,依靠结晶出36%-41
%Ni的固相
相图 第三讲
2013-7-26
2. 固溶体的平衡凝固
联结线(Tie line):确定某一温度下两相平衡成分的连线。
平衡凝固是指凝固过程中的每个阶段都能达到平衡,即在相 变过程中有充分时间进行组元间的扩散,以达到平衡相的成 分,现以ω (Ni)为30%的Cu-Ni合金(见图7.12)为例来描述 平衡凝固过程。该合金整个凝固过程中的组织变化示于图7. 15中。
2013-7-26
3.共晶合金的非平衡凝固
a.伪共晶 在非平衡凝固条件下,某些亚共晶或过共晶成分的合金也能得全部 的共晶组织,这种由非共晶成 分的合金所得到的共晶组织称为伪共 晶,如图7.27所示。
2013-7-26
在用Al-Si合金中,共晶成分的Al-Si合金在快冷条件下得到的组 织不是共晶组织,而是亚共晶组织;而过共晶成分的合金则可能得 到共晶组织或亚共晶组织,这种异常现象通过图7.28所示的伪共晶 区的配置不难解释了。
2013-7-26
b. 非平衡共晶组织
由于非平衡共晶体数量较少,通常共晶体中α相依附于初生α 相生长,将共晶体中另一相β推到最后凝固的晶界处从而使 共晶体两组成相间的组织特征消失,这种两相分离的共晶体 称为离异共晶(divorced eutectic) 离异共晶可通过非平衡凝固获得,如相图中的a点左侧合金, c
2013-7-26
• 各相区中相组成物:
共晶合金的特点
• 熔点分别低于各纯组元;
• 比纯金属具有更好的流动性,防止枝晶的形成;
• 恒温转变,减少铸造缺陷; • 其组织弥散细小混合,层状或杆状组织,性能优异的原位 复合材料。
2013-7-26
共晶合金的平衡凝固及其组织
Pb-Sn共晶相图
2013-7-26
2013-7-26
包晶合金的非平衡凝固
• 包晶转变一般不易进行完全,即最终组织不易达到平衡状
态,且包晶反应速度较慢,形成非平衡组织;
• 包晶转变能否进行完全的主要矛盾是所形成新相β内的扩 散速率;
• 从生长方式上看,新相 β包围α长大,扩散速率小,易产生 不完全性,若包晶相单独在液相中形核和长大时,包晶转 变亦可迅速完成。
• 晶粒之间和晶粒内部的成分是均匀的
2013-7-26
固溶体非平衡凝固
在工业生产中,合金溶液浇涛后的冷却速度较快,使凝固过程偏离 平衡条件,称为非平衡凝固。图7.17(a)是非平衡凝固时液、固两 相成分变化的示意图。
