含-H的酮或其它容易烯醇化的羰基化
第9章羰基化合物

第9章 羰基化合物大体要求:1. 把握醛和酮的命名(系统命名法,一般命名法)2. 把握醛和酮的结构及对化学性质的阻碍。
3. 了解醛和酮的物理性质和光谱特点。
4. 把握亲核加成的反映类型、机理、应用。
5. α—H 的酸性,α—H 的卤代反映及缩合反映(羟醛缩合)6. 氧化、还原反映及其在有机合成中的应用。
7. α,β—不饱和醛、酮的反映特点。
醛(aldehydes )和酮(ketones )都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛,与两个烃基相连的称为酮。
CO R'C RO HC R(H)O羰基 醛 酮醛能够简写为RCHO ,基团—CHO 为醛的官能团,称为醛基,酮能够简写为RCOR ’, 基团—CO —为酮的官能团,称为酮基。
醛和酮是一类超级重要的化合物,这不仅是因为学多化学产品和药物含有醛、酮结构,更重要的是醛、酮能发生许多化学反映,是进行有机合成的重要原料和中间体。
醌(quinone )类是一类特殊的环状不饱和二酮类化合物。
第一节 醛和酮一、羰基的结构羰基是醛、酮的官能团,它与醛、酮的物理化学性质紧密相关。
依照醛、酮分子的结构参数(见表10-1),能够以为羰基碳原子以sp 2杂化状态参与成键,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道在侧面彼此重叠形成一个π键(见图10-1)。
(请在图左侧第一幅图中,下半个轨道中着淡灰色,如中间那幅图轨道的颜色)表10-1 醛、酮分子的结构参数醛、酮分子 键长(pm ) 键角(0) HCHO C — ∠ ∠ CH 3CHOC — C —∠ ∠ ∠ CH 3COCH 3 C =O 121.4 C —∠ ∠δ-+图10-1 羰基的结构由于氧原子的电负性比碳原子大,因此成键处的电子云就不均匀地散布在碳氧原子之间,氧原子处电子云密度较高,带有部份负电荷,而碳原子处的电子云密度较低,带有部份正电荷。
加氢甲酰化反应 羰基化反应

加氢甲酰化反应羰基化反应
加氢甲酰化反应和羰基化反应是有机化学中两种重要的反应类型,它们在合成有机化合物和药物中具有广泛的应用。
首先,让我们来看加氢甲酰化反应。
加氢甲酰化反应是一种将醛或酮转化为醇的反应。
通常情况下,这种反应需要使用氢气和催化剂,如铂、钯或镍。
这种反应在工业上被广泛应用,用于生产醇类化合物,例如乙醇和异丙醇。
在实验室中,加氢甲酰化反应也常用于有机合成中,特别是在合成复杂有机分子时。
接下来是羰基化反应。
羰基化反应是指一种在有机化合物中引入羰基(C=O)的反应。
最常见的羰基化反应是卡宾反应,通过卡宾中间体将醛或酮转化为相应的羰基化合物。
此外,还有一些其他羰基化反应,如沃尔夫-克希纳反应和斯特克反应等,它们也可以实现在有机分子中引入羰基的目的。
总的来说,加氢甲酰化反应和羰基化反应都是有机化学中重要的反应类型,它们对于合成和改性有机分子都具有重要意义。
这些反应的研究和应用有助于扩展我们对有机化学反应的认识,并为药物和材料的合成提供了重要的手段。
酮-烯醇互变异构

酮-烯醇互变异构酮-烯醇互变异构:酮与一种称为烯醇的形式处于平衡状态。
烯醇这个名字源于这样一个事实,烯醇是含羰基( C = O )的基团,如醛或酮和醇羟基( OH )的组合。
这两种形式之间的相互转换是由一种叫做互变异构的过程产生的。
这两种异构体通过分子中氢和双键位置的变化而相互关联。
因此,互变异构现象描述了酮和烯醇之间的平衡,这种平衡通过改变电子和氢的键合位置而相互转化,从而产生两种异构体。
这一过程是酮、醛和酯的典型过程,一般来说,相互转化是缓慢的。
含羰基化合物的异构体优于烯醇形式,酮形式占主导地位,大于99 %。
这些比例的控制可以通过催化来实现,特别是通过酸或碱。
糖是碳原子的多羟基链(包含许多OH基团),其另外具有醛或酮官能团。
一般来说,所有糖的特征是碳:氢:氧的比例为1 : 2 : 1。
随后,碳水化合物具有在反应性羟基和羰基碳之间进行内部或分子内反应的能力。
羟基是亲核的;它拥有一个孤电子对,它可以贡献给羰基碳,从而形成一个键。
羰基碳易于形成这种键,因为它的电子受到双键氧的牵引作用。
氧比碳更能吸引成对的电子;据说它更具电负性。
当糖中的单个亲核羟基攻击醛或酮时,分别产生称为半缩醛或半缩酮的产物。
前缀hemi -表示反应的可逆性。
它们也称为缩醛或吡喃糖。
由于化学键形成所产生的闭环效应,这些是环状的。
请注意,攻击醛产生半缩醛会产生6元环。
在糖中,这被称为醛糖。
或者,如果羟基攻击酮以产生半缩酮,则所得产物是称为酮糖或呋喃糖的5元环。
另一个需要注意的惯例是“D -”和“L -”。
前缀“D -”用于表示光学异构体(具有围绕中心原子的不对称基团的异构体)旋转平面偏振光的方向。
d - '异构体的手性( C5 )中心的OH指向右侧;l - '异构体的手性( C5 )中心的OH指向左侧。
在糖中,糖的线性和环状半缩酮或半缩醛平衡存在;线性形式的糖可以经历酮-烯醇互变异构。
这发生在醛糖和酮糖形式之间的相互转化过程中。
有机化学课件(徐寿昌--全)14

§14.3 丙二酸酯在有机合成上的应用 1. 丙二酸二乙酯的制备:
• 强亲核试剂,与卤烷发 生取代反应.
5
2、 丙二酸二乙酯的化学性质: ① 在碱性条件下水解,加热后脱羧生成乙酸。
CH2(COOC2H5)2
Δ CH3COOH
NaOH
+
H3 O
HOOCCH2COOH
6
② 丙二酸二乙酯活泼亚甲基上的反应
CH2CH2COOH
(1) EtONa EtOH
2 CH2(CO2Et)2 (2) BrCH2CH2Br
(1) NaOH (2) H3O+
T.M
12
丙二酸二乙酯在有机合成的应用 丙二酸二乙酯的上述性质在有机合成上广泛用于
合成各种类型的羧酸(一取代乙酸,二取代乙酸,环 烷基甲酸,二元羧酸等)。
具有活泼亚甲基的化合物容易在碱性条件下形成 稳定的碳负离子,所以它们还可以和羰基发生一系列 亲核加成。
* *
• 水解、加热脱羧——1,5-二羰基化合物
29
• 水解、加热脱羧——1,5-二羰基化合物
30
• 感谢阅读
92.5%
7.5%
21
2. 乙酰乙酸乙酯的化学性质 1). 酮式分解和酸式分解 a. 乙酰乙酸乙酯在稀碱作用下,首先水解 生成乙酰乙酸,后者在加热条件下,脱羧生成 酮。
22
b. 乙酰乙酸乙酯与浓碱共热,则在α-和β-碳 原子间断键,生成两分子乙酸盐,该分解称为酸 式分解。
= =
= = =
O
O
CH3 C CH2 C OC2H5 + OH
24
(b)钠盐的烷基化和酰基化
== ==
= =
O
O
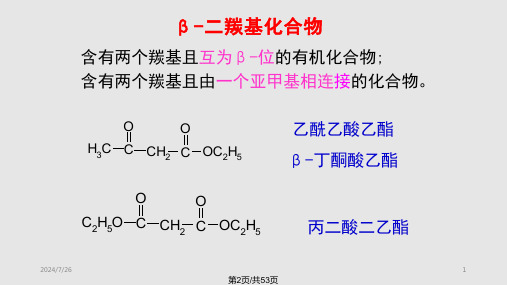
有机化学二羰基化合物
碳氧双键处于共轭体系,发生了电子的离域,使体
系能量降低而趋于稳定。
:OH
H3C C CH
O C OC2H5
2024/7/26
4
第5页/共53页
影响烯醇式含量的其它因素:
① 活泼亚甲基上连有吸电子基团,烯醇式含 量↑,连有供电子基团,烯醇式含量↓。
O
O
O
O
H3C
C
CH
C OC2H5 > H3C
C
CH2
2+
Hg
+
H
OH CH CH2
O CH3C H
β-二羰基化合物的烯醇式结构稳定性:乙酰乙酸乙酯
实验事实:
① 能与NaHSO3、HCN等发生加成反应; ② 能与羟胺、苯肼反应,生成肟、苯腙等; ③ 能被还原成β-羟基酸酯; ④ 经水解、酸化后,可以脱羧生成丙酮。
O
O
H3C C CH2 C OC2H5
有羰基
O CH3C CH
O COC2H5
Na+
Br(CH2)4Br
O CH3C
C2H5ONa
COCH3
成酮分解
COOC2H5
O CH COC2H5 CH2(CH2)3Br
O
CCH3
2024/7/26
28
第29页/共53页
② 制二酮
2024/7/26
制β-二酮(1,3-二酮)
O CH3C CH
O COC2H5
第11页/共53页
三、丙二酸二乙酯的合成及应用
1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
① 制备烃基取代乙酸 ② 制备二元羧酸
2024/7/26
aldol 反应机理‘

aldol 反应机理‘
Aldol反应,也称为羟醛缩合反应,是一种有机化学反应,指的是含有α-氢原子的醛或酮,在酸或碱的催化下,与另一分子醛或酮发生加成反应,生成β-羟基醛或酮,然后进一步受热失水形成α,β-不饱和醛或酮,以及其它一系列有机化合物的反应过程。
其反应机理如下:
在酸性条件下,羰基化合物(如醛或酮)会异构化成为烯醇,这种烯醇具有很强的亲核性,然后它会与另一分子羰基化合物进行加成,生成β-羟基羰基化合物。
而在碱性条件下,羰基α位氢的酸性较大,可以在碱的作用下去质子化,形成亲核性较强的烯醇负离子,然后与另一分子羰基化合物加成,同样生成β-羟基羰基化合物。
这个反应实际上是一个羰基化合物分子间的亲核加成反应,通过这种反应可以合成碳原子数比原来醛或酮增加一倍的醇或醛。
除了乙醛外,其他醛发生Aldol缩合得到的产物都不是直链的,而是原α-碳原子上带有支链的化合物。
因此,Aldol反应在有机合成中占据着重要地位,是构建β-羟基羰基化合物的一种重要方法。
以上信息仅供参考,建议查阅专业化学书籍或咨询化学专业人士获取更全面准确的信息。
醛酮
5、与磷叶立德的加成反应 磷叶立德的制备:
ph3P: + RCH 2-X + ph3P-CH2R + B B- = n-C4H9Li phLi
+ ph3P-CH2R + X + ph3P-CHR ph3P=CHR
磷叶立德 (魏悌希试剂)
醛(酮)与磷叶立德(含碳的亲核试剂)的Wittig反应 :
C=O + ph3P=CHR
O RMgX (CH 3)2CH-C-CH(CH 3)2 OMgX (CH 3)2C=C-CH(CH 3)2
O (CH 3)2CH-C-CH(CH 3)2 H(CH 3)3CMgX MgBr CH2-C-CH 3 H CH3
OH (CH 3)2C=C-CH(CH 3)2 RMgX
+ RH
烯醇化反应
OMgX (CH 3)2CH-C-CH(CH 3)2 H 还原反应 + CH2=C(CH3)2
CH3 OH
O Mg / (C2H5)2O CH3I CH3MgI CH3 OH H3O+
O CH3MgI
OH CH3
O BrCH 2CH2CH2-C-CH 3
O CH3MgI
O Mg / THF BrCH 2CH2CH2-C-CH 3 H3O+
OH CH3
位阻特大的醛、酮与格氏试剂不反应。
可以发生烯醇化反应或还原反应。例如:
C=O: + H + + C=O: H + C=O: H + C-O: H
保护羰基。
CH2=CH-CHO CH2-CH-CH O OH OH
C2H5OH / 无水HCl
OC2H5
原创——醛、酮化学反应归纳
原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
含-H的酮或其它容易烯醇化的羰基化
C COOH 1 C _H O HC H 2 1 N OH H + H2N CH3 + C H2C C H O COOH O H 3-氧代戊二酸 1,4-丁二醛 H3C N _ H2O HOOC
H2C
NR2''
H
H
an iminium ion
14
厦门大学 黄培强 2009-3-23
19.1、Mannich反应-II
适应范围: 碳亲核体:含α-活泼H的酮,β-酮酸、 β-酮 酯、硝基化合物、末端炔,酚的邻、对位,吲 哚的3-位等。 醛:甲醛,其它醛; 胺:仲胺,伯胺 预制的亚胺鎓: [(CH3)2N=CH2]+, I 条件:H2O,EtOH,或HOAc中,加HCl; 或 胺HCl盐。 非对称酮得到混合物
CH3 H + O H H C CH3 CH OH O 65% CH3
1
C H3C O
O H3C
C5 O
1,5-diketone Mechanism: step 1: Michael addition CH3 H O
厦门大学 黄培强 2009-3-23
CH3 OH O
H H C
CH3 C CH
H
H
OH
O
EtOH
O
O
厦门大学 黄培强 2009-3-23
19.4、Acylation of esters
O H3C C CH3 acetone (pKa = 20) + Base: O H3C C CH3 H2 C O C CH3
enolate of acetone O H2C C OCH3 O C OCH3
羰基化合物的反应
23
_ Nu R' R O _
R and/or R’ = stereogenic diastereotopic
24
构象分析确定产物的立体化学:Cram规则 开链模型 (S: smallest; M: medium; L: largest)
OH + B
20
例:醛、酮对HCN的加成 碱催化
HCN + A-
fast
HA + CNOCN
O + -CN
slow
O+ H-A CN
fast
OH
+ A-
CN a cyanhydrin
21
醛、酮与HCN加成的平衡常数(20C, 96%EtOH)
R1 O + HCN R
R1 R2 K R1 R2 K 环酮 K Ph H 236 Me Me 33 环戊酮 48
SR thiol esters √
OC6H4NO2(Opnp) p-nitrophenyl ester √
√ √ √
√ √ √
√ √
√ √
H-(AlH4-) √
R- S2O32-, RO2-, OCl - √
√
√
√ √
√
√ √
√
√
√
13
7.3 羰基加成可能的反应进程图
O + :Nu
-
k1 k-1
O
16
-
O
O + Nu+ HA
Nu + A
HO (c)
Nu + A
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
The Mannich Reaction: Mechanism
O H
O R C CH2R'
H
+
OH
R' C C CH2 NR2'' R a β-aminoketone a Mannich base
R' C CH an enole R
H+ HNR''2 O C
H+ HO C H2
NR''2
+ H+ -H2O
O C
BF3
O H3C
O H3C O BF3 COCH3 CH3CO + CH3COOBF3
33
厦门大学 黄培强 2009-3-23
1,3-二羰基化合物: 含活泼亚甲基化合物 三种共振极限式
C OR' R C R' H2 H2 β-羰基(酮)酸酯 β-二酮 N C O C O C
R
O C
O C
O C
O C
RO
C OR' H2 丙二酸酯 O C
O C
O C
C H2
OR
O2N
氰酸酯
厦门大学 黄培强 2009-3-23
C OR H2 硝基酸酯
H2C
NR2''
H
H
an iminium ion
14
厦门大学 黄培强 2009-3-23
19.1、Mannich反应-II
适应范围: 碳亲核体:含α-活泼H的酮,β-酮酸、 β-酮 酯、硝基化合物、末端炔,酚的邻、对位,吲 哚的3-位等。 醛:甲醛,其它醛; 胺:仲胺,伯胺 预制的亚胺鎓: [(CH3)2N=CH2]+, I 条件:H2O,EtOH,或HOAc中,加HCl; 或 胺HCl盐。 非对称酮得到混合物
两分子酯在碱作用下加成, 脱去一分子醇,生成β-酮酯的反应。
O H3C C OC2H5 1) C2H5O 2) H C2H5OH O H3C C O C C OC2H5 H2
+
H O
H2C C OC2H5
厦门大学 黄培强 2009-3-23
a β-keto ester
"三乙” 乙酰乙酸乙酯
25
Claisen Condensation: Mechanism
O H3C C OCH3 + Base: methyl acetate (pKa = 24) O R C O R
厦门大学 黄培强 2009-3-23
H2 C
enolate of methyl ester
R
O C O R
R
O O C CH2 C R'
24
19.4.1、The Claisen Condensation: Synthesis of β-ketoesters
Acid-Catalyzed Acylation of Ketones 酸催化的酮酰基化
H3C CH3 + acetone O C BF3 O (CH3C)2O H3C CH2 80-85% O C O C CH3 BF3 CH2
H3C
O C
BF3 CH3 BF3 O COCH3 H3C
O C
BF3 CH2 H -H+ H3C
缩合, 主要用于5,6员环的合成
H2C CH2 O COCH3 1) CH3O 2) H O COCH3
H2C H2C COCH3 O
C H + CH3OH C O a β-keto ester O COCH3
H
O CH2CH2COCH3 1) CH O H2C 3 H2C CH2COCH3 2) H
应用:1、各种Mannich碱,包括环状化合物的合成。 Robinson托品酮合法成(仿生合成,1904)。
C COOH 1 C _H O HC H 2 1 N OH H + H2N CH3 + C H2C C H O COOH O H 3-氧代戊二酸 1,4-丁二醛 H3C N _ H2O HOOC
O O O H, heat C2H5O C C CH2CH2CCH3 HO C CH CH2CH2CCH3 H H2O
20
厦门大学 黄培强 2009-3-23
19.3、Robinson Annulation环合Reacion Micheal addition + Aldol condensation
O HC C OC2H5 CH3 an ester enolate
OCH2CH3 O C OC2H5 H3CH2C C CH3 + CH3CH2OH
26
H3CH2C
O C
C CH3
厦门大学 黄培强 2009-3-23
β-酮酯 (pKa = 11)
Driving force
19.4.2、β-Dicarbonyl Compounds: 含活泼亚甲基
厦门大学 黄培强 2009-3-23 15
1947:Sir Robert Robinson Oxford University UK
for his investigations on plant products of biological importance, especially the alkaloids.
CH2 O C CH3 H2 OC2H5 C C O
O H3C CH2 + H2C
H C
pKa 11 COOC2H5
厦门大学 黄培强 2009-3-23
C O
OC2H5 C2H5O Na C2H5OH
O H3C
CH C H2
C2H5OOC
19
The Michael Addition Reaction
Intramolecular version O 1 1) NaOCH2CH3 5 COOEt 2) H O O
90% 酸催化的酮的酰基化需用更活泼的酸酐 O O O O BF3 C C C + (CH3C)2O H3C CH2 CH3 H3C CH3 acetone 80-85%
厦门大学 黄培强 2009-3-23 32
22
CH3 O H OHCH3 O源自O H 2CO O
OH OH
CH3 O
CH3 O OH
OH H H
厦门大学 黄培强 2009-3-23
Robinson Annulation: further examples
COOC2H5 NaOC2H5 O O OCH3 OH O O O
23
COOC2H5 O OMe
O COOC2H5 H O H C C C CH3 C2H5O C C H H 1 malonic ester enolate O COOC2H5 O COOC2H5 C2H5O C C CH2CH2CCH3 H C H H 1,4-addition product COOC2H5 90% C2H5O Na COOC2H5 O 2 C2H5OOC O H2 H O C2H5O C C C C C CH3 H 3. C2H5O H 4. Tautomerization O O H2 HO C C CH2CH2CCH3 1,5-keto acid COOH
a β-diketone O O C O 1) CH3O Na O C
+ C2H5O OC2H5 diethyl carbonate 2) H3O
厦门大学 黄培强 2009-3-23
OC2H5
a β-keto ester
31
Ketone-ester Claisen Cross Condensation: suite
19.1、Mannich Reaction-I
含α-H的酮或其它容易烯醇化的羰基化 合物 与醛(甲醛)及仲胺反应产生β-胺基酮 的反应。
O R C CH2R' + H O C H + HNR''2 水或醇 H
+
O H R' C C CH2 NR2'' R a Mannich base
13
厦门大学 黄培强 2009-3-23
O (pKa = 15.9) H CH C HOCH2CH3 3 2 O H2C C OC2H5 (pKa = 24.5) CH3 deprotonation OCH2CH3 H addition C OC2H5 O H3CH2C C OC2H5 O CH C OC2H5 CH3 酯的酰基化 O C O C OC2H5
C O H3 C
O C O H 3C
21
Robinson Annulation: Mechanism –Suite
step 2: Intramolecular aldol reaction CH3 CH3 C O O H 2C H HO step 3: Dehydration CH3 O OH OHH
A, A' = CHO, COR, COOR, NO2, CN, SO2Ph
18
厦门大学 黄培强 2009-3-23
The Michael Addition Reaction: Synthesis of 1,5- Dicarbonyl Compounds
O C2H5O CH2 COOC2H5 + H2C H C O C O CH3 C2H5O Na C2H5OH C2H5O CH H2C O OC2H5
Robinson托品酮合法成(仿生合成,1904); Robinson环合
O O + O O O
_ 2H O 2 - 2 CO2
厦门大学 黄培强 2009-3-23
1,4-丁二醛
O COOH C H + CH3NH2 + O C H COOH O
