配位化合物
第五章配位化合物

[Ag(S2O3)2]3-, [Fe(CN)6]4-, [Fe(SCN)6]3-, [HgI4]2- , [Fe(CN)6]3-等 或原子)和一定数目 配位单元:由中心离子(或原子 配位单元:由中心离子 或原子 和一定数目 的中性分子或阴离子以配位键结 合而成的中性分子或复杂离子。 合而成的中性分子或复杂离子。 [Ni(CO)4], [Co(NH3)3F3], [Pt(NH3)2Cl2], K3[Fe(SCN)6], [Ag(NH3)2]NO3。 配合物: 含配位单元的化合物。 配合物 含配位单元的化合物。
6
{
多齿配体数≠( ) 多齿配体数 (<) 配位数 中心离子的配位数一般等于其电荷数的二倍 如:M+——2、M2+——4、M3+——6 、 、 ④.配离子的电荷数 a. 配离子的电荷数等于中心原子的氧化数 和配体总电荷数的代数和。 和配体总电荷数的代数和。 b. 外层电荷数的相反数。 外层电荷数的相反数。 K3[Fe(SCN)6] [Ag(NH3)2]NO3 中心离子的电荷数: 中心离子的电荷数 +3(Ⅲ) +1(Ⅰ) [Pt(NH3)2NO2NH2 Cl2] +4(Ⅳ) Ⅳ
13
[Co(NH3)5(ONO)]Cl2 氯化亚硝酸根•五氨合钴 Ⅲ) 氯化亚硝酸根 五氨合钴(Ⅲ 五氨合钴 六氯合铂( 六氯合铂(Ⅳ)酸 H2[PtCl6] Na3[Ag(S2O3)2] [Cu(NH3)4](OH)2 K3[Fe(SCN)6] 二硫代硫酸根合银(Ⅰ 酸钠 二硫代硫酸根合银 Ⅰ)酸钠 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 六硫氰合铁(Ⅲ 酸钾 六硫氰合铁 Ⅲ)酸钾
12
首页 上页 下页 返回
[Ag(S2O3)2]3[Cr(NH3)5(H2O)]3+ [Cu(NH3)4]2+ [Fe(NH3)2(en)2]3+ [Co(NH3)5(ONO)]2+ [Cr(NH3)3Cl3]
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
配位化合物

• 配位反应与氧化还原反应的关系 配位离解平衡与氧化还原平衡的关系,主 要体现在配位化合物的生成对电极电势的影 响。
根据能斯特方程: 若氧化型生成配位化合物,浓度减小,则E减小; 若还原型生成配位化合物,浓度减小,则E增大。
中心原子(阳离子或原子)与一定数目的配体(离子或 中性分子) ,通过配位键结合,并按一定组成和空间 构型形成的复杂离子称为配离子
例如, [Cu(H2O)4] 2+
含有配离子的化合物以及中性配位分子统称为 配合物。 例如, H[AuCl4] 、[Co(NH3)Cl3]
配位键 配体 中心原子
[Cu (NH3)4]SO4 [Cu (NH3)4]2+
• 当配位体接近中心离子时,为了增强成键 的能力,中心离子用能量相近的空轨道进 行杂化,形成数目相同,能量相等的具有 一定方向性的杂化空轨道,以容纳配位体 提供的电子形成配位键。配离子的空间构 型、配位数及稳定性等主要取决于杂化轨 道的数目和类型。 • M :L(L代表配位体)
第三节 配位化合物的离解平衡
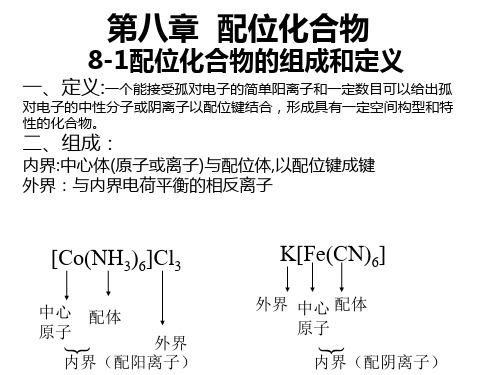
中 心 离 子 配 位 配 体 位 原 子 配 位 数 离 子 电 荷
内界(配离子)
外界 SO42-
内界
在配合物化学式中用方括号表示内界。 配合物的内界能稳定地存在于晶体及水溶液中。 它是配合物的特征部分,它的结构和性质与其他离 子不同。 如: [ Cu (NH3) 4 ]2+
外界
不在内界的其他离子,如SO42- 构成配合物的外界。 写在方括号外,
单齿配体:一个配体中只有一个配位原子 例如: Ag+ 与NH3 结合
配位化合物

Ni2+可以利用丁二肟在氨溶液中与Ni2+配位生成桃红 色絮状螯合物沉淀物来鉴定。
首页
上一页
下一页
末页
32
利用硫氰根负离子可以与Co2+形成蓝紫色的四硫氰 根 合 钴 ( II ) [Co(SCN)4]2- 来 检 验 Co2+ 的 存 在 。 与 Fe3+形成血红色配合离子可供检验Fe3+的存在。
K4[Fe (CN)6]
六氰合铁(Ⅱ)酸钾
H4[Fe (CN)6]
六氰合铁(Ⅱ)酸
[Co(NH3)5H2O]Cl3
氯化五氨·水合钴(Ⅲ)
首页
上一页
下一页
末页
18
配合物的类型
(1)简单配合物 由单齿配体与中心原子直接配位而成的配位化合 物。
例:[Ag(NH3)2]+ BF4[Fe(H2O)6]Cl3 [CoCl3(NH3)3] 等
28Ni 3d84s2 3d
Ni2+
4s 4p
[Ni(CN)4]2-
dsp2杂化
CN- CN- CN-CN-
首页
上一页
下一页
末页
24
[NiCl4]2-的空间构型为四面体。
28Ni 3d84s2
3d
Ni2+
4s 4p
[NiCl4]2-
3d sp3杂化
4s
4p
Cl- Cl- Cl- Cl-
首页
上一页
下一页
首页
上一页
下一页
末页
38
配合物与配位作用用于医学
什么是配位化合物?络合反应?

什么是配位化合物?络合反应?配位化合物和络合反应是无机化学中的重要概念。
配位化合物是由一个中心金属离子与络合体中化合物中的配体配位形成的化合物。
而络合反应就是配体与金属离子之间的配位过程。
一、配位化合物的定义及特点配位化合物是由一个中心金属离子与一个或多个配体通过均一或均四电子共轭配位键构成的化合物。
配体可以是有机物,也可以是无机物。
配位化合物可以具有很多不同的性质和应用。
1. 配位键配位键是指金属离子与配体之间的化学键。
根据不同的金属离子和配体,配位键可以分为配位共价键、氢键、离子键等。
配位共价键是对称的、电性的、共价性的。
氢键是轻元素或者氢与非金属之间形成的一种特殊化学键。
离子键是由电负性不同的原子或离子之间形成的化学键。
2. 配位度配位度是指配位体中与金属离子形成配位键的配位原子或配位基团的个数。
例如,水为配体的配位度为2,而乙二胺为配体的配位度为2。
3. 配位数配位数是指配位化合物中一个金属离子周围配位体数目的总数。
例如,六配位化合物的配位数为6。
4. 配位子配位子是指形成配位化合物的配体或配体的综合物。
配位子可以是一个原子或一个离子,也可以是一个配体络合物或一个配体的反应物。
二、络合反应的机理及应用络合反应是指金属离子与配体之间形成配位化合物的化学过程。
络合反应可以通过配位键的形成和断裂来实现。
1. 配位键的形成配体通过自旋被阻止以及相互接近的方式与金属离子形成配位键。
配位键的形成过程涉及电子供体与电子受体之间的配体静态效应和动态效应。
2. 配位键的断裂配位键的断裂是指配位体离开金属离子所需的能量。
配位键的断裂通常涉及与其他配体相互作用,或者通过外界条件改变。
3. 应用领域络合反应在无机化学、有机化学、生物化学以及材料科学等领域具有广泛的应用。
在无机化学中,络合反应可用于合成具有特定性质的金属配位聚合物和金属配位材料。
在有机化学中,络合反应可用于合成金属有机化合物,如金属有机催化剂。
在生物化学中,络合反应在生物体内维持金属离子的稳定性和活性。
什么是配位化合物

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
配位化合物

[Cu(NH3)2]Ac + CO + NH3 ===== [Cu(NH3)2]Ac.CO
减压加热
H = -35kJ
Cu2+ + 5CN- = Cu(CN)43- + 0.5(CN)2 K稳 =2×1030 (极为稳定,加入H2S也无沉淀,Ksp=2.5×10-50))
Cu(CN)4 3 - + e == Cu + 4CNE = -1.27V Zn(CN)42- + 2e == Zn + 4CNE = -1.26V 这两个电对的电势值相近,所以镀黄铜(Cu-Zn合金)所 用的电镀液为上述混合物.
[AlCl4][BF4][AgI4]2- 从这些配离子你看出配位数有什么规律? 从这些配离子你看出配位数有什么规律?
二,化学键理论
维尔纳(Werner.A):Nobel Prize提出三点: 维尔纳( 提出三点: 提出三点 1,主价和副价 , 主价指氧化数,副价指配位数. 主价指氧化数,副价指配位数. 2,倾向于既要满足主价,又要满足副价. ,倾向于既要满足主价,又要满足副价. 3,副价指向空间的确定位置. ,副价指向空间的确定位置. 1,价键理论:中心离子和配位原子都是通过杂化了的共价配位键 ,价键理论: 结合的. 结合的. (1)配位键的本质: )配位键的本质: a,σ配位键: 配位键: , 配位键
2,复盐 ,
CsRh(SO4)2.4H2O + BaCl2 无沉淀出现. 无沉淀出现. [Rh(H2O)4(SO4)2]-(二硫酸根四水合铑(III)) 二硫酸根四水合铑( )) 二硫酸根四水合铑 KCl.MgCl2.6H2O不是配合物 不是配合物
3,组成 ,
(1)配位体:是含有孤电子对的分子和离子 )配位体:
配位化合物知识总结

VS
磁性配合物在磁学、磁记录、信息存 储和分子基磁体等领域有广泛的应用 前景。
Part
04
配位化合物的应用
在化学反应中的作用
催化反应
配位化合物可以作为催化剂,通 过与反应物结合,改变反应途径,
降低反应活化能,从而加速化学 反应的进行。
分离和提纯
利用配位化合物的独特性质,如选 择性络合、稳定性差异等,可以实 现化学物质的分离和提纯。
配位化合物的稳定性取决于多个因素 ,包括中心离子的性质、配位体的类 型和数量、以及配位环境等。
稳定性规律
一般来说,中心离子的电荷数越高、 半径越小,配位化合物的稳定性越强 ;配位体的电子给予能力越强、数目 越多,稳定性也越高。
配位化合物的合成方法
有机合成
通过有机合成方法,可以制备出结构复杂、功能多样的配 位化合物。常见的合成方法包括重氮化反应、氧化还原反 应等。
配位化合物的分类
按中心原子分类
根据中心原子的种类,可以将配位化合物分为金属配位化合物和非金属配位化合物。金属配位化合物是指中心原 子为金属元素的配位化合物,如铜、钴、铁等;非金属配位化合物是指中心原子为非金属元素的配位化合物,如 硫、氮、磷等。
按配位数分类
根据配位数的大小,可以将配位化合物分为低配位数(2-4)和高配位数(≥6)的配位化合物。低配位数配位化 合物是指中心原子周围参与配位的配位体数目较少的配位化合物;高配位数配位化合物是指中心原子周围参与配 位的配位体数目较多的配位化合物。
02
动态配位化合物
03
超分子配位化合物
具有可逆的结构变化和反应性, 可用于传感器、分子机器等领域。
由多个分子或离子通过非共价相 互作用形成的复杂结构,具有独 特的物理和化学性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物基本概念
配离子的中心离子一般为过渡金属,特别是铁系、 内界 (配离子) C H2 铂系、第IB、IIB族元素。 CH 2 2 + 配体为水、氨等中性分子或卤离子、拟卤离子 NH2 2 + 2-
位 H中心离子与配体之间的化学作用力叫做配位键, N Cu O C 2 外 2 中 配 配 一般是中心原子接受配体中的某原子的孤对电子形成 原 Cu 配 SO 界 4 心 H 的。中心原子周围的配位原子的个数叫做配位数。 子 2C 位 位 位 O 离 O 原 原体 数 H子 N子 NH3 子 3含配位键的结合物都可以统称配合物。配合物不一 定是离子,也可以是中性分子。 C C 乙氨酸铜 配合物 O 配体中只有一个配位原子叫单齿配体,有多个配位 H2
m
C C 四面体配合物的 4 个配体不同时会出现一对异构体, D D A 镜面 C D C C BA CD M M 这对异构体的空间相互关系可按如图理解: M D B A D A B M B A C A B M B M A C A B B C A AC A AA M C C 上左图将一对异构体的一个配体 (D) 的位置固定 ( 向 M B M M MM B M A A C B C A C A B C B B C B A B 上),便发现另三个配体具有相反的螺旋排列,一个是 B B C B A映 异 构 体 A 固定一个配体(D)后 三顺式有对 B 反时针方向,另一个为顺时针方向,就好比两个螺旋相 在空间不能 互为镜像的关系 CC 另三个配体具有相反的 C 完全重合 反的螺丝钉。 C 螺旋(顺反时针)的排列 三反式 AA 三顺式 一反二顺式 A 四面体的这对异构体又如同左右手一样在空间不能 C CB B 4 个配体不同的四面体配合物具有手性 A M M M 重合 ),一个是左手 M M(AABBCC)有5种几何异构体 A A (中图,恰如你不能把左手套戴到右手上 A B ),因而称 BC C 体另一个则为右手体 ,它们互为镜像关系 (右图 A BB 为对映体。这类异构因而称为对映异构 ,又叫手性异构。 B B 请注意:几何异构与此绝然不同,属于非对映异构。 左 上图 右 边 的 对 映 体 以 上 下 取 向 的 轴 旋 转 180度 六配位络合物的异构现象要复杂多样得多,下面只 后 , 去 和 左 边 的 对 映 体 叠 合 ,就 可 发 现 它 们 是 是其中一个例子,其余的留给同学自己思考。
等也可作为配位体,H-可以同第III族的硼、铝、镓等
化合形成很有用的还原剂,如Li[AlH4]。H-还可以同
过渡元素形成[Co(CO)4H]、[Fe(CO)4H2]等化合物。
在-配合物中,配位体中没有孤电子对,而是提
供电子形成配键,同时金属离子(或原子)也提供电
子,由配位体的反键空*轨道容纳此类电子形成反馈 [Pt(C2H4)Cl3]-中Pt--C2H4之间的化学键 键,如1825年发现的蔡斯盐K[Pt(C2H4)Cl3]。
显然,这是由于双齿配体草酸根离子的“胳膊” H3N Cl H3N OH 不能反应 不够长,不可能形成反式的配合物。 两种不同的二氨二氯合铂异构体的不同的化学性质 上述的这类具有顺式和反式的异构现象称为顺反 异构,也叫几何异构。
Pt
H2O
HO
NH3
Pt
M(AABBCC)的异构体
配位化合物的立体异构 C C
原子的叫多齿配体(又分双齿、三齿、四齿等等)。由多 齿配体形成的环状配合物又被形象地叫做螯合物。
H Cu(NH ) -等)、羟离子 -)、酸根离子等离子。 H N (CN (OH 3 4 NH 配 SO4 3 3 C N O F P S Cl Br
配合物基本概念
负氢离子(H-)和能提供健电子的有机分子或离子
(Ph)3P (Ph)3P
Pt
Cl Cl
配位化合物的立体异构
Cl 当一种配合物中有不同的配体时,常常出现立体 Cl NH3 Cl NH3 异构体。下面是一些例子: Pt Pt Pt NH 3 K [PtCl4]用氨水处理得到一种棕黄色 四氯铂酸钾 Cl Cl NH3 NH3 2 H3N Cl 的配合物,经测定,组成为 [PtCl2(NH3)2] ,有极性, 顺式 反式 四面体构型 0.26g/100gH O; 在水中的溶解度是 2 transcis不可能有立体异构体 将这种棕黄色配合物用氯化氢处理或者热至 二氨二氯合铂的可能构型 250℃,转变为浅黄色 ,经测定,组成仍为[PtCl2(NH3)2],但 极性消失,在水中的溶解度减小至 0.037g/100gH2O。怎 样来分析这些事实呢? 首先可以肯定,这两种四配位络合物的几何构型 不是四面体而是平面四边形的,这是因为,如果是四 面体, [PtCl2(NH3)2] 不可能出现异构现象,而平面四 边形的[PtCl2(NH3)2]则可以有两种异构体:
配位化合物的立体异构
顺式 顺式 顺式 由实验得到的其他信息可以判定,棕黄色的异构 cisciscis体是顺式的,浅黄色的异构体是反式的。
Cl NH3 O H3N OH 为进一步验证,先对配合物进行水解处理,令 H N O H2O 3 草酸 C Pt Pt OH-离子取代Cl-离子,使之转化为组成为 Pt Cl NH3 C H3N OH H N O 3 [Pt(OH)2(NH3)2]的配合物,然后令它们分别与草酸反O 反式 反式 应。结果是:前者能形成新的配合物而后者不能。这 transtrans个事实可以解释为: Cl NH3 草酸
配ቤተ መጻሕፍቲ ባይዱ物的命名
配合物的命名比一般无机化合物命名更复杂的地方 在于配合物的内界。 处于配合物内界的配离子,其命名方法一般地依照 如下顺序:配位体数、配位体的名称(不同配位体名称之 间以中圆点(· )分开),“合”,中心离子名称,中心离子 氧化态(加括号:用罗马数字注明)。 若配离子中的配位体不止一种,在命名时配体列出 的顺序按如下规定: (1)在配位体中如有无机配体又有有机配体。无机配 体排列在前,有机配体排列在后。如cis-PtCl2(Ph3P)2], 应命名为顺-二氯· 二(三苯基膦)合铂(II)。 (2)在有多种无机配体和有机配体时。先列出阴离子的 名称,后列出阳离子和中性分子的名称。
配位化合物
基 本 概 念 配 合 物 的 命 名
配 合 物 的 空 间 结 构
价 键 理 论
配 合 物 的 稳 定 性
配 位 化 合 物 的 应 用
配合物基本概念
分析证实,硫酸铜无论其是水溶液还是晶体,天蓝 色都是四水合铜离子[Cu(H2O)4]2+产生的颜色。 向硫酸铜溶液滴加过量氨水,得到深蓝色的透明溶 液,若蒸发结晶,可以得到深蓝色的四氨合硫酸铜晶体。 无论在氨水溶液里还是在晶体里,深蓝色都是四氨 合铜离子[Cu(NH3)4]2+产生的颜色。 取少量硫酸四氨合铜晶体用水溶解后滴加过量浓盐 酸,得到黄色透明溶液,分析证实,其中存在四氯合铜 酸根离子[CuCl4]2-。并能在晶体里存在。 我们把像[Cu(H2O)4]2+、[Cu(NH3)4]2+、[CuCl4]2-这 样的由金属原子与中性分子或者阴离子结合形成的复杂 离子叫做配离子(络离子),其中的金属原子是配离子形 成体或中心原子,其中的H2O、NH3、Cl-等叫做配体。
