实验七双乙二胺水杨醛西佛碱合钴配合物的合成及载氧功能
钴席夫碱配合物

钴(Ⅱ)Schiff碱配合物制备及其氧合性能化学学院杨柘摘要:本文陈述了一种新型钴(Ⅱ)Schiff碱配合物的制备,简要阐述了其紫外中的紫移和蓝移现象和红外中的一些特征峰,并同时测定了该配合物的氧合性能。
本文着重于配合物的制备,表征和配位氧的测定,而对于氧合作用的细致机理未能深入探究。
关键词:钴(Ⅱ)配合物,schiff碱,氧合作用1.简介具有载氧性能的Co(Ⅱ)Schiff碱配合物的研究是生物无机化学的一个重要内容,这是因为这类配合物具有类似于生物氧载体的性质。
为了弄清生物体内结构复杂的氧载体与氧分子相互作用的机理,特别是活性中心和氧的成键情况,人们除了直接用天然氧载体作为研究对象外,还合成了许多结构较简单的模型化合物(也称仿生氧载体)来进行研究。
1938年Tsumaki首次报道了能够可逆吸-脱附氧的氧载体Co(Ⅱ)(Salen)。
采用液相方法合成的Co(Ⅱ)(Salen)配合物在低温下有很好的氧合可逆性,早期的研究认为Co(Ⅱ)(Salen)形成了1:1超氧型配合物,后来的研究表明更趋向形成了2:1的μ-过氧型配合物,由于其应用的可能性,合成人工氧载体这一课题开始得到人们的广泛关注。
20世纪60年代后期,人们集中研究了钴的多胺配合物在水溶液中的氧合性质。
研究表明,多胺-钴配合物在水溶液中每2mol配合物吸收1mol氧气,形成双核过氧桥配合物。
同时Floriani和Calderazzo以及Basolo等人研究了水杨醛亚胺合钴及其衍生物的载氧能力,发现某些Schiff碱的配合物在非水溶剂中能够以1:1或1:2的比例吸附氧。
因氧合配合物中参与配位的分子氧的结合是可逆的,在受热等条件下分子氧可被释放出来,失氧后的配合物仍对分子氧有一定活性。
2. Co(Ⅱ)Schiff碱配合物的制备2.1 N,N’-双(4-羟基-3-甲氧基苯亚甲基)三乙烯四胺(配体L)的合成将香草醛20mmol溶于40ml乙酸乙酯中,三乙烯四胺10mmol溶于20ml相同溶剂中,在10℃电磁搅拌下,把三乙烯四胺的溶液缓慢加入到醛中,迅速产生浅黄色沉淀,30min滴完,再继续搅拌1h后将沉淀过滤,用乙醚洗涤数次,硅胶干燥,得到浅黄色固体粉末L1。
实验项目卡--水杨醛乙二胺希夫碱的合成
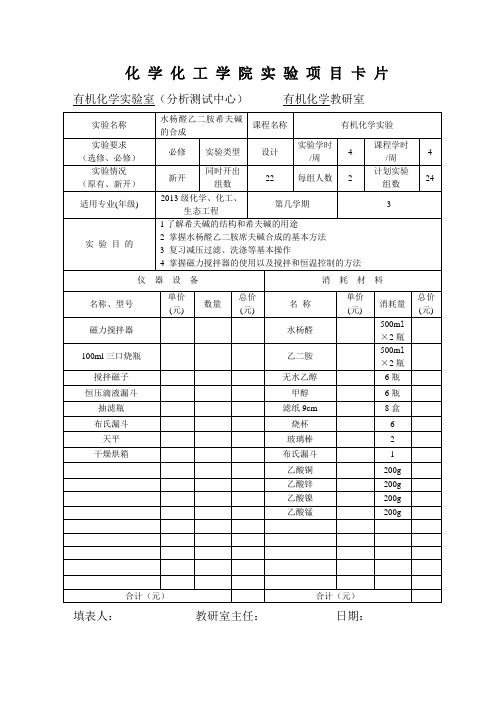
有机化学实验室(分析测试中心)有机化学教研室
实验名称
水杨醛乙二胺希夫碱的合成
课程名称
有机化学实验
实验要求
(选修、必修)
必修
实验类型
设计
实验学时/周
4
课程学时
/周
4
实验情况
(原有、新开)
新开
同时开出组数
22
每组人数2Fra bibliotek计划实验组数
24
适用专业(年级)
2013级化学、化工、生态工程
500ml×2瓶
搅拌磁子
无水乙醇
6瓶
恒压滴液漏斗
甲醇
6瓶
抽滤瓶
滤纸9cm
8盒
布氏漏斗
烧杯
6
天平
玻璃棒
2
干燥烘箱
布氏漏斗
1
乙酸铜
200g
乙酸锌
200g
乙酸镍
200g
乙酸锰
200g
合计(元)
合计(元)
填表人:教研室主任:日期:
第几学期
3
实验目的
1了解希夫碱的结构和希夫碱的用途
2掌握水杨醛乙二胺席夫碱合成的基本方法
3复习减压过滤、洗涤等基本操作
4掌握磁力搅拌器的使用以及搅拌和恒温控制的方法
仪器设备
消耗材料
名称、型号
单价
(元)
数量
总价
(元)
名称
单价
(元)
消耗量
总价
(元)
磁力搅拌器
水杨醛
500ml×2瓶
100ml三口烧瓶
乙二胺
[Co(II)Salen]配合物的制备及载氧实验装置的改进
![[Co(II)Salen]配合物的制备及载氧实验装置的改进](https://img.taocdn.com/s3/m/67d898f8ac51f01dc281e53a580216fc700a538e.png)
大 学 化 学Univ. Chem. 2022, 37 (5), 2112008 (1 of 8)收稿:2021-12-01;录用:2021-12-07;网络发表:2022-04-15*通讯作者,Email:******************.cn基金资助:山西省高等学校教学改革创新项目(J2021097, J2021099, J2020033, J2020013);山西省应用基础研究计划面上青年项目(201901D211152);山西省高等学校科技创新资助项目(2019L0047)•化学实验• doi: 10.3866/PKU.DXHX202112008 [Co(II)Salen]配合物的制备及载氧实验装置的改进郝俊生1,于海英1,邢隆飞1,何迎春2,*,梁琪1,刘涛1,常瑞雪11山西大学化学化工学院,太原 0300062山西大学应用化学研究所,太原 030006摘要:[Co(II)Salen]配合物的制备及载氧实验,以其较强的综合性而被多所高校列为综合化学实验教学项目。
鉴于现有实验装置存在的不足,进行了创新设计与改进:设计、组装了气体稳压稳流装置,使气体可以稳定分配,实现了多组实验同时独立开展,学生实验成功率显著提升;设计、组装了新的载氧装置,采用了三通阀与二通阀并联的方法,实现了对U 型管的氧气吹扫,排除了原装置中残留空气的影响,能够更科学准确地测量吸氧体积;同时,载氧装置全部固定在面板上,关键构件全部采用钢制结构,显著提升了仪器的气密性和使用寿命。
关键词:[Co(II)Salen]配合物;气体稳压稳流装置;载氧装置;创新设计与改进中图分类号:G64;O6Improvement of the Device for the Preparation of [Co(II)Salen] Complexes and Oxygen-Carrying ExperimentJunsheng Hao 1, Haiying Yu 1, Longfei Xing 1, Yingchun He 2,*, Qi Liang 1, Tao Liu 1, Ruixue Chang 1 1 School of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China.2 Institute of Applied Chemistry, Shanxi University, Taiyuan 030006, China.Abstract: The preparation of [Co(II)Salen] complexes and oxygen-carrying experiments are listed as a comprehensive chemistry experiment by many universities. Owing to the drawbacks of the existing experimental equipment, innovative designs and improvements were made as discussed in this paper. The designed device ensured the gas was distributed stably using a steady-pressure and steady-airstream, allowed multi-group experiments to be carried out simultaneously and independently, and improved the success rate of the experiment considerably. A new oxygen-carrying device, in which three-way and two-way valves were installed in parallel, was designed and assembled. The residual air was discharged from the U-shaped tube through oxygen blowing so that the volume of oxygen absorption could be measured more scientifically and accurately. Simultaneously, the oxygen-carrying device was fixed on a steel plate, and the key components were all made of the steel, which significantly improved the air tightness and service life of the instrument.Key Words: [Co(II)Salen] complexes; Steady-pressure and steady-airstream device; Oxygen-carrying device;Innovative design and improvement自然界的生物体中含有多种过渡金属离子的蛋白,如血红蛋白等,在一定条件下能够吸收和放出氧气,以供有机体生命活动的需要[1]。
钴(Ⅱ)席夫碱可逆载氧螯合物的合成

钴(Ⅱ)席夫碱可逆载氧螯合物的合成
桂芳成;安兴民
【期刊名称】《新疆大学学报:自然科学版》
【年(卷),期】1991(008)003
【摘要】本文报道新合成的五种Schiff碱四齿螯合剂,二种五齿Schiff碱螯合剂及相应的钴(Ⅰ)螯合物。
并在-20℃下进行了可逆载氧功能试验,得到了组成为
Co(Ⅱ)L·O_2和Co(Ⅱ)L·PY·O_2的两类分子氧加合物。
并用元素分析,电子光谱,IR,~1H NMR,TGA,磁化率和分子量测定等方法,确定了化合物的组成和分子结构式。
还讨论了影响1:1钴氧加合物的稳定性及可逆载氧速度的因素。
【总页数】9页(P68-76)
【作者】桂芳成;安兴民
【作者单位】不详;不详
【正文语种】中文
【中图分类】O614.812
【相关文献】
1.二价钴,镍氯化物的四齿N4大环席夫碱配合物的合成及表征 [J], 綦尤训;桑立新
2.钴(Ⅱ)Schiff碱螯合物及其氧加合物的合成与表征 [J], 安兴民
3.钴(Ⅱ)Schiff碱螯合物及其氧加合物研究 [J], 赵吉寿;颜莉;李文军
4.D—葡萄糖胺席夫碱铜(Ⅱ)螯合物的合成与表征 [J], 冯长建;刘小鹏
5.钴席夫碱螯合物及其氧加合物热重分析研究 [J], 赵吉寿;李文军
因版权原因,仅展示原文概要,查看原文内容请购买。
钴配合物_实验报告

一、实验目的1. 掌握钴配合物的制备方法。
2. 研究钴配合物的性质,包括颜色、溶解度、氧化还原性质等。
3. 探讨钴配合物在化学工业中的应用。
二、实验原理钴配合物是由钴离子与配位体通过配位键形成的化合物。
配位体可以是氨、氯、水等无机配体,也可以是有机配体如联吡啶、羧酸等。
钴配合物具有多种性质,如颜色、溶解度、氧化还原性质等,这些性质使其在化学工业、催化、药物等领域具有广泛的应用。
三、实验内容1. 实验材料- 钴盐:氯化钴(CoCl2·6H2O)- 配位体:氨水(NH3·H2O)、过氧化氢(H2O2)- 试剂:无水乙醇、浓盐酸、硫酸- 仪器:锥形瓶、滴管、水浴加热装置、抽滤装置、温度计、蒸发皿、量筒2. 实验步骤(1)制备氯化钴氨配合物将一定量的氯化钴溶解于无水乙醇中,加入适量的氨水,搅拌至溶液呈透明黄色。
将溶液转移至锥形瓶中,在室温下放置一段时间,待晶体析出后,抽滤、洗涤、干燥,得到氯化钴氨配合物。
(2)制备三氯化六氨合钴将一定量的氯化钴氨配合物溶解于水中,加入适量的过氧化氢,搅拌至溶液呈橙黄色。
将溶液转移至锥形瓶中,在室温下放置一段时间,待晶体析出后,抽滤、洗涤、干燥,得到三氯化六氨合钴。
(3)研究钴配合物的性质① 颜色:观察制备的钴配合物的颜色,并与标准样品进行对比。
② 溶解度:测定钴配合物在不同溶剂中的溶解度。
③ 氧化还原性质:利用氧化还原滴定法研究钴配合物的氧化还原性质。
四、实验结果与分析1. 颜色氯化钴氨配合物呈透明黄色,三氯化六氨合钴呈橙黄色。
2. 溶解度氯化钴氨配合物在水、乙醇、丙酮等溶剂中溶解度较好,在乙酸乙酯等溶剂中溶解度较差。
3. 氧化还原性质通过氧化还原滴定法测定,氯化钴氨配合物在酸性条件下具有氧化性,可与还原剂发生氧化还原反应。
五、结论1. 成功制备了氯化钴氨配合物和三氯化六氨合钴。
2. 研究了钴配合物的颜色、溶解度、氧化还原性质等性质。
3. 钴配合物在化学工业、催化、药物等领域具有广泛的应用前景。
实验七双乙二胺水杨醛西佛碱合钴配合物的合成及载氧功能

实验七 双乙二胺水杨醛西佛碱合钴配合物的合成及载氧功能一、实验目的1.了解血红蛋白载氧作用的意义,通过配合物的吸氧测量和放氧观察了解配合物的载氧作用机理2.制备非活性的配合物 3.掌握气体测量一般方法二、基本原理生物体内有许多含金属的蛋白质。
这些含金属的蛋白质在一定条件下能够结合或释放氧气,以供生命活动的需要。
例如,含铁的血红蛋白、含铜的血蓝蛋白和含钒的血钒蛋白等都有运输氧的功能。
业已发现,某些不含蛋白质的金属配合物,例如双水杨醛乙二胺西佛碱合钴[Co(Salen)]也同生物体的含金属的蛋白质相似,在一定条件下具有与氧可逆结合的能力。
C = N H2 -CH 2OH ON = C[Co(Salen)]由于载氧体在氧分离、氧化还原剂特别是在血液中氧的输送等研究课题中具有重要的理论和实践意义,所以这类不含蛋白质的金属配合物已引起研究者的广泛兴趣,并在载氧作用研究中被用作模型化合物(Model Compounds )。
由于合成方法不同,配合物[Co(Salen)]存在两种固态结构。
其中一种称为活性型,另一种叫做非活性型。
棕色的活性型[Co(Salen)]在固态两个分子以钴钴相互作用(钴钴间距3.46Å)形成二聚体,暗红色的非活性型[Co(Salen)]在固态两个分子以钴氧相互作用(钴氧间距2.26Å)形成二聚体。
活性型[Co(Salen)]在室温能吸收氧气,而在高温下能放出氧气。
非活性型[Co(Salen)]在室温稳定,不吸收氧气,但在配位溶剂(L )例如,二甲亚砜(DMSO )、二甲基甲酰胺(DMF )、吡啶(Py )中,能与溶剂配位形成活性配合物[LCo(Salen)],后者能迅速吸收氧气形成2:1的加合物[L(Salen)Co-O-O-Co(Salen)L]。
当所使用的溶剂是二甲基甲酰胺时,生成的加合物[(DMF) (Salen)Co-O-O-Co(Salen) (DMF)]是细颗粒状的暗棕色沉淀,不易过滤,宜用离心分离,加合物中Co 和O 的比例气体体积测量法测定。
乙二胺水杨醛双Schiff碱Cr(Ⅲ)配合物的合成与表征

万方数据万方数据万方数据乙二胺水杨醛双Schiff碱Cr(Ⅲ)配合物的合成与表征作者:李艳, 李军喜, 陆兰青, LI Yan, LI Jun-xi, LU Lan-qing作者单位:李艳,李军喜,LI Yan,LI Jun-xi(湖北科技学院核技术与化学生物学院,湖北咸宁,437100), 陆兰青,LU Lan-qing(咸宁高中,湖北咸宁,437000)刊名:化学与生物工程英文刊名:Chemistry & Bioengineering年,卷(期):2013,30(2)1.罗勤慧;沈孟长配位化学 19872.孟庆金;戴安邦配位化学的创始与现代化 19993.Desai M N;Chauhan P O;Shah N Schiff bases derived from chloroanlines as corrosion inhibitors of zinc in sulfuric acid solutions 1995(02)4.Iolio A B;Gennaro A C;Vianello E E Electrochemical reduction of Schiff bases ligands H2 salen and H2 salophen1997(13-14)5.Bastos B R M;Moreira J C;Farias P A M Adsorptive stripping voltammetric behaviour of UO2 (Ⅱ) complexed with the Schiff base N,N'-ethylenebis(salicylidenimine) in aqueous 4-(2-hydroxyethyl)-1-piperazine ethanesulfonic acid medium [外文期刊] 2000(1-2)6.Ma H;Chen S;Niu L Studies on electrochemical behavior of copper in aerated NaBr solutions with Schiff base2001(05)7.赵建章;赵冰;徐蔚青Schiff碱N,N'-双水杨醛缩-1,6-己二胺的光致变色光谱研究[期刊论文]-高等学校化学学报 2001(06)8.陈玉红;丁克强;王庆飞席夫碱应用研究新进展[期刊论文]-河北师范大学学报(自然科学版) 2003(01)9.竹学友;俞志刚;刘洲亚一种新型席夫碱及其铜配合物的合成与抑菌活性的研究[期刊论文]-化学与生物工程 2008(04)本文链接:/Periodical_hbhg201302014.aspx。
水杨醛配西佛碱

本科毕业论文(设计)题目:希佛碱-金属配合物镍(II)的合成与表征学院:化学与化工学院班级:06级应用化学2班姓名:方明指导教师:荆补琴职称:讲师完成日期:2010年06月05日希佛碱-金属配合物镍(II)的合成与表征摘要:本文采用分步合成的方法以水杨醛、乙二胺为原料合成了希佛碱以及它与镍的配合物,并用光度法和红外光谱对希佛碱和其配合物进行了表征。
实验结果表明:实验成功达到了预期的目的,用水杨醛、乙二胺为原料合成了它们的希佛碱以及它和镍的配合物。
关键词:希佛碱;镍;合成目录1前言 (1)2实验部分 (2)2.1合成原理 (2)2.2试剂和仪器 (2)2.3实验步骤 (3)2.3.1希佛碱及其配合物的生成 (3)2.3.2光度法测定配体及其配合物 (3)3结果与分析 (3)3.1配合物溶解性实验 (3)3.2配体与配合物的红外光谱测定 (4)3.3配体与配合物的光度法测定 (6)3.3.1配合物最大波长的测定 (6)3.3.2配合物络合比的测定 (6)3.4配合物的熔点测定 (7)4实验结论 (7)参考文献 (8)致谢 (10)1前言希佛碱是指含有亚甲胺基(Anomthine group)-RC=N-, 并通过是由伯胺与活泼的羰基化合物所形成的一类化合物[1]。
希佛碱是含有亚氨基,并通常由伯胺与活泼的羟基化合物所形成,由于金属中心存在自旋-自选交换作用,具有电子转移功能硝基苯甲醛与对氨基苯酚作为反应物合成希佛碱,两个金属离子之间可来凝结一些小的底物分子,可作为金属蛋白质小分子的模拟物。
希佛碱化合物从结构上可大致分为:单齿希佛碱、双齿希佛碱、不对称希佛碱以及异双希佛碱几类。
由于希佛碱化合物合成工艺简单,产率较高(一般产率会在80%以上),产物毒性低,易分离提纯,因而对希佛碱化合物的应用开发研究发展十分迅速。
其主要的应用研究集中在以下几个方面:(1)催化领域希佛碱分子及其金属配合物在催化领域中的应用非常广泛,希佛碱化合物作为催化剂主要应用于聚合反应、不对称催化反应、烯烃催化氧化方面以及电催化领域[2]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验七双乙二胺水杨醛西佛碱合钴配合物的合成及载氧功能
一、实验目的
1.了解血红蛋白载氧作用的意义,通过配合物的吸氧测量和放氧观察了解配合物的载氧作用机理
2.制备非活性的配合物 3.掌握气体测量一般方法 二、基本原理
生物体内有许多含金属的蛋白质。
这些含金属的蛋白质在一定条件下能够结合或释放氧气,以供生命活动的需要。
例如,含铁的血红蛋白、含铜的血蓝蛋白和含钒的血钒蛋白等都有运输氧的功能。
业已发现,某些不含蛋白质的金属配合物,例如双水杨醛乙二胺西佛碱合钴[Co(Salen)]也同生物体的含金属的蛋白质相似,在一定条件下具有与氧可逆结合的能力。
C = N H
CH 2 -CH 2
O
H O
N = C
[Co(Salen)]
由于载氧体在氧分离、氧化还原剂特别是在血液中氧的输送等研究课题中具有重要的理论和实践意义,所以这类不含蛋白质的金属配合物已引起研究者的广泛兴趣,并在载氧作用研究中被用作模型化合物(ModelCompounds )。
由于合成方法不同,配合物[Co(Salen)]存在两种固态结构。
其中一种称为活性型,另一种叫做非活性型。
棕色的活性型[Co(Salen)]在固态两个分子以钴钴相互作用(钴钴间距3.46Å)形成二聚体,暗红色的非活性型[Co(Salen)]在固态两个分子以钴氧相互作用(钴氧间距2.26Å)形成二聚体。
活性型[Co(Salen)]在室温能吸收氧气,而在高温下能放出氧气。
非活性型[Co(Salen)]在室温稳定,不吸收氧气,但在配位溶剂(L )例如,二甲亚砜(DMSO )、二甲基甲酰胺(DMF )、吡啶(Py )中,能与溶剂配位形成活性配合物[LCo(Salen)],后者能迅速吸收氧气形成2:1的加合物[L(Salen)Co-O-O-Co(Salen)L]。
当所使用的溶剂是二甲基甲酰胺时,生成的加合物[(DMF)(Salen)Co-O-O-Co(Salen)(DMF)]是细颗粒状的暗棕色沉淀,不易过滤,宜用离心分离,加合物中Co 和O 的比例气体体积测量法测定。
三、主要仪器与药品
仪器:天平;抽滤装置;非活性Co(salen)的制备装置;Co(salen)的氧气吸收装置;离心机;离心管。
药品:水杨醛、乙二胺、四水醋酸钴、95%乙醇、二甲基甲酰胺(DMF )、氯仿。
四、操作步骤
1.双水杨醛乙二胺西佛碱[N,N’-bis(salicylaldehyde)ethylenedimine,H 2salen]
向溶有2.45g (2.1mL )水杨醛的沸腾的50ml95%乙醇溶液中加入0.6g (0.675mL )乙二胺。
搅拌5分钟,冷却,抽滤,用少量95%乙醇洗涤所得黄色片状晶体,干燥,称量,计算产率。
熔点,120℃。
2.双乙二胺水杨醛西佛碱合钴[(N,N’-bis(salicylaldehyde)ethylenedimino)cobalt,Co(salen)] 按图安装仪器。
向250mL三口瓶中加入H2salen和100mL95%乙醇。
开动电磁搅拌器,通氮气冲洗以置换反应仪器中的空气,调节氮气流量稳定在1泡/2秒,控制热源温度70-80。
将四水醋酸钴加热完全溶解入15mL热水中,迅速加入反应瓶中,立即有棕色沉淀生成,继续加热搅拌一小时后,棕色沉淀全部转变成暗红色晶体。
冷却,关闭氮气,抽滤,先用5mL水先三次,再用5mL95%乙醇洗涤,在真空干燥器中干燥所得暗红色晶体。
称量,计算产率。
分解点,300℃。
3.配合物的吸氧测定
按图安装仪器。
量气管内装水至略低于刻度“0”的位置。
上下移动水准调节器,赶尽附着在胶管和量气管内壁的气泡。
检查装置是否漏气:打开活塞1和2使反应瓶和量气管系统相通。
把水准调节器下移一段距离,并固定在一定的位置,如果量气管中的液面只在开始稍有下降,随后维持稳定,表明装置不漏气。
若液面继续下降,则说明装置漏气,这时必须检查整个系统,找出漏气原因。
经检查与调整后,重复试验,直至装置不漏气为止。
准确称取0.1~0.15g范围的[Co(Salen)],放进干燥的三口瓶中,量取5mLDMF于密封弯管中,塞紧备用。
打开活塞1和2,使反应瓶、量气管和氧气瓶系统相通,赶尽空气并使氧气充满反应瓶及量气管,关闭活塞2的氧气进口而使量气管与反应瓶相通,再查漏一次,在确认系统不漏气后,把水准调节器移至量气管右侧,使两者的液面保持在同一水平,读出量气管中的液面位置。
旋转密封弯管,使密封弯管中的DMF全部加入反应瓶中。
开动搅拌器,观察反应瓶内
反应物的变化。
每隔2分钟记录一次量气管中的液面位置,直至吸收氧气反应完全止(量气管中的液面位置连续两次的读数接近)。
观察氧加合物在氯仿中的放氧反应
把吸收氧气的加合物转移至两支10mL刻度的离心管中,使两支离心管保持重量平衡,离心分离。
离心完毕,取出离心管,吸走上层清液,保留固体。
沿离心管壁慢慢加入5mL 氯仿,不要搅拌或摇动,细心观察管内的反应现象,并解释现象出现的原因。
五、结果与讨论
1.制备非活性型[Co(Salen)]配合物时,在钴盐溶液加入到配体溶液之前5分钟应开通氮气。
2.在吸氧实验中体系不能漏气。
3.在本实验条件下,[Co(Salen)]配合物与吸收的氧气的摩尔比为2:1。
4.数据记录
室温:
大气压:Pa
室温时的饱和水蒸气压:Pa
5.数据处理
根据下式计算吸收氧气实验中[Co(Salen)]配合物的物质的量
n1=m/M
式中n1为物质的量;m为[Co(Salen)]配合物的质量;M为[Co(Salen)]配合物的摩尔质量(325.233g/mol)。
计算吸收氧气物质的量n2
由已知的数据,求出一定温度和压强下被吸收的氧气体积,根据理想气体定律,计算被吸收氧气物质的量n2
PV=n2RT
根据上述计算结果,求出所吸收的氧气与之间的物质的量的比值n2/n1。
六、思考题
1.在制备非活性型[Co(Salen)]配合物时,为什么要通氮气保护?
2.[Co(Salen)]配合物在溶剂DMF和CHCl3中有两种性质不同的吸氧和放氧作用,试从溶剂的性质来解释其所起的作用?
3.用化学方程式表示[Co(Salen)]配合物的吸氧和放氧过程。
七、参考文献
1.王佰康主编,新编中级无机化学实验,1998,南京大学出版社,84-87。
2.T.G.Appleton,c.,1977,54,443-444。
3.钟山主编,中级无机化学实验,2003,高等教育出版社,86-94。
执笔石尧成。
