乙二胺双缩水杨醛钴配合物的制备和载氧性质
乙二胺双缩水杨醛钴配合物的制备和载氧性质

乙二胺双缩水杨醛钴配合物的制备和载氧性质一.实验目的1.掌握无机合成中的一些操作技术,制备非活性的配合物。
2.了解血红蛋白载氧作用的意义,通过配合物的吸氧测量和放氧观察了解配合物的载氧作用机理。
二.实验原理在自然界的生物体中,有许多含有过渡金属离子的蛋白。
其中有些金属蛋白,例如含铁的肌红蛋白、血红蛋白、含铜的血蓝蛋白和含钒的血钒蛋白等,在一定条件下都能够吸收和放出氧气,以供有机体生命活动的需要,被称为载氧体。
一些简单的金属配合物也具有类似的现象,可作为载氧体的模拟化合物,对了解天然载氧体的结构和反应机理、开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。
乙二胺双水杨醛缩的钴(Ⅱ)配合物[Co(salen)]是研究得最早的钴载配合物的典型代表。
从一般的钴载氧配合物(CoLn)研究中发现,它们与氧的结合可以有两种不同的方式:CoLn + O2 === LnCoO22 CoLn + O2 === LnCo—O2—CoLnCo与O2的摩尔比可以是1:1或2:1,由配体L的性质、反应温度、使用溶剂等条件决定。
[Co(salen)]配合物由于制备条件的不同可以两种不同的固体形态存在,一种是棕褐色的胶状产物[活性型,图(a)],在温室下能迅速吸收氧气,而在高温下放出氧气;另一种是暗红色晶体[非活性型,图(b)],在室温下温度,不吸收氧气。
图二[Co(salen)]的非活性型图三[Co(salen)]加氧后的结构和活性型结构非活性型的[Co(salen)]在某些极性有机溶剂中,如二甲亚砜(DMSO)、二甲基甲酰胺(DMF)、吡啶(Py)中,能与溶剂配位形成活性配合物[LCo(Salen)],后者能迅速吸收氧气形成2:1的加合物[L(Salen)Co-O-O-Co(Salen)L]。
在DMF溶剂中生成的加合物[(DMF) (Salen)Co-O-O-Co(Salen) (DMF)]是细颗粒状的暗棕色沉淀,不易过滤,宜用离心分离,加合物中Co和O的比例可用气体体积测量法测定。
双核乙二胺水杨醛Schiff碱Cu(II)配合物的合成及晶体结构

o th d a o r i a in e vr n n. ca e r c o d n t n i me t l o o
Ke r s: c i a e; r sa sr cu e c mp e y wo d S h f b s c t l t t r ; o lx y u
JANG G a g q ’ I u n — i ( eate t f hm sy G i o nvri , uyn 50 5 C ia D pr n o e ir, uz uU iesy G iag50 2 , hn ) m C t h t
Abta tA wl os-k opr I) o pe a enpeae yc ri tn r ci fe yeeim n ai l dhd s c: i goel ecpe (I cm l hsbe rprd b o dn i e t no t lnda ies c a eye r d i x ao a o h l y l
D。 . 0 g c , =1 7 6 / m3 =1 3 . 2, R = .53 w 2 012 ; 10 8 I 004 ,R = .52 结构分 析表 明 , 配合物
中存 在两种 截然 不 同的 c u
(I 配位 模式 ,u 1 离子采取 四方平面构型 ,u 2 离子却为扭 曲八面体几何构 型。 I) C() C () 关键词 : 夫碱 ; 席 晶体结构 ; 配合物
Salen]配合物的制备及载氧作用(精)
![Salen]配合物的制备及载氧作用(精)](https://img.taocdn.com/s3/m/8eaeda4cf01dc281e53af090.png)
三、实验步骤:
1. 非活性型配合物[Co(II)Salen]的制备。
OH CHO H2N N O NH2 Co O N N O
2.26
95%乙醇
OH HO HC N N CH
Co(CH3COO)2
Co HC N N CH
O
O
N
在无氧及70~80℃条件下搅拌1小时
O O N
Co
N O O N
O N
3.45
五、 思考题
1.在制备[Co(II)Salen]配合物的过程中通氮气 有何作用? 2. [Co(II)Salen]配合物在溶剂DMF和CHCl3 中有两种性质截然不同的吸氧和放氧作用, 试从溶剂的性质来解释其原因。
六、参考文献
[1]王伯康,钱文浙等编. 中级无机化学实验. 高等教育出版社,1984 [2] T. G. Appleton. J. Chem. Educ., 54, 443 (1977)
的反应
O2(g) CHCl 3 [Co(II)Salen]2(DMF)2O2 [Co(II)Salen] DMF
4. 数据记录及结果处理
编号 1 2 5 3 4 5 6 7 8
时间(min) 0 量气管液面 读数(mL) 吸收氧体积 (mL)
10 15 20 25 30 35
室温:
℃;大气压力:
[3] E. I. Ochiai, J. Chem. Educ., 50, 610 (1973)
[4] C. Floriani and F. Calderazzo. J. Chem.
Soc. (A), 946 (1969)
四、注释
1.水杨醛及乙二胺有气味和腐蚀性,取用时 应在通风橱中进行,切忌滴到皮肤上。 2.支试管、小试管及离心试管应预程中通氮 气有何作用? 2. [Co(II)Salen]配合物在溶剂DMF和CHCl3 中有两种性质截然不同的吸氧和放用,试 从溶剂的性质来解释其原因。
双水杨醛缩乙二胺铁(Ⅱ)配合物的合成及其晶体结构

1 实 验部 分
1 1 试 剂和仪 器 .
状单晶, 室温 干燥 。
14 晶体 结构 测定 .
F S 4・ H O( R, 安 化 学试 剂 厂 ) 乙 二胺 eO 7 2 A 西 、
摘
要: 设计合 成 了双水 杨醛 缩 乙二胺 ( a n 及 其铁 ( 配合 物 F (a n 并通 过 x一射 线 H sl ) e Ⅱ) e sl ), e
单 晶衍射技 术 测定 了其 晶体 结 构 。该 配 合 物 属 正 交 晶 系, ba空 间群 , Pc 晶胞 参 数 a:077 3 .43( )
状结构 。
关 键词 : ( 配合 物 ; 铁 Ⅱ) 晶体 结构 ; 成 合 中图分 类号 : 6 2 8 0 1 . 文 献标识码 : A 文章 编 号 :0 46 2 2 1 ) 10 6 -3 10 -0 X( 0 0 0 -0 20
( 国 ) 德 。
近年来 , 内报 道 了大量 有 关 铁 配合 物 单 晶合 国 成, 主要集 中在 铁 ( 配 合 物 的合 成 ¨ 。铁 配 合 Ⅲ) 。J 物 功能 主要 集 中于液 晶性 能 J催 化剂 . 、 物 功 、 o生 J
能 引、 发光 性 能 等方 面 , 于生 物 功 能方 面 的研 关 究 所用 的配 体多用 卟啉 、 聚糖等较 大 的有机 分子 。 壳
12 H sln的合 成 . 2a e 在 10m 0 L三颈瓶 中加 人 2 2 5 (8 8r o) . 9 8g 1 . t 1 e o
水 杨醛 , 3 用 5mL甲醇溶解 , 缓慢 滴加 溶有 05 6 .55g
双水杨醛缩乙二胺Schiff_碱
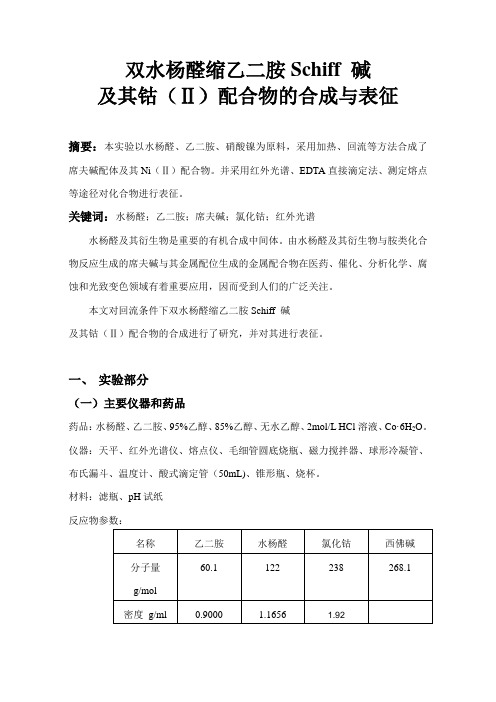
双水杨醛缩乙二胺Schiff 碱及其钴(Ⅱ)配合物的合成与表征摘要:本实验以水杨醛、乙二胺、硝酸镍为原料,采用加热、回流等方法合成了席夫碱配体及其Ni(Ⅱ)配合物。
并采用红外光谱、EDTA直接滴定法、测定熔点等途径对化合物进行表征。
关键词:水杨醛;乙二胺;席夫碱;氯化钴;红外光谱水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的席夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及其钴(Ⅱ)配合物的合成进行了研究,并对其进行表征。
一、实验部分(一)主要仪器和药品药品:水杨醛、乙二胺、95%乙醇、85%乙醇、无水乙醇、2mol/L HCl溶液、Co·6H2O。
仪器:天平、红外光谱仪、熔点仪、毛细管圆底烧瓶、磁力搅拌器、球形冷凝管、布氏漏斗、温度计、酸式滴定管(50mL)、锥形瓶、烧杯。
材料:滤瓶、pH试纸反应物参数:名称乙二胺水杨醛氯化钴西佛碱分子量60.1 122 238 268.1g/mol密度g/ml 0.9000 1.1656 1.92(二)实验原理1.双水杨醛缩乙二胺Schiff碱及其镍(Ⅱ)配合物的合成Schiff碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:本实验采用水杨醛和乙二胺在75℃的条件下用回流法制备相应的Schiff碱,反应方程式如下所示:席夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
(三)实验装置图(四)实验内容1.Schiff 碱配体及其镍(Ⅱ)配合物的合成实验步骤现象记录(1)Schiff 碱配体的合成在装有回流冷凝管和搅拌器的圆底烧瓶中加入6ml水杨醛和30ml无水乙醇,开动搅拌器搅拌。
cosalen合成

Co-salen配合物的合成
双水杨醛缩乙二胺合钴配合物[Co(Salen)]具有类卟啉结构, 是典型的具有载氧功能的仿酶模型化合物, 能有效地活化分子氧, 在合成上经常用于烯烃的分子氧环氧化, 醇的选择性催化氧化以及催化氧化Baeyer-Villiger反应等, 由于其优良的吸氧功能, 可以加快氧化反应的速率。
而且Co(Salen)原料易得、合成方法简单。
1、配体salen的合成
取2.5克乙二胺和8.5ml水杨醛溶解于18ml甲醇中,在冰水浴中搅拌30min,静置15min后,用G3玻璃滤器减压抽滤,用1ml乙醚洗涤,在33℃下真空干燥,得淡黄色固体,再用160ml无水乙醇重结晶,在33℃下真空干燥,得到黄色晶体,即为配体salen,熔点:125-125.5℃。
合成西佛碱的反应的条件温和,无需加热,当室温较高时,可用冰水浴。
整个过程处理方便。
2、Co-salen配合物的合成
取3.48克配体salen溶解于150ml热的甲醇中,另取3.24克CoAc2·4H2O 溶解于20ml温水中,迅速转移到上述甲醇溶液中,加热回流1h,冷却、过滤、在50℃下真空干燥,即得红褐色的Co-salen配合物,熔点:大于300℃。
合成路线图如下:。
乙二胺双缩水杨醛钴配合物的制备和载氧性质

乙二胺双缩水杨醛钴配合物的制备和载氧性质一.实验目的1.掌握无机合成中的一些操作技术,制备非活性的配合物。
2.了解血红蛋白载氧作用的意义,通过配合物的吸氧测量和放氧观察了解配合物的载氧作用机理。
二.实验原理在自然界的生物体中,有许多含有过渡金属离子的蛋白。
其中有些金属蛋白,例如含铁的肌红蛋白、血红蛋白、含铜的血蓝蛋白和含钒的血钒蛋白等,在一定条件下都能够吸收和放出氧气,以供有机体生命活动的需要,被称为载氧体。
一些简单的金属配合物也具有类似的现象,可作为载氧体的模拟化合物,对了解天然载氧体的结构和反应机理、开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。
乙二胺双水杨醛缩的钴(Ⅱ)配合物[Co(salen)]是研究得最早的钴载配合物的典型代表。
从一般的钴载氧配合物(CoLn)研究中发现,它们与氧的结合可以有两种不同的方式:CoLn + O2 === LnCoO22 CoLn + O2 === LnCo—O2—CoLnCo与O2的摩尔比可以是1:1或2:1,由配体L的性质、反应温度、使用溶剂等条件决定。
[Co(salen)]配合物由于制备条件的不同可以两种不同的固体形态存在,一种是棕褐色的胶状产物[活性型,图(a)],在温室下能迅速吸收氧气,而在高温下放出氧气;另一种是暗红色晶体[非活性型,图(b)],在室温下温度,不吸收氧气。
图二[Co(salen)]的非活性型图三[Co(salen)]加氧后的结构和活性型结构非活性型的[Co(salen)]在某些极性有机溶剂中,如二甲亚砜(DMSO)、二甲基甲酰胺(DMF)、吡啶(Py)中,能与溶剂配位形成活性配合物[LCo(Salen)],后者能迅速吸收氧气形成2:1的加合物[L(Salen)Co-O-O-Co(Salen)L]。
在DMF溶剂中生成的加合物[(DMF) (Salen)Co-O-O-Co(Salen) (DMF)]是细颗粒状的暗棕色沉淀,不易过滤,宜用离心分离,加合物中Co和O的比例可用气体体积测量法测定。
水杨醛亚胺钴(Ⅱ)配合物的合成及载氧性能

关键词:Salen Ca(.)配合物;5-氯水杨醛;3 ,5-二叔丁基水杨醛;载氧性能;构效关系中图分类号:O 641.4
文献标志码:A
文章编号:1006 —7167(2019% 12 -0052 -05
Synthesis of Salicylaldiminate Colbet ( || % Compkxes and Their Oxygen Carrying Performance
JIANG Cuiyo, S+#G !&(, L/2 Lel, L"—5 S7&=an, Z+#—5 LongCl
(Collese of Science, China University of Petroleum, Qingdao 266580, Shandong, China%
Abstract: Five kinds of SchWO base ligands were synthesized by salicylaldehyde and its derivvtives, ethylenediamine and
ISSN 1006 -7167 CN 31 — 1707/L
RESEARCH AND EXPLORATION IN LABORATORY
第38卷第12期 2019年12月
Vol. 38 No. 12 Dec. 2019
水杨醛亚胺钻(!)配合物的合成及载氧性能
姜翠玉,邵雪,刘蕾,梁书源,张龙力
(国石油大学(华东)理学院,山东 青岛266580%
°C、反应时间2.5 h,此条件下L1产率最高,达到81.4% $在配体与硝酸钻的物质
的量之比为1.5、溶剂用量为60.0 mL、反应温度80 C、反应时间3 h条件下合成5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙二胺双缩水杨醛钴配合物的制备和载氧性质一.实验目的1.掌握无机合成中的一些操作技术,制备非活性的配合物。
2.了解血红蛋白载氧作用的意义,通过配合物的吸氧测量和放氧观察了解配合物的载氧作用机理。
二.实验原理在自然界的生物体中,有许多含有过渡金属离子的蛋白。
其中有些金属蛋白,例如含铁的肌红蛋白、血红蛋白、含铜的血蓝蛋白和含钒的血钒蛋白等,在一定条件下都能够吸收和放出氧气,以供有机体生命活动的需要,被称为载氧体。
一些简单的金属配合物也具有类似的现象,可作为载氧体的模拟化合物,对了解天然载氧体的结构和反应机理、开发在特殊条件下(如潜艇、高空飞行)的氧供应材料具有重要意义。
乙二胺双水杨醛缩的钴(Ⅱ)配合物[Co(salen)]是研究得最早的钴载配合物的典型代表。
从一般的钴载氧配合物(CoLn)研究中发现,它们与氧的结合可以有两种不同的方式:CoLn + O2 === LnCoO22 CoLn + O2 === LnCo—O2—CoLnCo与O2的摩尔比可以是1:1或2:1,由配体L的性质、反应温度、使用溶剂等条件决定。
[Co(salen)]配合物由于制备条件的不同可以两种不同的固体形态存在,一种是棕褐色的胶状产物[活性型,图(a)],在温室下能迅速吸收氧气,而在高温下放出氧气;另一种是暗红色晶体[非活性型,图(b)],在室温下温度,不吸收氧气。
图二[Co(salen)]的非活性型图三[Co(salen)]加氧后的结构和活性型结构非活性型的[Co(salen)]在某些极性有机溶剂中,如二甲亚砜(DMSO)、二甲基甲酰胺(DMF)、吡啶(Py)中,能与溶剂配位形成活性配合物[LCo(Salen)],后者能迅速吸收氧气形成2:1的加合物[L(Salen)Co-O-O-Co(Salen)L]。
在DMF溶剂中生成的加合物[(DMF) (Salen)Co-O-O-Co(Salen) (DMF)]是细颗粒状的暗棕色沉淀,不易过滤,宜用离心分离,加合物中Co和O的比例可用气体体积测量法测定。
向[(DMF) (Salen)Co-O-O-Co(Salen) (DMF)]加入氯仿或苯后,将慢慢溶解,并不断放出细小的氧气流,并产生暗红色的[Co(salen)]溶液。
CHCl3[Co(salen)(DMF)]2(μ-O2) 2[Co(salen)]+O2+2DMF三.主要仪器与试剂1.仪器:天平;抽滤装置;非活性Co(salen)的制备装置;Co(salen)的氧气吸收装置;离心机;离心管2.试剂:水杨醛,乙二胺,醋酸钴[Co(CH3COO)2.4H2O],乙醇,二甲基甲酰胺(DMF),氯仿四.实验过程及现象记录1.非活性[Co(salen)]配合物的制备注意事项①计算吸收的氧的物质的量时,注意要考虑室温时饱和水蒸气压。
②制备过程中,在钴盐溶液加入到配体溶液之前5min应开通氮气。
③咋吸氧实验过程中要保持体系不能漏气。
五.数据处理温度:29℃大气压:1atm。
六.实验讨论实验所得吸收的氧与配合物的物质的量的比为1:59,与文献相差较大,可能的原因是:1. 配合物[Co(salen)]不够干燥,含有水,所以导致吸收氧的量比较低2.实验书中建议在红外灯或真空干燥箱烘干产品,但本实验烘干操作时在普通烘箱中进行,有可能在高温烘干过程中吸收了空气中的氧气。
3.有可能是[Co(salen)]与DMF反应不完全,所以吸收的氧气的量较少。
七.实验习题1.还有那些配合物常用于作为载氧模拟物?①铁(II) 载氧体化学家们早在20世纪50年代已经开始研究人工合成铁氧载体,但直到70年代才逐步找到恰当的合成方法。
过去合成铁氧载体遇到的主要困难是Fe(II) 配合物与O2作用生成不能可逆载氧的μ− O二聚体Fe III−O−Fe III。
虽然这一过程的详细机理还没有完全弄清楚,但是在固相反应时生成的μ−O 二聚体的机制可粗略表示如图4-24。
1975年Basolo在研究四苯基卟啉铁与O2反应动力学的基础上,提出如下机制:(4-10) LFe II(Por) + O2LFe III(Por)(O2−)(4-11) LFe III(Por) (O2−) + Fe II(Por) LFe III(Por) − O22−− LFe III(Por)L(4-12) LFe III(Por) − O22−− Fe III(Por)L LFe III(Por) − O − LFe III(Por)L但也有人认为μ− O二聚体的形成按另一途径进行,即式(4-11) 中过氧加合物分子先发生断裂:(4-13) L III Fe(Por) − O22−− Fe III(Por)L 2LFe IV(Por) − O2−LFe IV(Por) − O2− + LFe II(Por) LFe III(Por) − O2−− Fe III(Por)L 血红蛋白和肌红蛋白的铁卟啉辅基处于多肽链盘绕之中,正是这种空间位阻效应能够阻止两个血红素的Fe(II) 离子互相靠近,抑制了不可逆载氧的FeIII-O-FeIII生成,因此能够可逆载氧。
人们据此进行了大量研究,已经找到防止Fe(II) 配合物生成μ− O二聚体的的三种有效途径:a在Fe(II) 配合物内设置空间位阻;b在低温下使Fe(II) 配合物生成μ− O二聚体的反应非常慢;c把Fe(II) 配合物固载在有一定刚性的载体表面。
②Vaska 型氧载体1963年L. Vaska合成了[IrCl (CO) (PPh3)2]氧载体,其中Ir+属于d8电子组态,PPh3为三苯基膦。
这个配合物在苯溶液中能可逆键合氧分子,生成1:1的双氧配合物,其反应如下。
配合物与氧分子反应前溶液黄色,反应后变为红色。
经X射线衍技术证实,这种Vaska 型氧载体加合物分子为三角双椎构型,氧分子以侧基和Ir+键合,O—O键长130pm,Ir—O 键长209pm。
红外光谱测得氧分子的伸缩振动频率V O—O = 858cm-1,说明键合的氧分子有过氧基的特性。
由此推测,中心离子需反馈两个电子给氧分子。
Ir+与O2键合时形成两个三中心配键,其中一个是氧分子的成键π电子给予Ir+离子的空d 轨道形成σ配键,另一个是由Ir+离子充满电子的未成键d 轨道反馈给氧分子的反键π* 轨道形成反馈π键,如图4-33。
膦配位的主要作用是阻止氧分子接受来自铱的电子而不可逆还原,以保持铱的低价氧化态(+1) ,同时又促进上述反馈π键形成。
由于Vaska 型氧载体的中心金属原子或离子需要反馈两个电子给配体的氧分子,所以d10组态的金属原子或低价态的金属离子更有利于生成Vaska 型氧载体。
它们是含有大量d 电子的软的π电子对给予体,与软的π电子接受体分子氧强烈作用,d10金属原子以它的外层空s 和p 轨道杂化来接受O2成键π电子形成σ配位键,而它们的充满电子的d 轨道反馈给O2的反键π* 轨道形成反馈π键。
事实上,已经发现,Pt0、Pd0、和Ni0的4-三苯基膦配合物[M (PPh3) 4] 在甲苯或苯溶液中也能与氧分子生成1:1的加合物[ (PPh3)2M (O2) ]。
用红外光谱测定[(PPh3)2Pt(O2) ]和[ (PPh3)2Pd (O2) ]的O-O 键伸缩振动频率分别为830和880cm-1,可见键合的氧分子具有过氧基的特征。
[ (PPh3)2Pt(O2) ]单晶结构参数证实,键合的氧分子的O—O键长为145pm,两个氧原子和两个磷原子与Pt原子几乎处在一个平面上。
③铜(I) 氧载体1978年M. G. Simmons 和L. J. Wilson合成了以咪唑作为配体的Cu (I) 配合物,在室温下无论是溶液或固体都能可逆载氧。
他们用2,6-二乙酰基吡啶与组胺缩合,得到配体2,6-[1- (2-咪唑-4-亚乙基亚氨基) 乙基]吡啶,然后在氮气保护下加入[Cu (I) (MeCN) 4] (ClO4) 得到暗红色的[Cu (I) ] (ClO4) 配合物,如下。
该配合物在溶液中以单体形式存在。
Cu (I) 离子的配位数为5。
在室温下露置于空气中,溶液迅速从红色变为绿色,约2分钟后反应完全,每2molCu (I) 吸收1molO2。
如果把载氧后的溶液温热至40°C 左右并用氮气赶跑气体,或在减压下搅拌溶液,很容易发生放氧逆反应,溶液恢复原来的红色。
如此重复实验证实它能可逆载氧。
据此推测可能存在下列反应:LCu I + O2LCu II O2−(4-20)LCu II O2− + Cu I L LCu II O22−Cu II L2.如何解释[Co(salen)]配合物的两种结构的吸氧活性和非活性?答:因为活性的Co与Co键之间的键长为0.345nm而非活性的Co与O之间的键长为0.226nm,键长越长键能越小,那么,所以活性型的容易加入氧气。
而非活性的键长短,键能大,难以发生反应。
3.[Co(salen)]配合物在溶剂DMF和CHCl3中有两种性质截然不同的吸氧和放氧作用,可否从溶剂的性质来解释其所起的作用?答:因为DMF是极性溶剂,非活性型的是极性,溶剂的极性对产物有影响,非活性型的能与极性的溶剂配位而成为活性型,这样活性型就能迅速吸氧气儿形成2:1型的加合物。
而氯仿是非极性的溶剂,使得活性型的配合物向非活性型的转变,从而放出氧气。
4.在制备[Co(salen)]配合物过程中通氮气起什么作用?答:通氮气是为了提供无氧环境。
需要制备的配合物为非活性[Co(salen)]配合物,但是在加热的条件下可能与空气中的氧气反应生成活性[Co(salen)]配合物,导致产率较低。
