人教版高中化学选修四第四章电化学基础总复习(习题2)
2019-2020学年高中化学人教版选修四 第四章电化学基础4.2化学电源b (II)卷

2019-2020学年高中化学人教版选修四第四章电化学基础4.2化学电源b (II)卷姓名:________ 班级:________ 成绩:________一、 2017_2018学年高中化学测试新人教版选修4第四章电化学 (共12题;共34分)1. (2分) (2018高二下·温州期中) “绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型最符合这一要求的是()A . 取代反应B . 加聚反应C . 氧化反应D . 消去反应2. (2分) (2019高二下·杭州月考) 用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。
下列说法中正确的是()A . 燃料电池工作时,负极反应为:H2-2e-= 2H+B . 若要实现铁上镀铜,则a极是铁,b极是铜C . 若要实现电解精炼粗铜,则a极发生氧化反应, b极质量增加D . 当a、b均是石墨时,当消耗H2 22.4L(标况)时,a极析出铜64g3. (2分)(2016·静宁模拟) 如图所示,下列说法正确的是()A . 甲池中阳离子向通入CH3OH一方的电极区域内移动B . 甲池通入CH3OH的电极反应式为CH3OH﹣6e﹣+2H2O═CO32﹣+8H+C . 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度D . 甲池中消耗280 mL(标准状况下)O2 ,此时丙池中理论上产生1.45 g固体4. (2分)某原电池的电池反应为:Fe+2Fe3+=3Fe2+ ,与此电池反应不符合的原电池是()A . 铜片、铁片、FeCl3溶液组成的原电池B . 石墨、铁片、Fe(NO3)3溶液组成的原电池C . 铁片、锌片、Fe2(SO4)3溶液组成的原电池D . 银片、铁片、Fe(NO3)3溶液组成的原电池5. (2分) (2019高二上·重庆期末) 《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如下。
人教版选修4 第四章 电化学基础单元复习作业

人教版选修4 第四章电化学基础一、选择题1.如图所示,液面上浮着一个空心铁球。
数天后可观察到的现象是 ()①铁球表面出现红棕色锈斑②铁球表面出现黑色锈斑③量筒内水位下降④量筒内水位上升A.①③B.①④C.②③D.③④2.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO后恰好恢复到电解前状态。
则电解过程中转移电子的物质的量为()A.0.1 mol B.0.2 molC.0.3 mol D.0.4 mol3.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。
下列判断不正确的是()A.反应时,电子从乙中石墨电极沿导线流向甲中石墨电极B.反应时,甲中石墨电极发生还原反应C.电流表读数为零时,反应达到化学平衡状态D.电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极4.用含少量银和锌的粗铜作阳极,纯铜片作阴极,CuSO4溶液作电解液,电解一段时间后,阳极质量减少了x g,则()A.电解液质量增加x gB.阴极质量增加x gC.阴极质量增加b g,b>xD.阴极质量增加b g,b<x5.下列叙述与电化学腐蚀有关的是()A.炒过菜的铁锅不及时清洗易生锈B.在空气中金属镁、铝都具有较好的抗腐蚀性C.红热的铁丝与水接触时,表面形成了蓝黑色的物质D.把铁片投入氯化铜的溶液中,在铁表面上附着一层红色的铜6.铜锌原电池(如图)工作时,下列叙述正确的是()A.正极反应式:Zn-2e-===Zn2+B.电池总反应式:Zn+Cu2+===Zn2++CuC.在外电路中,电子从正极流向负极D.盐桥中的K+移向ZnSO4溶液7.全固态锂硫电池能量密度高、成本做,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+x S8===8Li2S x(2≤x≤8)。
下列说法错误的是()A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4B.电池工作时,外电路中流过0.02 mol电子.负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多8.化学在生产和日常生活中有着重要的应用。
人教版选修四第四章、电化学基础 期末基础知识复习及训练(含答案)

人教版高二化学必修四第四章、电化学基础期末基础知识复习及训练(含答案)基础知识点整理一、原电池基本概念理解。
1、原电池的概念:把化学能直接转化为电能的装置叫做原电池。
2、化学电池的分类:常见的原电池可以分为三类:(1)一次电池:常见一次电池:碱性锌锰电池、锌银电池、锂电池等;(2)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池;(3)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池。
3、原电池的电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑4、常见原电池的电极反应总结。
⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极: Pb-2e-+ SO42- = PbSO4正极: PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应:阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-===总反应式:Pb + PbO 2 + 2H2SO4放电充电2PbSO4 + 2H2O5、典型例题分析。
例题1、原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是( )A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑答案:B解析:(1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Fe作负极。
人教版选修4第四章《电化学基础》核心知识与全章分节分层练习 +答案+全解全析
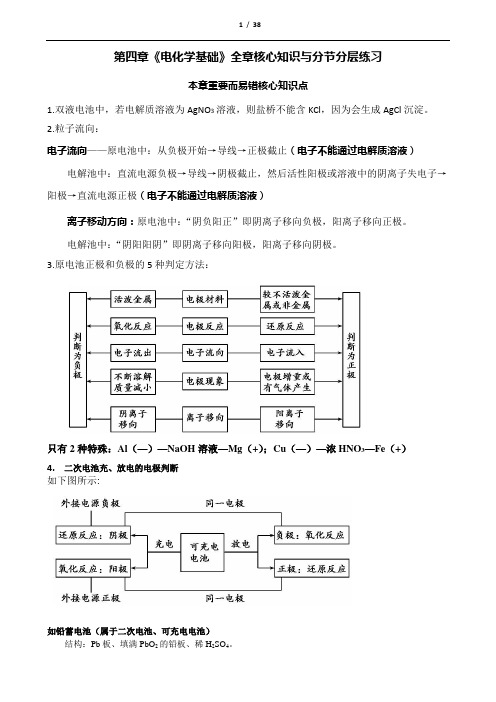
第四章《电化学基础》全章核心知识与分节分层练习本章重要而易错核心知识点1.双液电池中,若电解质溶液为AgNO3溶液,则盐桥不能含KCl,因为会生成AgCl沉淀。
2.粒子流向:电子流向——原电池中:从负极开始→导线→正极截止(电子不能通过电解质溶液)电解池中:直流电源负极→导线→阴极截止,然后活性阳极或溶液中的阴离子失电子→阳极→直流电源正极(电子不能通过电解质溶液)离子移动方向:原电池中:“阴负阳正”即阴离子移向负极,阳离子移向正极。
电解池中:“阴阳阳阴”即阴离子移向阳极,阳离子移向阴极。
3.原电池正极和负极的5种判定方法:只有2种特殊:Al(—)—NaOH溶液—Mg(+);Cu(—)—浓HNO3—Fe(+)4.二次电池充、放电的电极判断如下图所示:如铅蓄电池(属于二次电池、可充电电池)结构:Pb板、填满PbO2的铅板、稀H2SO4。
.放电反应(原电池):负极:Pb-2e-+ SO42- = PbSO4正极:PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2O充电反应(电解池):阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-总反应式:Pb + PbO2 + 2H2SO42PbSO4 + 2H2O简单理解:充电要恢复放电前的样子。
即:放电时原电池负极失电子后,充电时要补回来,故原负极电极要接电源负极成阴极;放电时原电池正极得电子后,充电时要把电子失去,故原正极电极要接电源正极成阳极。
5.书写原电池中的电极反应式时,(1)一定要首先找出题目给出的溶液的酸、碱性,经确认无误后再用H+(酸溶液)或OH-(碱溶液)来平衡电荷。
(2)有些题目中未直接告诉酸碱性,则看电池总反应式,若总反应式中出现碱,则为碱性溶液,则必须用OH-(碱溶液)来平衡电荷。
(3)不在水溶液中进行的原电池反应,一般不能用H+或OH-平衡电荷。
人教版高中化学选修四第四章电化学基础总复习(习题2).docx

高中化学学习材料唐玲出品河南省信阳市二高2016届高三化学复习能力提升训练:选修4 电化学基础(有详解)1.某课外活动小组,为研究金属的腐蚀与防护的原理,做了如下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图的装置进行实验,过一段时间后观察。
下列现象不可能出现的是()A. B中导气管中产生气泡B. B中导气管里形成一段水柱C. 金属片剪口变红D. 锌被腐蚀2.在水中加入等物质的量的Ag+、Pb2+、Na+、SO42—、NO3—、Cl—,该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为()A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.53.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+2Pb2++2H2O。
下列有关新型液流式铅酸蓄电池的说法正确的是()A.充放电时,溶液中Pb2+浓度保持不变B.充放电时,溶液的导电能力变化不大C.放电时的负极反应式为:Pb-2e-=Pb2+D.充电时的阳极反应式为:Pb2++4OH-+2e-=PbO2+2H2O4.以铁为阳极、铜为阴极,对足量的NaOH溶液电解,一段时间后,得到2 mol Fe(OH)3沉淀,此间共消耗水的物质的量为()A.3mol B.4mol C.5mol D.6mol5.银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH)2,则负极上发生反应的物质是()A. AgB. Zn(OH)2C. Ag2OD. Zn6.下列述叙正确..的是()A.要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠B.镀锡铁表面有划痕是,仍然能阻止铁被氧化C.向上图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成D.各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS7.惰性电极电解下列溶液,电解一段时间,阴极质量增加,电解液的pH下降的是()A.CuSO4 B.NaCl C.NaOH D.H2SO48.如图所示,将两烧杯中电极用导线相连。
高中化学第4章电化学基础训练2新人教版选修4(2021年整理)

2018年高中化学第4章电化学基础训练2 新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年高中化学第4章电化学基础训练2 新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年高中化学第4章电化学基础训练2 新人教版选修4的全部内容。
训练2 化学电源[基础过关]一、常见的化学电池1.下列说法正确的是 ( ) A.碱性锌锰电池是二次电池B.铅蓄电池是一次电池C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生D.燃料电池的活性物质大量储存在电池内部2.下列有关电池的说法不正确的是() A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极3.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是 2PbSO4+2H2O错误!PbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是()A.需要定期补充硫酸B.工作时铅是负极,PbO2是正极C.工作时负极上发生的反应是Pb-2e-+SO错误!===PbSO4D.工作时电解质的密度减小4.氢氧燃料电池已用于航天飞机,它是以铂作电极,KOH溶液作电解质,正极反应为O2+2H2O +4e-===4OH-,负极反应为2H2+4OH--4e-===4H2O,下列叙述不正确的是( ) A.H2在负极发生氧化反应B.燃料电池的能量转化率可达100%C.是一种高效、环保的发电装置D.供电时的总反应为2H2+O2===2H2O二、根据电极反应式或总反应式分析电池的有关变化5.市场上经常见到的标记为Li。
(人教版)化学选修四:第4章《电化学基础》专题突破(2)及答案
2 原电池电极反应式的书写规律和方法1.根据装置书写电极反应式(1)先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。
(2)负极反应式的书写(3)①首先判断在正极发生反应的物质:当负极材料与电解质溶液能自发的发生化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能自发的发生化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。
②然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若参与反应也要书写叠加式。
③燃料电池的正极反应式电解质是碱性或中性溶液:O2+2H2O+4e-===4OH-,电解质是酸性溶液:O2+4H++4e-===2H2O。
(4)正、负电极反应式相加得到电池反应的总反应方程式。
2.根据总反应式书写电极反应式如果题目给定的是总反应式,可分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情况写电极反应式,另一极的电极反应式可直接写或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式即得结果。
以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下:(1)根据总反应方程式分析有关元素化合价的变化情况,确定2 mol H2失掉4 mol电子,初步确定负极反应式为2H2-4e-===4H+。
(2)根据电解质溶液为碱性,与H+不能共存,反应生成水,推出OH-应写入负极反应式中,故负极反应式为2H2+4OH--4e-===4H2O。
(3)用总反应式2H2+O2===2H2O减去负极反应式得正极反应式:2H2O+O2+4e-===4OH-。
3.可充电电池电极反应式的书写在书写可充电电池电极反应式时,要明确电池和电极,放电为原电池,充电为电解池。
(1)原电池的负极发生氧化反应,对应元素化合价升高。
(2)原电池的正极发生还原反应,对应元素化合价降低。
人教版选修4 第四章 电化学基础全章复习训练
人教版选修4 第四章电化学基础一、选择题1.用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是()A.AgNO3[AgNO3]B.NaOH[H2O]C.KCl[KCl]D.CuSO4[Cu(OH)2]2.可以将反应Zn+Br2===ZnBr2设计成原电池,下列4个电极反应:①Br2+2e-===2Br-,②2Br--2e-===Br2,③Zn-2e-===Zn2+,④Zn2++2e-===Zn,其中表示放电时负极和正极反应的分别是()A.②和③B.②和①C.③和①D.④和①3.“ZEBRA”蓄电池的结构如下图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是()A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应式为NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动4.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为()A.4∶1 B.1∶1C.4∶3 D.3∶45.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6 mol·L-1,用石墨作电极电解此混合溶液,通电一段时间后,两电极均收集到2.24 L(标准状况下)气体,假设电解后溶液的体积仍为500 mL,下列说法正确的是()A.原混合溶液中c(K+)=0.2 mol·L-1B.上述电解过程中共转移0.2 mol电子C.电解得到的Cu的物质的量为0.5 molD.电解后溶液中c(H+)=0.2 mol·L-16.在25 ℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解。
通电一段时间后,在阴极逸出a mol气体,同时有W g Na2SO4·10H2O晶体析出,若温度不变,此时剩余溶液的质量分数为( ) A.W W +18a×100% B.W W +36a×100% C.7 100W161(W +18a )%D.7 100W161(W +36a )%7.某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。
人教版高中化学选修四 第四章 电化学基础 练习试题 含答案
绝密★启用前人教版高中化学选修四第四章电化学基础练习题本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分第Ⅰ卷一、单选题(共15小题,每小题4.0分,共60分)1.如图所示,电流计指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是()A. B极为原电池的正极B. A、B、C可能分别为锌、铜、稀盐酸C. C中阳离子向A极移动D. A极发生氧化反应2.现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是()A.电解开始时阴极有H2放出B.电解开始时阳极上发生:Cu2++2e-===CuC.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化D.整个电解过程中,不参与电极反应3.有关电化学知识的描述正确的是()A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂C.因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极D.理论上说,任何能自发进行的氧化还原反应都可被设计成原电池4.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。
下列“水”电池在海水中放电时的有关说法不正确的是()A.负极反应式:Ag+Cl--e-===AgClB.正极反应式:5MnO2+2e-=== Mn5C.每生成1 mol Na2Mn5O10转移2 mol电子D. AgCl是还原产物5.用质量均为100 g的铜棒做电极,电解硝酸银溶液,电解一段时间后,两个电极的质量差为28 g,则阴极的质量为()A. 128 gB. 114 gC. 119 gD. 121.6 g6.某小组为研究电化学原理,设计如图装置。
2020-2021学年高中化学人教版选修4第四单元电化学基础测试卷 (二) 学生版
2020-2021学年高二上学期第四单元测试卷化学(二)注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64 Ba 137一、选择题(每小题2分,共20分。
每小题只有一个选项符合题意。
)1.铁锅用水清洗放置后出现红褐色的锈斑,在此变化过程中不发生的反应是A.Fe-3e-=Fe3+B.O2+2H2O+4e-=4OH-C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Fe+O2+2H2O=2Fe(OH)22.关于下列装置说法正确的是A.装置②中滴入酚酞,a极附近变红B.装置①中,一段时间后SO2−4浓度增大C.用装置③精炼铜时,c极为粗铜D.装置④中发生吸氧腐蚀3.如图是保护埋在土壤中的铁管的常用方法,下列说法正确的是A.铁管表面的电子通过导线传递到锌块上B.锌块改变了铁管的组成和结构C.锌块作正极,随着电子沿导线的流出而逐渐消耗D.若土壤呈酸性,则H+向铁管移动4.用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是A.CuSO4B.H2SO4C.CuCl2D.NaCl5.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下实验装置部分实验现象a极质量减小,b极质量增大b极有气体产生,c极无变化d极溶解,c极有气体产生电流从a极流向d极由此可判断这四种金属的活动性顺序是A.a>b>d>c B.b>c>d>a C.d>a>b>c D.a>b>c>d6.液体燃料电池相比于气体燃料电池具有体积小等优点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
河南省信阳市二高2016届高三化学复习能力提升训练:选修4 电化学基础(有详解)1.某课外活动小组,为研究金属的腐蚀与防护的原理,做了如下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图的装置进行实验,过一段时间后观察。
下列现象不可能出现的是()A. B中导气管中产生气泡B. B中导气管里形成一段水柱C. 金属片剪口变红D. 锌被腐蚀2.在水中加入等物质的量的Ag+、Pb2+、Na+、SO42—、NO3—、Cl—,该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为()A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.53.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+2Pb2++2H2O。
下列有关新型液流式铅酸蓄电池的说法正确的是()A.充放电时,溶液中Pb2+浓度保持不变B.充放电时,溶液的导电能力变化不大C.放电时的负极反应式为:Pb-2e-=Pb2+D.充电时的阳极反应式为:Pb2++4OH-+2e-=PbO2+2H2O4.以铁为阳极、铜为阴极,对足量的NaOH溶液电解,一段时间后,得到2 mol Fe(OH)3沉淀,此间共消耗水的物质的量为()A.3mol B.4mol C.5mol D.6mol5.银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH)2,则负极上发生反应的物质是()A. AgB. Zn(OH)2C. Ag2OD. Zn6.下列述叙正确..的是()A.要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠B.镀锡铁表面有划痕是,仍然能阻止铁被氧化C.向上图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成D.各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS7.惰性电极电解下列溶液,电解一段时间,阴极质量增加,电解液的pH下降的是()A.CuSO4 B.NaCl C.NaOH D.H2SO48.如图所示,将两烧杯中电极用导线相连。
当闭合开关 S 后,以下表述正确的是()A.电流表指针不发生偏转B.Al、Pt 两极有 H2产生C.Mg、C 两极生成的气体可以恰好完全反应D.甲池 pH 减小,乙池 pH 不变9.我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:()Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,下列有关说法正确的是A.图中涉及的能量转化方式只有3种B.该发电工艺可实现零排放C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+D.储能时若充电时间过长,阳极流向阴极的10.A、B、C三个电解槽,A槽是CuCl2水溶液,纯铜片做阴极,B、C都是AgNO3水溶液,纯银丝做阴极,先将A、B槽并联,再与C槽串联进行电解,当B槽中银丝质量增加0.108g,C槽银丝质量增加0.216g时,A槽中铜片质量增加了()A 0.216gB 0.108gC 0.064gD 0.032g11.下列关于实验现象的描述不正确...的是 ( )A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快12.利用下列装置,可完成很多电化学实验。
下列有关叙述,正确的是()A 、若X 为锌棒,开关K 置于A 处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法B 、若X 为铜棒,开关K 置于A 处,装置中发生的总反应为2NaCl+2H 2O 2NaOH+Cl 2↑+H 2↑C 、若X 为碳棒,开关K 置于B 处,在铁棒附近滴入铁氰化钾溶液可看到溶液变血红色D 、若X 为碳棒,开关K 置于B 处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红13.如图装置所示,将装置放置一段时间。
下列有关描述错误的是:( )A .生铁块中的石墨是原电池的正极B .红墨水柱两边的液面变为左低右高C .两试管中相同的电极反应式是:Fe – 2e - = Fe 2+D .b 试管中的正极反应是:2H + +2e - = H 2↑14.用铁丝(电极a )、铜丝(电极b )和CuSO 4溶液可以构成原电池或电解池,如图所示。
则下列说法正确的是 ( )。
A .构成原电池时b 极反应为Cu -2e -=Cu 2+B .构成电解池时a 极质量一定减少C .构成电解池时b 极质量可能减少也可能增加D .构成的原电池或电解池工作后可能产生大量气体15.如图所示,将铁棒和石墨棒插入盛有饱和NaCl 溶液的U 型管中。
下列叙述正确的是:电解 KA B 食盐水 X FeA .K 1闭合,向铁棒附近滴入K 3[Fe(CN)6]溶液,有蓝色沉淀出现B .K 1闭合,电流方向由铁棒经导线流向石墨棒C .K 2闭合,碳棒是阴极D .K 2闭合,电路中通过0.2N A 个电子时,两极共产生4.48L 气体16.下列有关说法正确的是( )A .合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动B .铅蓄电池在放电过程中,负极质量增加,正极质量减少C .100 mL pH =3的HA 溶液、HB 溶液分别与足量的锌反应,HA 溶液放出的氢气多,说明HA 的酸性比HB 的弱D .已知I 3-I 2+I -,向盛有KI 3溶液的试管中加入适量CCl 4,振荡静置后CCl 4层显紫色,说明KI 3在CCl 4中的溶解度比在水中的大17.关于下图所示的原电池,下列说法正确的是 ( )A .电子从铜电极通过检流计流向锌电极B .盐桥中的阳离子向硫酸铜溶液中迁移C .锌电极发生还原反应,铜电极发生氧化反应D .铜电极上发生的电极反应是↑=+-+222H e H18.LiFePO 4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景。
已知该电池放电时的电极反应式为:( )正极:FePO 4+Li ++e -=LiFePO 4,负极:Li -e -=Li +,下列说法中正确的是A .充电时阳极反应为Li ++e -=LiB .充电时动力电池上标注“-”的电极应与外接电源的负极相连C .放电时电池内部Li +向负极移动D .放电时,在正极上是Li +得电子被还原19.(8分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。
某学生在实验室利用碱性甲醇燃料电池电解Na 2SO 4溶液。
请根据图示回答下列问题:(1)图中a 电极是 (填“正极”、“负极”、“阴极”或“阳极”)。
该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L 氧气时(已折合为标准状况),理论上电解Na 2SO 4溶液生成气体的总物质的量 是 mol 。
(4)25℃、101kPa 时,燃烧16g 甲醇生成CO 2和H 2O(l),放出的热量为363.26 kJ ,写出甲醇燃烧的热化学方程式: 。
20.由A 、B 、C 、D 四种金属按下表中装置进行实验,已知用C 与B 相连作电极放入硫酸铜溶液中B 溶解。
根据实验现象填表:装置现象金属A 断溶解 C 的质量增加 A 上有气体产生 正极反应式四种金属活动性有强到弱的顺序:21.按要求完成下列各小题。
Ⅰ、CO 和H 2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH 4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:22(H )(CO)(H O)c c K c ⋅= 它所对应的化学方程式为: 。
(2)向体积为2L 的密闭容器中充入CH 4和H 2O(g)组成的混合气(共1mol ),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X 〔n(CH 4)/n(H 2O)〕对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)②图2中两条曲线所示的压强比的关系:P2 _______P1(3)以CH4、O2为原料可设计成燃料电池:①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。
在此温度下,将pH=2的H2SO4溶液V a L与pH=12的NaOH溶液V b L混合,若所得混合液为中性,则V a︰V b=。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数K a=____________________。
22.烃A在一定条件下可以按下图进行转化:已知D为,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。
据此作答:(1)框图中属于取代反应的是_______(填序号);B完全燃烧后生成的CO2和水的质量比为_________。
(2)A的结构简式是_________________;G1的结构简式是____________________。
(3)写出E在一定条件下生成高聚物的化学方程式:____________________(4)已知B可在碱性条件下和O2构建成燃料电池,写出负极的电极反应式:___________________ 23.下表为部分短周期元素化合价及其相应原子半径的数据。
请回答下列问题:(1)元素G在周期中的位置是;元素F所形成的常见单质的电子式为。
(2)A、B、C、E的氢化物稳定性顺序是。
(用化学式回答)(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。
该反应的化学方程式是。
(4)请写出B的单质的一种重要用途;工业上制取该单质的原理反应为。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。
