【名校推荐】福建泉州市南安第一中学人教版高中化学必修一 2.3 氧化还原反应2 练习试题含答案
人教版高中必修一化学课件:2.3.1氧化还原反应

快速记忆: (化合价)升高、失电子、被氧化、氧化反应——高失氧 (化合价)降低、得电子、被还原、还原反应——低得还
某元素原子失去电子 (或电子对偏离) 某元素原子得到电子 (或电子对偏向)
化合价升高 化合价降低
氧化反应 还原反应
牢记各常用元素化合价!
一+价1钾钾钠钠氢氯与氢银银,; 二+价2钙氧镁钙钡钡与镁锌锌;; 三+价3金铝属,元四素价硅铝,; 五+价2、磷+;3铁助元记素词。
原反应
➢ (5)氧化还原反应中一种物质被氧化,另一种物质必 然被还原
➢ (6)有单质生成的反应一定是氧化还原反应 ➢ (7)有单质参加的化合反应一定是氧化还原反应
三 氧化还原反应中电子转移的表示方法
(1)用于表示反应中元素化
合价变化情况的双箭头—— 双线桥法
失1×4e-
+2
0高温 0 +4
2CuO + C = 2Cu + CO2
化合价降低
氧化反应 还原反应
➢ 对于反应MnO2 +4HCl(浓)= MnCl2 +Cl2 +2H2O
(化1)合M价n降_O_低2__在_,反发应生中_还__得__原__到______电_反子应,。所含元素
(2) HCl 在反应中__失__去__电子,所含元素化 合价_升__高__,发生_氧__化_____反应。
基本反应类 型
反应实例
点燃
化合反应 3Fe+2O2 = Fe3O4
CaO+H2O = Ca(OH)2
分解反应 2H2O 电=解2H2↑+O2↑
CaCO3
∆
=
CaO+CO2 ↑
氧化还原反应人教版高中化学必修一教学课件1

2e-
00
+1 -1
H2 + Cl2 = 2HCl
还原剂 氧化剂
+17
Cl
化合价升降的原因:
共用电子对的偏移
HCl +1
+17
+1 -1
H Cl
H Cl
氧化还原反应课件人教版高中化学必 修一1
氧化还原反应课件人教版高中化学必 修一1
氧化还原反应
氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
0
0
+1 -1
H2 + Cl2 === 2 H Cl
化合价降低,电子对偏向,被还原, 发生还原反应
还原剂 氧化剂 得到2×e-,
双线桥——用于表示反应中反应物和生成物同种 元素的化合价前后变化情况和电子得失(或转移) 数目
氧化还原反应课件人教版高中化学必 修一1
氧化还原反应课件人教版高中化学必 修一1
+4 -2 +1-1 +2 -1 +1-2 0 2.在反应MnO2 + 4HCl = MnCl2 + 2H2O+ Cl2↑,
Cl 元素化合价升高,被 氧化 (填"氧化"或"还原"), 发生 氧化 (填"氧化"或"还原")反应;
Mn 元素化合价降低,被 还原 (填"氧化"或"还原"), 发生 还原 (填"氧化"或"还原")反应。
电子转移的表示方法(双线桥)
正确判断各反应物、生成物各元素的化合价及其变化。
两个线桥一个在上、一个在下,线桥的方向是从反应物 一方指向生成物一方,首尾都必须对应化合价发生变化的 同种元素。
最新人教版高中化学必修一2.3.1《氧化还原反应》1优质课件.ppt

(2)注意事项 ①单线桥表示氧化剂和还原剂中变价 元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转 移数目;
③箭头标明电子转移的方向;
④单线桥箭头从还原剂中失电子的元 素原子指向氧化剂中得电子的元素原子。
(1)写例出2下列反应的化学方程式,用双线 桥标明电子转移的方向和数目,并注明“被氧 化”、“被还原”。
要点二 氧化还原反应中电子转移的表示
1.双线桥法 表明反应前后同一元素原子间的电子转移 情况
(1)双线桥法的基本步骤
(2)注意事项 ①箭头、箭尾指向化合价变化的同种 元素。
②必须注明“得到”或“失去”的字样。 ③还原剂失去电子总数与氧化剂得到 电子总数相等。
2.单线桥法 表明反应前后不同元素原子的电子转 移情况。
思考
在一个化学反应中能否只存在氧化反应或 只存在还原反应?
【思考·提示】 不可能。在化学反应中, 有一种物质失去电子被氧化,必然同时有另一 种物质得到电子被还原,氧化反应和还原反应 必然同时存在于一个反应中。
二、从电子转移的角度认识氧化还原反应 1.电子得失型
点燃 2Na+Cl2=====2NaCl 反应过程中发生了 电子的得失:
2.氧化还原反应与四种基本反应类型 间的关系
(1)置换反应一定属于氧化还原反应。 (2)复分解反应一定不属于氧化还原反 应。
(3)有单质参与的化合反应和有单质生 成的分解反应,均属于氧化还原反应。
(4)图示关系:
特别提醒
1.有单质参与的化学反应不一定是氧化还原 放电
反应,如 3O2=====2O3;
________________________________________
人教版高中化学必修一第二章第三节氧化还原反应 课件(共14张PPT)

课后强化练习
1、(2014上海)含有砒霜(As2O3)的式样和锌、盐酸混合反应,生成砷化氢 (AsH3)在热玻璃管中完全分解成单质砷和氢。若砷的质量为1.5mg,则( ) A.被氧化的砒霜为1.98mg B.分解产生的氢气为0.672ml C.和砒霜反应的锌为3.90mg D.转移的电子总数为6x10-5NA
2、在反应P + CuSO4 + H2O →Cu3P + H3PO4 + H2SO4(未配平)的反应中, 7.5molCuSO4参与反应,被氧化的的P的物质的量为————————,生成 1molCu3P时,参加反应的P的物质的量为——————————mol。
3、配平下列氧化还原反应方程式 (1) NH3 + CuO --- N2 + Cu + H2O (2) Cl2 + KOH -- KCl + KClO3 + H2O (3) Cu + HNO3 --- Cu(NO3)2 + NO↑ + H2O
)
还原剂是 (
)
【例2】
用单桥法标出电子转移的方向和数目,指出氧化产物和还原 产物
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
氧化产物是(
)
还原产物是 (
)
【练习2】
用单桥法标出电子转移的方向和数目,指出氧化产物 和还原产物
5NH4NO3 = 4N2↑+ 9H2O + 2HNO3
(
)
三、电子转移方向和数目以及配平
【例1】用双桥法标出电子转移的方向和数目,指出氧化剂
和还原剂
3S+6KOHK2SO3+K2S+3H2O
人教版化学必修一2.3氧化还原反应(共36张ppt)
氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。
氧化还原反应:有电子转移(得失或偏移)的反应。
氧化还原反应的定义:
有得氧、失氧 的反应
有化合价升降 的反应
表观特征
有电子转移 的反应
实质
氧化还原反应的判据:有无化合价的升降。
原来是因为我!!!
化学反应
氧化还原反应 非氧化还原反应
置换反应
复分解反应
化合反应 分解反应
注意:有单质参加的化合反应和有单质生成的分解反应 全部属于氧化还原反应。
二、氧化剂和还原剂
1、氧化剂和还原剂
化合价降低,得电子,被还原
+2
0 △ 0还是+咱1哥俩好啊!
CuO + H2 === Cu + H2O
化合价升高,失电子,被氧化
氧化剂 还原剂 还原产物 氧化产物
化合价变化本质原因的分析: 化合价的升降 ——电子的得失
Na+ Cl-
还原反应(化合价降低)的实质
是原子得到电子的过程。
0
0
+1 -1
2Na + Cl2======= 2NaCl
氧化反应(化合价升高)的实质 是原子失去电子的过程。
电子得失的动画演示
点燃 H2 + Cl2 ==== 2HCl 化合价的升降——共用电子对的偏移
3、从电子转移(得失或偏移)分析
失去电子,化合价升高,被氧化 电子对偏离,化合价升高,被氧化
0
0 点燃 +1 -1
2Na + Cl2 === 2NaCl
0
0 点燃 +1 -1
H2 + Cl2 === 2HCl
人教版高中化学必修一课件《2-3-1氧化还原反应》

有 有 无 无
是 是 不是 不是
第三节 氧化还原反应 第1课时 氧化还原反应
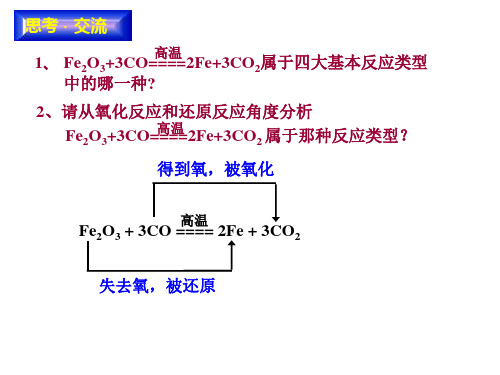
1.从得失氧的角度认识氧化还原反应 (1)CuO失氧,发生了还原反应。 得氧 (2)C,发生了氧化反应。 结论:从得失氧的角度看,一种物质被,另一 氧化 还原 种物质被的反应叫氧化还原反应。
2.从元素化合价变化的角度认识氧化还原反应 △ (1)反应: CuO+ H2=====Cu+ H2O
① CuO失氧,铜元素化合价降低,发生 得氧 ,氢元素化合价升高,发生 ② H2
还原 反应,被还原 氧化 反应,被氧化
点燃 (2)反应: 2Na+ Cl2=====2NaCl(反应物、生成物均无氧元素 )
①氯元素化合价降低,发生 还原 反应,被还原 ②钠元素化合价 升高 ,发生氧化反应,被氧化
有序 号 5 6 7 8来自化学反应 Fe+2HCl=== FeCl2+H2↑ Zn+CuSO4=== ZnSO4+Cu HCl+KOH=== KCl+H2O BaCl2Na2SO4=== BaSO4↓+2NaCl
四种反 应类型
价态有 无变化
是否是氧化 还原反应
置换反应 置换反应 复分解反应 复分解反应
序 号 化学反应 四种反 应类型 价态有 无变化 是否是氧化 还原反应
2NO+O2 1 ===2NO2 CO2+CaO 2 ===CaCO3
化合反应 化合反应
有 无 无
是 不是 不是 是
△ NH4HCO3===== 3 NH3↑+CO2↑ 分解反应 +H2O △ 分解反应 4 2KClO3===== 2KCl+3O2↑
点燃 (2)反应:H2+Cl2=====2HCl ①氯元素化合价 降低 ,共用电子对 偏向 氯原子, 发生还原反应被还原 ②氢元素化合价 升高 ,共用电子对 偏离 氢原子, 发生氧化反应被氧化
人教化学必修1氧化还原反应PPT(38页)
§2.3 氧化还原反应
(第1课时)
1.了解氧化还原反应的特征。 2.了解氧化还原反应的实质。(重点) 3.了解氧化还原反应与四种基本类型的关系。 4.学会电子转移的表示方法----双线桥表示法。
人教化学必修1氧化还原反应PPT(38页 )
火箭的升空,需要燃料的燃 烧。燃料燃烧过程中伴随着 很多化学变化和物理变化, 伴随着许多能量的转化。今 天我们来学习一类重要的化 学反应
电子对偏
生,
向的反应 且得失(或偏向
有电子 转移的
反应
偏离)总数相等
化合反应 分解反应
氧化还原反应
化合
分解 置换
点燃
C + O2 == CO2
有单质参加
置换反应
CaO + H2O == Ca(OH)2
△
2KClO3 == 2KCl + 3O2↑
△
Cu(OH)2 == CuO + H2O
复分解反应 有单质生成
写出下列反应的化学反应方程式,分析参加反应的 物质所含元素的化合价在反应前后是否发生了变化?
(1)硫在氧气中燃烧。 (2)铁丝在硫酸铜溶液中反应。 (3)碳酸钙高温受热。 (4)稀硫酸加入到氢氧化钡溶液中。 (5)氢气还原氧化铜。
化合价升高 被氧化(氧化反应)
+2
0
0
CuO + H2 === Cu +
0
0
+1-1
2H2 + Cl2 = 2HCl
因为有元素化合价升降变化,所以是氧化还原反应。
思考:化合价的升降是什么原因引起的?如何在上 述两反应中表达出来?
化合物NaCl 的形成过程
Na
失去 e-后
失去e-
【人教版】高中化学必修一:2.3.1《氧化还原反应》ppt课件
-6-
M 第1课时 氧化还原反应
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
(2)注意事项: ①箭头、箭尾对应化合价变化的同种元素。 ②必须注明“得到”或“失去”等字样。 ③还原剂失去电子总数与氧化剂得到电子总数相等。
-14-
M 第1课时 氧化还原反应
目标导航
UBIAODAOHANG
(3)用单线桥法标出电子转移的方向和数目。
解析:由化学方程式可知:铜元素化合价升高,从0价变为+2价,被
氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反
应,HNO3发生还原反应。
-19-
M 第1课时 氧化还原反应
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
M 第1课时 氧化还原反应
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
一、氧化还原反应概念之间的关系 1.概念间的关系
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
记忆口诀: 氧→得→降→还→还→还 还→失→升→氧→氧→氧 即:氧化剂→得到电子→所含元素化合价降低→被还原→发生还 原反应→得到还原产物; 还原剂→失去电子→所含元素化合价升高→被氧化→发生氧化 反应→得到氧化产物。
人教版高中化学必修一第二章第三节氧化还原反应 课件(共15张PPT)
2、向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通 入Cl2,通入Cl2的体积(标准状况)和溶液中相 关离子的物质的量关系图正确的是() C
(13年上海高考) 已知氧化性Br2>Fe3+。FeBr2 溶液中通入一定量的Cl2,发生反应的离子方程 式为:a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl,下列选项中的数字与离子方程式中的a、b、c
• (3)第ⅢA、 ⅣA、 ⅤA、 ⅥA、 ⅦA主族元素:除符 合最高正价=主族序数,最低负化合价=主族序数-8外,还 有其它化合价,需要根据化合物中确定元素的化合价准确 推出(负价确定)
注:O和F没有最高正价、在化合物中F只有-1价, O一般为-2价(过氧化物、超氧化物中例外)
• (4)副族元素化合价需要根据化合物中确定元 素的化合价准确推出
• 基本要求:常见化合物能熟练快速标出、通过分
练习1:判断下列那些为氧化还原反应,如果是判断
氧化剂和还原剂,并说出比例关系
①Na2O2+CO2=Na2CO3+O2 ②KClO3+I2=KIO3+Cl2 ③NaH+H2O =NaOH+H2 ; ④CaO2+H2O =Ca(OH)2 +H2O2 ; ⑤KMnO4+HCI=KCI+MnCI2+CI2+H2O
6
练习:按要求书写下列反应的离子方程式:
(1)(2016新课标卷2)双氧水浓度可在酸性条件下用 KMnO4溶液测定该反应的离子方程式 (2) (2016新课标卷2)丁组同学向盛有双氧水溶液的试管 中滴加几滴酸化的FeCl2溶液,溶液变成棕黄色, 发生反应的离子方程式为
人教版高中化学必修一2.3氧化还原反应教案
本节课旨在培养学生的科学探究与创新意识,通过氧化还原反应的学习,提升学生的科学思维能力。具体包括:
1. 提高学生对氧化还原反应本质的理解,培养学生的科学探究能力。
2. 通过实例分析,培养学生的分析与判断能力,使学生能够运用氧化还原反应的知识解决实际问题。
3. 培养学生运用科学语言描述化学反应,提升学生的科学表达与交流能力。
针对这些情况,教师在教学过程中应注重引导学生回顾已有知识,为新知识的学习做好铺垫。通过实例分析、小组讨论等方式,激发学生的兴趣,帮助他们理解氧化还原反应的本质。同时,加强实验教学,提高学生的动手能力,培养学生的观察能力和解决问题的能力。此外,教师还需关注学生的个体差异,因材施教,使他们在原有基础上取得更好的学习成果。
人教版高中化学必修一 2.3 氧化还原反应 教案
课题:
科目:
班级:
课时:计划1课时
教师:
单位:
一、教学内容分析
本节课的主要教学内容为人教版高中化学必修一第2.3节“氧化还原反应”。本节课的核心内容是让学生理解氧化还原反应的概念、特点以及氧化还原反应的基本规律。具体内容包括:
1. 氧化还原反应的定义与特征:氧化还原反应的定义、氧化还原反应的特征(化合价的变化、电子的转移)。
八、板书设计
①氧化还原反应的定义与特征:氧化还原反应的定义、氧化还原反应的特征(化合价的变化、电子的转移)。
②氧化还原反应的基本概念:氧化剂、还原剂、氧化数、电子转移。
③氧化还原反应的类型:单质之间的氧化还原反应、化合物之间的氧化还原反应、置换反应、分解反应、合成反应。
④氧化还原反应的判断:根据化合价变化判断、根据电子转移判断。
2. 实验教学的重要性不可忽视。氧化还原反应是一个实验性很强的概念,通过实验可以帮助学生更好地理解概念和规律。然而,我在实验教学方面还有待改进。我需要设计更多具有启发性和实践性的实验,让学生在实验中亲自体验和探索氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组卷:杨仲发
1.用双线桥分析下列氧化还原反应化合价的变化,并填空:
H 2 + CuO
Cu +H 2O Zn + H 2SO 4 = ZnSO 4 + H 2↑
氧化剂:_________还原剂:_________ 氧化剂:_________还原剂:_________ H 2 →H 2O 发生的是________反应 2H + →H 2发生的是________反应
H 2S + Cl 2 = S↓+ 2HCl
氧化剂:_________还原剂:_________ 氧化剂:_________还原剂:_________ H 2S→S 的过程中发生的是________反应 CO 2 →C 的过程中发生的是_______反应.
2KMnO 4+16HCl (浓)= 2MnCl 2 +2KCl+5Cl 2↑+ 8H 2O 2Na + 2H 2O == 2NaOH + H 2↑
氧化剂:_________还原剂:_________ 氧化剂:_________还原剂:_________ MnO 2 →MnCl 2是被__________(氧化或还原) Na →NaOH 是被__________(氧化或还原)
2Al + 6HCl = 2AlCl 3 + 3H 2↑
CuCl 2 + Fe = FeCl 2 + Cu
氧化剂:_________还原剂:_________ 氧化剂:_________还原剂:_________
氧化产物:________还原产物:___________
氧化产物:________还原产物:________
2KMnO 4
K 2MnO 4 + MnO 2 + O 2↑ 2H 2S + SO 2 = 3S + 2H 2O
氧化剂:_________还原剂:_________ 氧化剂:_________还原剂:_________
氧化产物:________还原产物:___________
氧化产物:________还原产物:________ 2Mg + CO 2 = 2MgO + C 点燃
2.盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。
现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn +2HCl===ZnCl 2+H 2↑______________; ②NaOH +HCl===NaCl +H 2O________;
③2HCl=====电解H 2↑+Cl 2↑____________________。
3.在2Mg +O 2=====点燃2MgO 的化学反应里,氧元素的化合价由0价降低为______价,降低
了______价;氧元素化合价降低的总数为______,即氧原子得到电子的总数为________,则镁元素化合价升高的总数为________,镁原子失去电子的总数为______,1 mol Mg 反应时转移电子的物质的量为________。
4.在相同条件下,下列所给的离子中,哪一种氧化性最强 ( )
A .Ag +
B .Mg 2+
C .Fe 2+
D .Cu 2+
5.单质X 和Y 相互反应生成X 2+Y 2-。
现有下列叙述:①X 被氧化、②X 是氧化剂、③X 具有氧化性、④Y 2-是还原产物、⑤Y 2-具有还原性、⑥X 2+具有氧化性、⑦Y 的氧化性比X 2+的氧化性强,其中正确的是( )
A .①②③④
B .①④⑤⑥⑦
C .②③④
D .①③④⑤
6.在一定条件下,下列微粒的还原性顺序为:Cl -<Br -<Fe 2+<I -
<SO 2,由此判断以下反应在溶液
中不能发生的是( )
A .2Fe 3++SO 2+2H 2O ===2Fe 2++SO 42-+4H +
B .2Fe 2++Cl 2===2Fe 3++2Cl -
C .2Br -+4H ++SO 42-===SO 2+Br 2+2H 2O
D .I 2+SO 2+2H 2O ===4H ++SO 42-+2I -
7.根据以下几个反应:①Cl 2+2KI ===2KCl+I 2 ②2FeCl 2+Cl 2===2FeCl 3
③2FeCl 3+2KI ===2KCl+I 2 +2FeCl 2 ④I 2+SO 2+2H 2O ===2H 2SO 4+2HI
判断氧化性由强到弱的顺序是( )
A .Cl 2>I 2>Fe 3+>SO 2
B .Cl 2>Fe 3+>I 2>SO 2
C .Cl 2>Fe 3+>SO 2>I 2
D .Fe 3+>I 2>Cl 2>SO 2
8.常温下,在溶液中可发生以下反应:①16H ++10Z -+2XO -4===2X 2+
+5Z 2+8H 2O , ②2M 2++R 2===2M 3++2R -,③2R -+Z 2===R 2+2Z -
, 由此判断下列说法错误的是( )
A .氧化性强弱顺序为:XO -4<Z 2<R 2<M 3+
B .还原性强弱顺序为:X 2+<Z -<R -<M 2+
C .Z 元素在反应①中被氧化,在③中被还原
D .常温下可发生反应2M 2++Z 2===2M 3++2Z -
9.有下列三个反应:①Cl2+FeI2===FeCl2+I2②2Fe2++Br2===2Fe3++2Br-
③Co2O3+6HCl===2CoCl2+Cl2↑+3H2O,下列说法正确的是( )
A.反应①②③的氧化产物分别是I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3
C.在反应③中当1molCo2O3参加反应时,2molHCl被氧化
D.可以推理得到Cl2+FeBr2===FeCl2+Br2
10.根据同一氧化还原反应对比氧化性、还原性强弱的原理,请设计一个实验证明铁离子的氧化性强于铜离子。
2015年高一化学练习(14)氧化还原反应2
1.略
2.【答案】(1)氧化性、酸性酸性既有氧化性又有还原性
3.【答案】-224444 2 mol
4.A 5.B 6.C 7.B 8.A 9 C
10.将铜粉加入到氯化铁溶液中,溶液变蓝色,证明铁离子的氧化性强于铜离子。
