胰岛素(Insulin)测定试剂盒(化学发光法)产品技术要求新产业
胰岛素抗体(INS抗体)检测试剂盒(化学发光免疫分析法)产品技术要求泰格

胰岛素抗体(INS抗体)检测试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定性检测人血清中的胰岛素抗体(INS抗体)。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 实验有效性
测定的阳性对照与阴性对照相对发光值(RLU值)均值之比大于3.5时,实验结果成立。
2.4 阴性参考品符合率
10份胰岛素抗体阴性参考品检测结果不得出现假阳性。
2.5 阳性参考品符合率
5份胰岛素抗体阳性参考品检测结果不得出现假阴性。
2.6 重复性
同一份精密性参考品加样10孔,平行测试的相对RLU值强度分析精密度(C.V%)应不高于15.0%。
2.7 批间差
三批不同批次试剂盒,每批精密性参考品加样10孔,平行测试的相对RLU值强度分析精密度(C.V%)应不高于20.0%。
2.8 临界值
2.8.1 阳性率应≥95%;
2.8.2 阴性率应≥95%。
2.9 稳定性
2.9.1试剂盒在37℃放置7天,检测结果应符合2.1~2.6的要求。
2.9.2试剂盒在2℃~8℃放置12个月,检测结果应符合2.1~2.6的要求。
胰岛素(INS)测定试剂盒(化学发光免疫分析法)产品技术要求yuande
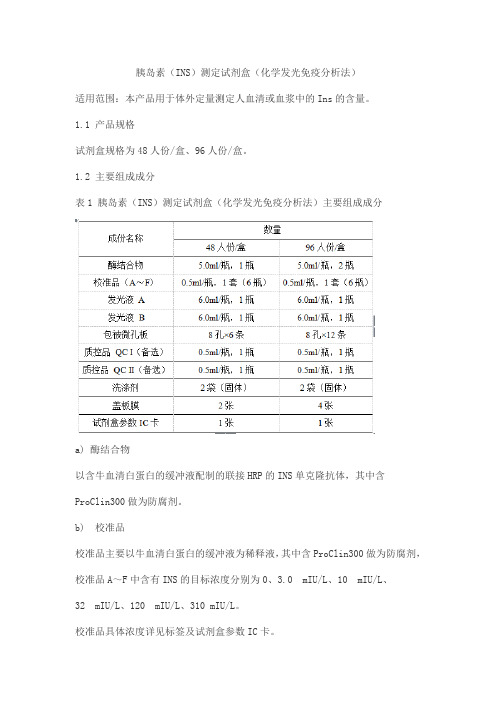
胰岛素(INS)测定试剂盒(化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清或血浆中的Ins的含量。
1.1 产品规格试剂盒规格为48人份/盒、96人份/盒。
1.2 主要组成成分表1 胰岛素(INS)测定试剂盒(化学发光免疫分析法)主要组成成分a) 酶结合物以含牛血清白蛋白的缓冲液配制的联接HRP的INS单克隆抗体,其中含ProClin300做为防腐剂。
b) 校准品校准品主要以牛血清白蛋白的缓冲液为稀释液,其中含ProClin300做为防腐剂,校准品A~F中含有INS的目标浓度分别为0、3.0 mIU/L、10 mIU/L、32 mIU/L、120 mIU/L、310 mIU/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
c) 发光液发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6的Tris-HCl缓冲液配制。
d) 包被微孔板包被有INS单克隆抗体白色聚苯乙烯微孔板,用铝箔袋真空包装。
e) 质控品(备选)以正常人血清为基质制备的冻干品,其中含ProClin300做为防腐剂,其靶值浓度范围QCⅠ(3.74 mIU/L~15.15 mIU/L)QCⅡ(94.26 mIU/L~233.41 mIU/L)。
质控品具体浓度详见质控品参数卡。
不同批号试剂盒中的相同组分不能互换。
2.1 外观a)液体组分应澄清,无沉淀或絮状物,实际装量应不小于标示装量;b)冻干组分呈白色或淡黄色疏松体,加水后应在3分钟内完全溶解;c)所有组分均无包装破损,标示清楚。
2.2 准确度试剂盒内校准品与相应浓度的国家标准品(编号:150519)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.3剂量-反应曲线的线性用双对数数学模型拟合,在[3.0,300] mIU/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
胰岛素测定试剂盒(免疫比浊法)产品技术要求shijiwode

胰岛素测定试剂盒(免疫比浊法)
适用范围:用于体外定量测定血清中胰岛素(In)的含量。
1.1包装规格
1.2主要组成成分
2.1 外观
试剂1为无色澄清液体;试剂2为乳白色液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
在600nm处测定试剂空白吸光度,应≤1.8。
2.4 分析灵敏度
测试10 mU/L的被测物时,吸光度变化(ΔA)应≥0.005。
2.5 准确度
重复检测国家标准物质(编号150519),检测均值与标准物质赋值偏差不超过±15%。
2.6 线性
2.6.1在[0.75,100]mU/L区间内,线性相关系数r≥0.990;
2.6.2在[0.75,20]mU/L区间内绝对偏差不超过±3mU/L;在(20,100 ]mU/L 区间内相对偏差不超过±15%。
2.7 重复性
检测高、中、低三个浓度水平的样本,变异系数CV不超过10%。
2.8 批间差
随机抽取三批试剂盒,测试同一份样本,相对极差不超过±10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7之规定。
胰岛素(INS)测定试剂盒(化学发光法)产品技术要求科美

胰岛素(INS)测定试剂盒(化学发光法)适用范围:本试剂盒用于定量测定人血清中胰岛素(INS)的含量。
1.1包装规格2.1外观和物理检查组分齐全、完整;标签清晰,无磨损;液体试剂无渗漏,无混浊、沉淀或絮状物;包被板包装袋无破损、漏气现象;校准品呈疏松体,加入蒸馏水或去离子水后应在10 min 内溶解,无沉淀或絮状物。
2.2 准确性试剂盒内校准品与相应浓度的胰岛素国家标准品(150519)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以胰岛素国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900-1.100之间。
2.3线性在5~160μIU/mL范围内,剂量-反应曲线的线性相关系数(r)应不小于0.9900。
2.4最低检测限应不大于2.0μIU/mL。
2.5分析内精密度用低、高两个浓度水平的质控样本进行重复检测,其变异系数(CV)应满足:仪器自动操作法应不大于8.0%,手工操作法应不大于15.0%。
2.6批间精密度用三个批号试剂盒分别检测低、高2个浓度水平的样本,三个批号试剂盒之间的批间变异系数(CV)应不大于20.0%。
2.7质控品测定值用INS试剂盒测定质控品血清,其测定结果应在试剂盒规定的范围内。
2.8特异性2.8.1与人血清C-肽(C-P)的交叉反应检测浓度为20 ng/mL的C-P,测定值应不大于3.0 μIU/mL。
2.8.2 与胰岛素原的交叉反应检测浓度为10ng/mL的胰岛素原,测定值应不大于3.0μIU/mL。
2.9稳定性INS试剂盒在2~8℃避光保存,有效期12个月。
试剂盒在2~8℃保存至有效期末,分别检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应符合各项目的要求。
2.10校准品性能指标2.10.1瓶间差瓶间差(CV)应不大于5%。
2.10.2复溶稳定性复溶后的校准品在4℃条件下保存7天后检测2.1、2.2、2.3、2.4、2.5、2.7项,结果应满足各项目要求。
INS(胰岛素、Insulin、INS) Abbott AXSYM试剂标准操作规程SOP

INS(胰岛素、Insulin、INS) Abbott AXSYM1.检验目的检测血清INS主要是用于给糖尿病人提供辅助的诊断信息以及对胰岛素瘤的鉴别诊断,可以动态观察相关疾病的发生发展过程、疗效及预后评估。
2.方法原理采用了美国雅培公司的专利技术——微粒子酶免疫分析(MEIA),即以anti-INS包被微粒子(○M-Ab)与标本中的BNP形成○M-Ab-Ag复合物,当复合物被转移到纤维杯上时,微粒子就不可逆地结合到纤维杯表面的玻璃纤维上,并与加入的碱性磷酸酶标记anti-INS结合,洗去未结合的游离物质,加入底物——四甲基伞形酮磷酸盐,碱性磷酸酶脱去底物的磷酸基而发出荧光,通过MEIA光路元件检测而得到定量结果。
3.性能指标MEIA定量检测INS不精密度CVs为4.0-5.3%,检出限>1.0μU/ml,灵敏度1.0μU/ml,白蛋白、a-1酸性糖蛋白、胆红素等于22种体内相关成份对INS测定无干扰,携带污染率0.001%。
4.标本收集4.1标本类型:静脉血或动脉血的血清或血浆标本均可作为检测标本(抗凝剂可用肝素钠、枸橼酸钠或EDTA,抗凝剂的质量应符合化试药品要求——化学纯或分析纯,使用的比例以厂家推荐为准);其他体液如羊水、胸水、腹水等体液可以作为检测标本,但加热灭活的血清和血库的库存血则不宜作为检测标本。
4.2标本留取:以空腹为宜,收到标本后最好立即离心留取血清或血浆(凝固血应待其充分凝固后收集血清),不能有残留的红细胞、纤维蛋白丝,明显溶血的标本不宜采纳,进行抗凝或血栓溶解治疗的病人采血后宜适当延长凝固时间再进行离心分离血清,羊水中如混有胎儿红细胞可能会导致较高的INS结果,因此抽取羊水应尽量不要混入胎儿红细胞。
4.3标本保存:留取的标本最好在3小时内检测,不能立即检测的应放置于2-8℃最长达24小时(可以含有凝块但要密闭以防蒸发),或者-20℃最长达12个月(不能反复冻融也不能含有凝块和红细胞)。
胰岛素测定试剂盒(胶乳免疫比浊法)产品技术要求lepu

胰岛素测定试剂盒(胶乳免疫比浊法) 适用范围:用于体外定量测定人血清中胰岛素的含量。
1.1规格试剂1: 1×50mL,试剂2: 1×50mL;试剂1: 1×50mL,试剂2: 1×25mL;试剂1: 1×45mL,,试剂2: 1×15mL;试剂1: 1×48mL,试剂2: 1×12mL;试剂1: 1×50mL,试剂2: 1×10mL;试剂1: 1×60mL,试剂2: 1×20mL;试剂1: 1×60mL,试剂2: 1×10mL;试剂1: 2×20mL,试剂2: 2×10mL;试剂1: 1×20mL,试剂2: 1×10mL。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1应为无色或黄色澄清液体,试剂2应为乳白色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在600nm处测定试剂空白吸光度,应≤1.8;2.4 分析灵敏度测试10μIU/mL的被测物时,吸光度变化(ΔA)应不低于0.0006。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[1,100]μIU/mL区间内,线性相关系数r应不低于0.990;2.7.2 [1,12)μIU/mL区间内绝对偏差不超过±1.44μIU/mL;[12,100]uIU/mL 区间内相对偏差超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差≤12%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
胰岛素 C-肽质控品产品技术要求北京康彻思坦
胰岛素/C-肽质控品
适用范围:本品适用于使用厦门万泰凯瑞生物技术有限公司生产的胰岛素测定试剂盒(化学发光微粒子免疫检测法)、C-肽测定试剂盒(化学发光微粒子免疫检测法)进行临床检测时的实验室内部质量控制。
1.1 包装规格
水平1(复溶体积):1×2mL,10×2mL,30×2mL;
水平2(复溶体积):1×2mL,10×2mL,30×2mL;
水平3(复溶体积):1×2mL,10×2mL,30×2mL;
全水平(复溶体积):水平1 1×2mL,水平2 1×2mL,水平3 1×2mL。
1.2 主要组成成分
注:不同批次质控品不能混用;每批次质控品的质控范围见试剂盒内靶值单。
2.1外观
试剂(盒)各组分应齐全、完整;标签应清晰,包装无破损。
质控品冻干品应为疏松体,复溶后液体应澄清。
2.2 质控品赋值有效性
检测结果应在质控范围内。
2.3 均匀性
2.3.1瓶间差
瓶间变异系数应不高于15%。
2.3.2瓶内均匀性
瓶内变异系数应不高于10%。
2.4稳定性
2.4.1复溶稳定性
原包装质控品在开瓶完全复溶后,置于2℃~8℃条件下保存。
放置28天后,胰岛素和C-肽测试结果应符合2.2项的规定;
2.4.2 效期稳定性
原包装质控品在2℃~8℃条件下储存,有效期为36个月。
取效期末产品进行检测,结果应符合2.1、2.2、2.3.2项的规定。
胰岛素测定试剂盒(磁微粒化学发光法)产品技术要求利德曼
胰岛素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中胰岛素(INS)含量。
1.1包装规格100测试/盒。
1.2 主要组成成分表1 产品组成成分注:校准品及质控品浓度具有批特异性,具体浓度见瓶标签。
2.1 外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应澄清,无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2净含量不得低于标示体积。
2.3 特异性(交叉反应)试剂盒与表2中有关潜在交叉反应物应无显著的交叉反应。
表2 交叉反应2.4准确度用国家标准品(编号150519)作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.5空白限应不大于2uIU/ml。
2.6线性在[2,450] uIU/ml的测量范围内,试剂盒的相关系数r应≥0.990。
2.7重复性用(15±3)uIU/ml和(240±48)uIU/ml 的样本各重复检测10次,其变异系数(CV)应不大于8%。
2.8质控品的赋值有效性质控品的测量值应在质控范围内。
2.9批内瓶间差校准品批内瓶间差(CV)应不大于10%质控品批内瓶间差(CV)应不大于10%2.10批间差批间变异系数(CV)应不大于15%。
2.11稳定性2.11.1效期稳定性该试剂盒有效期为12个月,在有效期满后一个月内的任一天检测试剂盒的准确度、空白限、线性和重复性,应符合2.4~2.7的要求。
2.11.2 复溶稳定性校准品和质控品开瓶复溶后,室温保存,可稳定4小时,在第5小时再次检测,相对偏差应在±10%范围内。
校准品和质控品开瓶复溶后,2℃~8℃保存,可以稳定24小时,在第25小时再次检测,相对偏差应在±10%范围内。
2.12溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,校准品溯源至国际标准品(来源NIBSC,编号:66/304)。
胰岛素(INS)测定试剂盒(化学发光法)产品技术要求迪迈
胰岛素(INS)测定试剂盒(化学发光法)适用范围:本试剂盒用于体外定量测定人血清中葡萄糖浓度。
1.1包装规格试剂:1×40ml、试剂:1×80ml、试剂:2×60ml、试剂:3×40ml试剂:4×80ml、试剂:5×60ml、试剂:2×100m试剂:2×125ml;试剂:2×15ml、试剂:10×60ml2.1外观试剂为无色至浅黄或浅红色澄清液体。
2.2 净含量试剂净含量不少于标称装量。
2.3 试剂空白吸光度在37℃、波长340nm、1cm光径条件下,用生理盐水作为样本加入试剂测试时,试剂空白吸光度应不大于0.6。
2.4 分析灵敏度GLU含量为5.55mmol/L时,测定吸光度差值的绝对值应>0.100△A。
2.5 线性区间试剂(盒)线性在[2.2,25]mmol/L区间内:2.5.1 线性相关系数(r)应不小于0.9900;2.5.2 [2.2,3.0]mmol/L区间内,线性绝对偏差不超过±0.5mmol/L;(3.0,25]mmol/L区间内,线性相对偏差不超过±10%。
2.6 精密度2.6.1 重复性用相同批号试剂盒测试两个水平的质控品,所得结果的重复性(变异系数,CV)应不大于5.0%。
2.6.2 批间差用3个不同批号试剂盒测试两个水平的质控品,试剂(盒)批间相对极差应不大于10.0%。
2.7 准确度用国家标准物质(编号:GBW09175b)进行测试,当浓度≤4.16mmol/L,实测值与标示值偏差应不超过±0.833mmol/L;当浓度>4.16mmol/L时,实测值与标示值的偏差应在±20%范围内。
2.8 稳定性试剂盒于2℃~8℃避光环境中密封保存,有效期为12个月。
取到效期后的试剂测定外观、试剂空白吸光度、分析灵敏度、线性区间、重复性、准确度应分别符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
胰岛素测定试剂盒(化学发光免疫分析法)产品技术要求frrk
胰岛素测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中胰岛素的浓度水平。
1.1规格96T。
1.2 组成2.1 外观a)包装标签应清晰、无磨损;b)试剂盒各组份应齐全、包装完好,液体无渗漏。
2.2 线性本试剂盒线性范围为:[1,320]μIU/mL。
线性相关系数r≥0.9900。
2.3空白限不大于1 μIU/mL。
2.4准确度用参考物质作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.5重复性重复检测质控品Q1和 Q2各10次,其批内变异系数(CV)应不大于10%。
2.6批间差用三个批号的试剂盒检测质控品Q1和 Q2,三批号试剂盒之间的批间变异系数(CV)应不大于15%。
2.7质控品赋值有效性质控品测量值应在质控范围内。
2.8特异性2.8.1与人胰岛素原的交叉反应检测浓度为320μIU/mL的人胰岛素原, 交叉反应率应小于1%。
2.8.2与白蛋白的交叉反应检测浓度为320μIU/mL的白蛋白, 交叉反应率应小于1%。
2.8.3与C-肽的交叉反应检测浓度为320μIU/mL的C-肽, 交叉反应率应小于1%。
2.9稳定性规定产品2℃~8℃储存,有效期6个月。
取到效期后的样品检测准确度、空白限、线性、重复性,应符合2.2~2.5的要求。
2.10溯源性根据《GB/T 21415—2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源,赋值过程以及不确定度等内容,校准品溯源至中国食品药品检定研究院标准品(150519)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表1
名称
数量
mL/瓶
100测试/盒
50测试/盒
磁性微球溶液
1
2.5
2.0
发光标记物
10.5
7.0
荧光素标记物
10.5
7.0
低点校准品
2.5Байду номын сангаас
2.0
高点校准品
2.5
2.0
质控品
1.0
1.0
2.3精密度
2.3.1批内精密度
批内变异系数(CV)应≤5%。
2.3.2批间精密度
批间变异系数(CV)应≤10%。
2.4准确度
相对偏差应在±10%范围内。
2.5空白限
试剂盒的空白限应小于0.3 µIU/m L。
2.6溯源性
试剂盒的校准品的赋值可溯源到制造商内部校准品。
1/1
产品名称
胰岛素(Insulin)测定试剂盒(化学发光法)
型号、规格
50测试/盒、100测试/盒
结构及组成
由磁性微球溶液、发光标记物、荧光素标记物、低点校准品、高点校准品和质控品组成。
产品适用范围/预期用途
本试剂用于定量测定人血清内胰岛素(Insulin)的含量。
2.性能指标
2.1外观
a)试剂盒的外观应整洁,标识应清晰、准确、牢固;
