第二章-紫外-可见光谱分析法
合集下载
第二章 可见紫外吸收光谱分析1

由于玻璃可吸收紫外光,所以玻璃棱镜只能用于
用于可见光域内。 石英棱镜可使用的波长范围较宽,可从185- 4000nm,即可用于紫外、可见和近红外三个光域。
光栅是利用光的衍射与干涉作用制成的。
它可用于紫外、可见及红外光域,而且
在整个波长区具有良好的、几乎均匀一 致的分辨能力。
它具有色散波长范围宽、分辨本领高、 成本低、便于保存和易于制备等优点。 缺点是各级光谱会重叠而产生干扰。
它是分光光度法定量分析的依据。
吸光系数
朗伯-比耳定律中,当c以克/升,液层厚 度b以厘米表示时,常数K以a表示,称 为吸光系数。 a的单位为升/克.厘米。 朗伯-比耳定律 :A=abc
摩尔吸光系数
朗伯-比耳定律中,浓度用摩尔/升,液 层厚度b用厘米为单位表示,则K用另一 符号ε来表示。 ε称为摩尔吸光系数(或克分子消光系数), 单位为升/摩尔.厘米。 它表示物质的浓度为1摩尔/升,液层厚 度为1厘米时溶液的吸光度。 朗伯-比耳定律 : A=εbc
72型 721型
751型 WFD-8型
760 40000
~
硅碳棒或 辉光灯
岩盐或萤 石棱镜
WFD-3型 WFD-7型
一、组成部件
光源
单色器
样品池
记录装置
检测器
(一)光源
对光源的基本要求是应在仪器操作所 需的光谱区域内能够发射连续辐射,有足 够的辐射强度和良好的稳定性,而且辐射 能量随波长的变化应尽可能小。 常用的光源有热辐射光源(如钨丝灯 和卤钨灯)和气体放电光源(如氢灯和氘 灯)两类。
1)非单色光的影响: 光吸收定律的重要前提是入射光
仪器分析2-2紫外-可见吸收光谱分析法
例如:铌和钽都可与邻苯三酚生成二元络合物, 但是在草酸介质中,只有钽能与邻苯三酚形成黄色的 钽-邻苯三酚-草酸三元络合物,铌则不能形成类似的 三元络合物,因而提高了反应的选择性。
显色反需考虑的因素 灵敏度; 选择性; 显色剂吸收干扰易排除; 反应生成的有色化合物组成恒定、化学性质稳定。
2.6.2显色反应的选择 2.6.2.1显色剂用量 显色反应一般可以用下式表示:
响因素:灯电压,如钨丝灯和卤钨灯; ☻ 气体放电光源:气体放电发光光源:紫外光区,375-
180nm,如 氢灯和氘灯(功率大4-5倍) ; ☻ 紫外-可见分光光度计测定范围:185nm~1000nm 。
光源 分光系统 吸收池 检测系统 记录系统
2.5.2 分光系统 ☻ 将来自光源的光按波长的长短顺序分散为单色光,并
(2) 双光束分光光度计
通过一个快速转动的扇形镜将经单色器的光一分为 二,然后用另一个扇形镜将脉冲辐射再结合进入换能器 ,即两光束同时分别通过参照池和测量池。
特点:消除、补偿光源和检测器的不稳定,精确度高。
单色器
吸 收 池
吸
信号记录
收
处理系统
池
检测器
(3) 双波长分光光度计
由同一光源发出的光被分成两束,分别经过两个 单色器,得到两个不同的单色光(λ1、λ2),它们 交替地照射同一溶液,然后经过光电倍增管和电子控
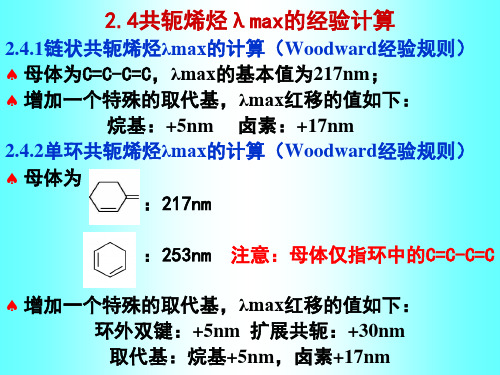
2.4共轭烯烃λmax的经验计算
2.4.1链状共轭烯烃λmax的计算(Woodward经验规则) 母体为C=C-C=C,λmax的基本值为217nm; 增加一个特殊的取代基,λmax红移的值如下:
烷基:+5nm 卤素:+17nm 2.4.2单环共轭烯烃λmax的计算(Woodward经验规则) 母体为
显色反需考虑的因素 灵敏度; 选择性; 显色剂吸收干扰易排除; 反应生成的有色化合物组成恒定、化学性质稳定。
2.6.2显色反应的选择 2.6.2.1显色剂用量 显色反应一般可以用下式表示:
响因素:灯电压,如钨丝灯和卤钨灯; ☻ 气体放电光源:气体放电发光光源:紫外光区,375-
180nm,如 氢灯和氘灯(功率大4-5倍) ; ☻ 紫外-可见分光光度计测定范围:185nm~1000nm 。
光源 分光系统 吸收池 检测系统 记录系统
2.5.2 分光系统 ☻ 将来自光源的光按波长的长短顺序分散为单色光,并
(2) 双光束分光光度计
通过一个快速转动的扇形镜将经单色器的光一分为 二,然后用另一个扇形镜将脉冲辐射再结合进入换能器 ,即两光束同时分别通过参照池和测量池。
特点:消除、补偿光源和检测器的不稳定,精确度高。
单色器
吸 收 池
吸
信号记录
收
处理系统
池
检测器
(3) 双波长分光光度计
由同一光源发出的光被分成两束,分别经过两个 单色器,得到两个不同的单色光(λ1、λ2),它们 交替地照射同一溶液,然后经过光电倍增管和电子控
2.4共轭烯烃λmax的经验计算
2.4.1链状共轭烯烃λmax的计算(Woodward经验规则) 母体为C=C-C=C,λmax的基本值为217nm; 增加一个特殊的取代基,λmax红移的值如下:
烷基:+5nm 卤素:+17nm 2.4.2单环共轭烯烃λmax的计算(Woodward经验规则) 母体为
第2章 紫外可见光谱

3. n→ *跃迁 若形 成不饱和键的原子 含有杂原子(N、 S、P、O),则可 发生n→ * 跃迁
* * n → * → * n→ * →*
反键 反键
能 量
n
未成键 成键 成键
n→ *跃迁所需的能量较→ * 跃迁所需 的能量更小。吸收波长更长,但由于属跃 迁禁阻类型,吸收强度很小。如丙酮除有 → *跃迁外,还有n→ *跃迁,吸收波 长在280nm左右。
部吸收,它就呈现黑色;若反射所有
颜色的光则呈现白色;若透过所以颜 色的光,则为无色。
KMnO4溶液选择 性的吸收了525
nm附近的绿青色
光,而对与绿青
色光互补的400
nm附近的紫色光
几乎不吸收,所
以KMnO4溶液呈
紫红色。
此外,溶液颜色的深浅,决定于溶液
吸收光子的多少,即取决于吸光物质
浓度的高低。如CuSO4溶液的浓度愈高,
发射光谱
hv
无线电波 红外
分子 原子 原子核 分子光谱 原子光谱
紫外可见
紫外可见光谱 红外光谱
核磁共振波谱
核磁共振波谱
3
紫外可见分光光度法(紫外可见
吸收光谱法)是根据溶液中物质的分 子或离子对紫外-可见光谱区的辐射能
的吸收特征和强度对物质进行定性、
定量和结构分析的方法。
该方法具有较高的灵敏度和准确
波长(能量)顺序排列称为电磁波
谱(electromagnetic spectrum)。
15
电磁波谱按能量大小分为若干个区:
无线电波 1~1000 m
微波 10-3~1 m 红外 0.76~1000 m
可见 400~760 nm 紫外 10~400 nm
第二章 紫外-可见分光光度法

入射光通过溶液时,除一部分被吸光粒子吸收
外,还有部分因散射而损失,使透光度减小,
A实。所以往往发生正偏离。 • 化学因素引起的偏离 吸光物质常因离解、缔合而形成新化合物或 互变异构等化学变化而改变其浓度,导致了偏 离。例如 K2Cr2O7在水溶液中存在下列平衡:
2 2CrO4 Cr2O H 2O + 2 H 2 2 7 稀释或增大pH值 浓缩或减小pH值
如图所示,假设有一束强度为I0的单色平行
光,垂直通过一横面积为s的均匀介质。 当光强度为Ix的单色光通过
吸收层(db)后,光强度减弱
了dIx,则厚度为db的吸收
层对光的吸收率为-dIx/Ix,
另一方面,由于db为无限小,所以截面积上所有 吸光质点所占的面积之和(ds)与横截面积(s)之 比(ds/s)可视为该截面积上光子被吸收的几率, 即:-dIx/Ix=ds/s
降低由于单色光不纯造成负偏的方法: • 选择吸收曲线的max作入射光波长。因为吸收 曲线峰值顶部曲线较平坦,入射光谱带内各波长 的值相近。选择max,偏离光吸收定律较小。 只有当干扰物质存在并对待测物质的max产生
吸收时,才选择没干扰的其它波长作入射光波
长。
• 选择高分辨率仪器,使入射光波长范围尽可
5.传播速度c
c=· 单位:cm/s 二.微粒性 光的微粒性特征为:光由光子组成,而光子 具有能量,其能量与波长之间的关系为: E=h· =hc/ h—普朗克常数 6.626×10-34J· s 由上式可知,不同波长的光具有不同的能量, 波长愈长,光的能量愈低;反之,则愈高。
§2-2 分子光谱概述
若干个振动能级;在同一 电子能级和同一振动能级 中,因转动能量不同而分 为若干个转动能级。 若用E电、E振、E转分别表示三个能级, 则三者的关系为:E电>E振>E转。
外,还有部分因散射而损失,使透光度减小,
A实。所以往往发生正偏离。 • 化学因素引起的偏离 吸光物质常因离解、缔合而形成新化合物或 互变异构等化学变化而改变其浓度,导致了偏 离。例如 K2Cr2O7在水溶液中存在下列平衡:
2 2CrO4 Cr2O H 2O + 2 H 2 2 7 稀释或增大pH值 浓缩或减小pH值
如图所示,假设有一束强度为I0的单色平行
光,垂直通过一横面积为s的均匀介质。 当光强度为Ix的单色光通过
吸收层(db)后,光强度减弱
了dIx,则厚度为db的吸收
层对光的吸收率为-dIx/Ix,
另一方面,由于db为无限小,所以截面积上所有 吸光质点所占的面积之和(ds)与横截面积(s)之 比(ds/s)可视为该截面积上光子被吸收的几率, 即:-dIx/Ix=ds/s
降低由于单色光不纯造成负偏的方法: • 选择吸收曲线的max作入射光波长。因为吸收 曲线峰值顶部曲线较平坦,入射光谱带内各波长 的值相近。选择max,偏离光吸收定律较小。 只有当干扰物质存在并对待测物质的max产生
吸收时,才选择没干扰的其它波长作入射光波
长。
• 选择高分辨率仪器,使入射光波长范围尽可
5.传播速度c
c=· 单位:cm/s 二.微粒性 光的微粒性特征为:光由光子组成,而光子 具有能量,其能量与波长之间的关系为: E=h· =hc/ h—普朗克常数 6.626×10-34J· s 由上式可知,不同波长的光具有不同的能量, 波长愈长,光的能量愈低;反之,则愈高。
§2-2 分子光谱概述
若干个振动能级;在同一 电子能级和同一振动能级 中,因转动能量不同而分 为若干个转动能级。 若用E电、E振、E转分别表示三个能级, 则三者的关系为:E电>E振>E转。
第二章紫外-可见分光光度法(Ultraviolet-Visible

=40~80nm时,显色反应对比度为中等; 80nm时,显色反应具有较高的对比度。
一般要求显色剂与有色化合物的对比度 在60nm以上。
2. 对比度在实际分析测定中的意义 对比度实质上表示了显色反应颜色变化 的程度;反映了过量显色剂对测定体系的影 响。 如果显色反应的对比度大,则过量试剂 对测定的影响较小;反之,对比度小,则试 剂对测定的影响就比较大。
2.2 分子吸收光谱概述 1.分子吸收光谱产生的本质 在分子中,除了原子的核能En,质心在 空间的平动能Et外,还有电子运动能Ee,原 子之间的相对振动能Ev,以及分子转动能Er 等。 分子的总能量可写为: E=En + Et + Ee+ Ev+ Er
由于En在一般化学实验条件下不发生变 化,分子的平动能Et又比较小,因此当分子 能级发生跃迁时,能量的改变为: E=Ee + Er +Ev
而n→*、n→*和→*三种跃迁需要能
量相对较小,吸收峰位于近紫外区甚至可见 区,对于紫外-可见分析具有实用意义。
n→*、→*跃迁区别:
n→*(,10~
100L/mol· cm)跃迁产生的 吸收峰强度低于→*(,104L/ mol· cm);
随着溶剂极性的增加,→*跃迁所产生的
c的单位为g· L-1,b的单位为cm时,κ以a表示,称为吸 光系数,其单位为L· g-1· cm-1, A=abc。
c的单位为mol· L-1,b的单位为cm,κ用ε表示,称为摩尔 吸光系数,其单位为L· mol-1· cm-1, A=εbc。
摩尔吸光系数ε的讨论:
(1)吸收物质在一定波长和溶剂条件下的特征常数。 (2)不随浓度c和液层厚度b的改变而改变。 在温度和波长等条件一定时,ε仅与吸收物质本身的 性质有关,与待测物浓度无关;
一般要求显色剂与有色化合物的对比度 在60nm以上。
2. 对比度在实际分析测定中的意义 对比度实质上表示了显色反应颜色变化 的程度;反映了过量显色剂对测定体系的影 响。 如果显色反应的对比度大,则过量试剂 对测定的影响较小;反之,对比度小,则试 剂对测定的影响就比较大。
2.2 分子吸收光谱概述 1.分子吸收光谱产生的本质 在分子中,除了原子的核能En,质心在 空间的平动能Et外,还有电子运动能Ee,原 子之间的相对振动能Ev,以及分子转动能Er 等。 分子的总能量可写为: E=En + Et + Ee+ Ev+ Er
由于En在一般化学实验条件下不发生变 化,分子的平动能Et又比较小,因此当分子 能级发生跃迁时,能量的改变为: E=Ee + Er +Ev
而n→*、n→*和→*三种跃迁需要能
量相对较小,吸收峰位于近紫外区甚至可见 区,对于紫外-可见分析具有实用意义。
n→*、→*跃迁区别:
n→*(,10~
100L/mol· cm)跃迁产生的 吸收峰强度低于→*(,104L/ mol· cm);
随着溶剂极性的增加,→*跃迁所产生的
c的单位为g· L-1,b的单位为cm时,κ以a表示,称为吸 光系数,其单位为L· g-1· cm-1, A=abc。
c的单位为mol· L-1,b的单位为cm,κ用ε表示,称为摩尔 吸光系数,其单位为L· mol-1· cm-1, A=εbc。
摩尔吸光系数ε的讨论:
(1)吸收物质在一定波长和溶剂条件下的特征常数。 (2)不随浓度c和液层厚度b的改变而改变。 在温度和波长等条件一定时,ε仅与吸收物质本身的 性质有关,与待测物浓度无关;
紫外-可见吸收光谱法

基团 -COOR 跃迁类型 π→π* n→π* λmax 165 205
对于有机化合 物最有用
εmax(L/mol· cm) 4000 50
33
常用术语
1)生色团
ቤተ መጻሕፍቲ ባይዱ
能产生紫外-可见吸收的官能团,是含有非键轨道和π分子 轨道的电子体系。能引起n→ π* 和π→π*跃迁
C C C C O
C O N O
34
37
2) 共轭不饱和烃
CH2=CH-CH=CH-CH=CH2: λmax= 258nm
38
3) 羰基化合物
R C Y O
K带: π→π*跃迁,强吸收(共轭体系中) R带:n →π*跃迁,弱吸收(生色团或助色团中)
39
基团结构
-C=O
π→π*
n→π*
λmax(nm)
166
λmax(nm)
280
-C=C-C=O -C=C-C=C-C=O
2) 助色团
是能使生色团吸收峰向长波方向位移并增强其强度的官 能团,是带有非键电子对的基团。含有孤电子对,能与生色 团中π电子相互作用,使π→π*跃迁能量降低并引起吸收峰 位移。 –OH, –NH2, –SH及卤族元素
3) 红移和蓝移 (或紫移)
红移:某些有机化合物经取代反应引入某些基团后,吸 收峰的波长λmax向长波方向移动。 蓝移(紫移):吸收峰的波长λmax向短波方向移动。
质吸收光能,透过溶液后光线的强度要减弱。
I0 It
s I0 Ix I
dx abc
12
透光度和吸光度
透过光强度I与入射光强度I0之比(以T表示)称为透光率
或透光度:
T I I0
(2-1)
T越大,表示它对光的吸收越小。透光率倒数的对数称为 吸光度A。A代表了溶液对光的吸收程度,为无因次量 。
对于有机化合 物最有用
εmax(L/mol· cm) 4000 50
33
常用术语
1)生色团
ቤተ መጻሕፍቲ ባይዱ
能产生紫外-可见吸收的官能团,是含有非键轨道和π分子 轨道的电子体系。能引起n→ π* 和π→π*跃迁
C C C C O
C O N O
34
37
2) 共轭不饱和烃
CH2=CH-CH=CH-CH=CH2: λmax= 258nm
38
3) 羰基化合物
R C Y O
K带: π→π*跃迁,强吸收(共轭体系中) R带:n →π*跃迁,弱吸收(生色团或助色团中)
39
基团结构
-C=O
π→π*
n→π*
λmax(nm)
166
λmax(nm)
280
-C=C-C=O -C=C-C=C-C=O
2) 助色团
是能使生色团吸收峰向长波方向位移并增强其强度的官 能团,是带有非键电子对的基团。含有孤电子对,能与生色 团中π电子相互作用,使π→π*跃迁能量降低并引起吸收峰 位移。 –OH, –NH2, –SH及卤族元素
3) 红移和蓝移 (或紫移)
红移:某些有机化合物经取代反应引入某些基团后,吸 收峰的波长λmax向长波方向移动。 蓝移(紫移):吸收峰的波长λmax向短波方向移动。
质吸收光能,透过溶液后光线的强度要减弱。
I0 It
s I0 Ix I
dx abc
12
透光度和吸光度
透过光强度I与入射光强度I0之比(以T表示)称为透光率
或透光度:
T I I0
(2-1)
T越大,表示它对光的吸收越小。透光率倒数的对数称为 吸光度A。A代表了溶液对光的吸收程度,为无因次量 。
仪器分析-紫外可见光光谱分析

1,3,5-己三烯
正己烷
258
n=4
1,3,5,7-辛四烯
环己烷
304
不共轭双键不发生红移。
C=O双键同C=C双键的共轭作用使n→*和→*跃迁的吸收峰都发生红移。
3)溶剂效应
01
02
03
04
05
极性溶剂使π-π*跃迁发生红移。
pH值
Note: 测UV-Vis应注明溶剂
pH增大,苯酚π-π*吸收带发生红移。
1
2
特点:灵敏度高,实际工作中常用。
1
常将M与某L(显色剂)生成具有电荷迁移的配合物,然后进行含量测定。
2
-* 跃迁 配体具有双键的金属络合物
3
2.3光的吸收定律
郎伯-比尔(Lambert-Beer )定律 入射光强度 吸光强度 反光强度 透光强度 + IS 散射光强度 均匀溶液,散射光小,可忽略
由于n—π共轭参与,使分子整体共轭效应增强。
取代基 苯环或烯烃(吸电子基)上的H被各种取代基取代,多发生红移。 空间异构
蓝移(紫移):使化合物的吸收波长向短波方向移动效应。 影响蓝移因素: 1)溶剂效应 极性溶剂使n-π*跃迁发生蓝移 2)pH值 pH值减小,苯胺的π-π*吸收带蓝移n—π共轭参与少,使分子整体π共轭效应减少。
分子转动-转动能级(rotation)
分子整体能级 E=Ee+Ev+Er
01
03
02
04
05
分子从基态能级跃迁到激发态能级
当有一频率v , 如果辐射能量hv恰好等于该分子较高能级与较低能级的能量差时,即有:
激发态
基态
ΔE电=1-20eV ΔE振=0.05-1eV ΔE转 在分子能级跃迁所产生的能量变化,电子跃迁能量变化最大,它对应电磁辐射能量主要在区紫外—可见区。
正己烷
258
n=4
1,3,5,7-辛四烯
环己烷
304
不共轭双键不发生红移。
C=O双键同C=C双键的共轭作用使n→*和→*跃迁的吸收峰都发生红移。
3)溶剂效应
01
02
03
04
05
极性溶剂使π-π*跃迁发生红移。
pH值
Note: 测UV-Vis应注明溶剂
pH增大,苯酚π-π*吸收带发生红移。
1
2
特点:灵敏度高,实际工作中常用。
1
常将M与某L(显色剂)生成具有电荷迁移的配合物,然后进行含量测定。
2
-* 跃迁 配体具有双键的金属络合物
3
2.3光的吸收定律
郎伯-比尔(Lambert-Beer )定律 入射光强度 吸光强度 反光强度 透光强度 + IS 散射光强度 均匀溶液,散射光小,可忽略
由于n—π共轭参与,使分子整体共轭效应增强。
取代基 苯环或烯烃(吸电子基)上的H被各种取代基取代,多发生红移。 空间异构
蓝移(紫移):使化合物的吸收波长向短波方向移动效应。 影响蓝移因素: 1)溶剂效应 极性溶剂使n-π*跃迁发生蓝移 2)pH值 pH值减小,苯胺的π-π*吸收带蓝移n—π共轭参与少,使分子整体π共轭效应减少。
分子转动-转动能级(rotation)
分子整体能级 E=Ee+Ev+Er
01
03
02
04
05
分子从基态能级跃迁到激发态能级
当有一频率v , 如果辐射能量hv恰好等于该分子较高能级与较低能级的能量差时,即有:
激发态
基态
ΔE电=1-20eV ΔE振=0.05-1eV ΔE转 在分子能级跃迁所产生的能量变化,电子跃迁能量变化最大,它对应电磁辐射能量主要在区紫外—可见区。
紫外可见分光光度法课件

第二章 紫外-可见分光光度法
1
紫外-可见分光光度法
第一节 基本原理
一、紫外-可见吸收光谱(UV-VIS光谱)
• 起源:价电子能级跃迁 由于分子吸收紫外-可见光区的电磁辐射,分
子中价电子(或外层电子)的能级跃迁而产生。 紫外光谱—又称为电子光谱—分子吸收光谱
问题1:为何UV-Vis光谱吸收带都比较宽??
pH值降低(加酸)→ E2、B带蓝移,ε减
pH值增大(加碱)→E2、B带红移,ε增大
6
第二节 紫外可见分光光度计
• 仪器校正
1、波长校正
• 苯的吸收峰校正波长(紫外光区)。在25ml容量瓶内,滴入一滴苯(A.R.), 用无水乙醇稀释至刻度,摇匀后,以无水乙醇为空白,在200~280nm间用 lcm石英池测定吸收度。 如下: 229.2 233.5 238.9 243.2 248.5 254.5 260.6 268.4
图8-4 (+)和(-)丁醇-2的ORD谱线
2)发色团(如羰基) R带:270 nm 。ORD曲线在此处越过零点,进入另一个相
区。形成的一个峰和一个谷组成的ORD谱线—Cotton效应谱线 正的Cotton效应:当波长由长波一端向短波一端移动时, ORD谱线由峰向谷变化 负的Cotton效应: ORD谱线由谷向峰变化 ORD谱线与零线相交点的波长称为λK
2.3.1 蛋白质的圆二色性
在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键, 芳香氨基酸残基及二硫桥键。当平面圆偏振光通过这些光活性的 生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的 吸收不相同,产生吸收差值。由于这种吸收差的存在, 造成了偏 振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质 的圆二色性。
1
紫外-可见分光光度法
第一节 基本原理
一、紫外-可见吸收光谱(UV-VIS光谱)
• 起源:价电子能级跃迁 由于分子吸收紫外-可见光区的电磁辐射,分
子中价电子(或外层电子)的能级跃迁而产生。 紫外光谱—又称为电子光谱—分子吸收光谱
问题1:为何UV-Vis光谱吸收带都比较宽??
pH值降低(加酸)→ E2、B带蓝移,ε减
pH值增大(加碱)→E2、B带红移,ε增大
6
第二节 紫外可见分光光度计
• 仪器校正
1、波长校正
• 苯的吸收峰校正波长(紫外光区)。在25ml容量瓶内,滴入一滴苯(A.R.), 用无水乙醇稀释至刻度,摇匀后,以无水乙醇为空白,在200~280nm间用 lcm石英池测定吸收度。 如下: 229.2 233.5 238.9 243.2 248.5 254.5 260.6 268.4
图8-4 (+)和(-)丁醇-2的ORD谱线
2)发色团(如羰基) R带:270 nm 。ORD曲线在此处越过零点,进入另一个相
区。形成的一个峰和一个谷组成的ORD谱线—Cotton效应谱线 正的Cotton效应:当波长由长波一端向短波一端移动时, ORD谱线由峰向谷变化 负的Cotton效应: ORD谱线由谷向峰变化 ORD谱线与零线相交点的波长称为λK
2.3.1 蛋白质的圆二色性
在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键, 芳香氨基酸残基及二硫桥键。当平面圆偏振光通过这些光活性的 生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的 吸收不相同,产生吸收差值。由于这种吸收差的存在, 造成了偏 振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质 的圆二色性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目视比色法
• 用眼睛观察、比较溶液颜色深度以确定物质含量的方法。 标准系列
未知样品
光电比色法(分光光度法)
• 通过滤光片得一窄范围的光(几十nm)
光电比色计结构示意图
二、紫外-可见分光光度法的特点
• 1.具有较高的灵敏度和一定的准确度,适用于微量组分的测定。
• 2.适用范围广 • 近年来,由于分光光度法的选择性和灵敏度都有所提高,几乎所有的
第四节 紫外-可见分光光度计
光源
参比
样品
0.575
单色器
吸收池
检测器
信号显 示系统
I0
AlgTlg1lgI0 bc T It
It
1.光源
• 光源的作用是供给符合要求的入射光。分光光度计对光源 的要求是:在使用波长范围内提供连续的光谱,光强应足 够大,有良好的稳定性,使用寿命长。
• 在可见区常用的光源为钨灯或卤钨灯,可用的波长范围为 320~1000nm;在紫外区常用的光源为氢灯和氘灯,它们 发射的连续光波长范围为185~375nm,其中氘灯的辐射 强度大、稳定性好、使用寿命长。
1cm时该溶液在某一波长下的吸光度。
5、吸光系数
• 吸光系数是吸收物质在一定波长和溶剂条件下的特征常数。 • 吸光系数的特点 • (1)不随浓度和液层厚度的改变而改变。在温度和波长等条件一定时,吸光
系数仅与吸收物质本身的性质有关,与待测物浓度无关,可作为定性鉴定的 参数。 • (2)同一吸收物质在不同波长下的ε值是不同的,在最大吸收波长λmax处 的摩尔吸光系数,常以εmax表示。εmax表明了该物质最大限度的吸光能力, 也反映了光度法测定该物质可能达到的最大灵敏度。 • (3)εmax越大表明该物质的吸光能力越强,用光度法测定该物质的灵敏度越 高。εmax>6×104L/(mol·cm)属于高灵敏度;εmax在1×104~6×104 L/(mol·cm)属于中等灵敏度,εmax<1×104L/(mol·cm)属于低灵敏度。
• 如果把适当颜色的两种光按一定强度比例混合,也可成为 白光,这两种颜色的光称为互补色光。
红 紫
蓝
白
青蓝 青
橙 黄
绿
三、溶液颜色的产生
• 溶液颜色是基于物质对光有选择性吸收的结果。
光谱示意
表观现象示意
完全吸收
完全透过
吸收黄色光
四、溶液的吸收光谱曲线
• 吸收光谱曲线是通过实验获得的,具体方法是:将不同波 长的光依次通过某一固定浓度和厚度的有色溶液,分别测 出它们对各种波长光的吸收程度(用吸光度A表示),以 波长为横坐标,以吸光度为纵坐标作图,画出曲线,此曲 线即称为该物质的光吸收曲线(或吸收光谱曲线),它描 述了物质对不同波长光的吸收程度。
• 一、朗伯-比耳定律 • 1、透光度和吸光度
入射光 I0
透射光It
• 当一束辐射强度为I0的平行单色光垂直照射到一定浓度的均匀透明溶液时,
由于溶液的吸收,透过光的辐射强度变为It,则It与I0之比称为透光度,用T表
示:
T It I0
• 物质对光的吸收程度可用吸光度A表示,吸光度与光强度、透光度之间的关
无机物质和许多有机物质的微量成分都能用此法进行测定。 • 3.手续简便,分析速度快,适用于控制分析 • 分光光度法的操作过程,主要包括试样的溶解,待测组分的显色等内
容,操作简便,完成吸光光度分析的全过程一般只需几十分钟,甚至 可在几分钟内完成,适合于控制分析。 • 4.仪器简单,容易掌握 • 但吸光光度分析也有一定的局限性,对超纯物质的分析,灵敏度达不 到要求,相对误差较大,不利于高含量组分的测定。
• 当溶液的浓度为质量浓度单位g/L时,其数学表达式为 • A=abc • 式中:a为质量吸光系数,L/(g·cm),相当于浓度为1g/L、液层厚度为1cm
时该溶液在某一波长下的吸光度。 • 当溶液的浓度单位为mol/L时,其数学表达式为 • A=εbc • 式中:ε为摩尔吸光系数,L/(mol·cm),相当于浓度为1mol/L,液层厚度
• 当它们吸收一定能量ΔE后,这些价电子将跃迁到较高的能级(激发态),此 时电子所占的轨道称为反键轨道,而这种特定的跃迁是同分子内部结构有着 密切关系的。
• (1)σ→σ*跃迁 • 所需能量最大。 • σ*表示σ键电子的反键轨道,饱和碳氢化合物只有σ键电子,
它吸收远紫外线(10-200nm)后,由基态跃迁至反键轨道。 • (2)n→σ*跃迁 • 所需能量较大。 • 饱和碳氢化合物中氢被氧、氮、硫、卤素等取代后(单
• 例2:铁(Ⅱ)浓度为2.5×10-4g/L的溶液,与邻菲罗啉反 应,生成橙红色络合物。该络合物在波长508nm,比色皿 厚度为2cm时,测得 A=0.15。计算邻菲罗啉亚铁的 a及ε, 铁的相对原子质量为55.85g/mol。
ab Ac 220 .5 .115 0 430L0 /g (cm ) 5.5 8 5300 1.671 640 L/m ( o cm l)
• 例1:已知含Fe3+浓度为500μg·L-1的溶液用KCNS显色, 在波长480nm处用2cm吸收池测得A=0.197,计算摩尔吸 光系数,铁的相对原子质量为55.85g/mol。
c(F3e)501 0 068.9 51 06(moL l1) 5.5 85
b Ac8.90 5.1 1 9 06721.1140(Lm o1lcm 1)
• 利用比较待测溶液本身的颜色或加入试剂后呈现的颜色的 深浅来测定溶液中待测物质的浓度的方法就称为比色分析 法。比色分析中根据所用检测器的不同分为目视比色法和 光电比色法。
• 应用分光光度计,根据物质对不同波长的单色光的吸收程 度不同而对物质进行定性和定量分析的方法称分光光度法 (又称吸光光度法)。
级间距离较近,电子容易激发,吸收波长向长波长方向移动。 • (4)n→π*跃迁 • 所需能量最低。 • 凡有机化合物中含有杂原子氮、氧、硫等同时又具有双键,吸收紫外
光后产生n→π*跃迁,吸收带在200-400nm之间,为弱吸收,ε在10100之间。
• 上述四种类型的电子跃迁,按照所需能量的大小进行排列,其次序为: • σ→σ※> n→σ※>π→π※> n→π※
系为:
AlgTlg1lgI0 T It
• 2、朗伯定律
• 即当一束平行光照射到一固定浓度的溶液时,其吸光度
与光通过的液层厚度成正比,这就是朗伯定律,其数学
表达式为:
• A=k1b • 式中:b——液层厚度;
•
k1——比例系数。
• 3、比耳定律
• 当单色光通过液层厚度一定的有色溶液时,溶液的吸光度
第二章 紫外-可见 光谱分析法
第一节 概述
• 紫外-可见光谱分析法是基于物质分子对波长为 200-780nm区域内光辐射的吸收而建立起来的 分析方法。由于200-780nm光辐射的能量主要 与物质中原子的价电子的能级跃迁相适应,所以 紫外-可见分光光度法又称电子光谱法。
一、紫外-可见分光光度法分类
1、入射光非单色性引起偏离
• 吸收定律成立的前提是入射光是单色光。但实际上, 一般单色器所提供的入射光并非是纯单色光,而是 由波长范围较窄的光带组成的复合光。而物质对不 同波长的吸收程度不同(即吸光系数不同),因而 导致了对吸光定律的偏离。
2、溶液的化学因素引起偏离
• 溶液中的吸光物质因离解、缔合,形成新的化合 物而改变了吸光物质的浓度,导致偏离吸收定律。 因此,测量前的化学预处理工作十分重要,如控 制好显色反应条件,控制溶液的化学平衡等,以 防止产生偏离。
键),其孤对电子 n较σ键电子易于激发,使电子跃迁所需 能量减低,吸收波长较长,一般在1→π*跃迁 • 所需能量较小。 • 含有π电子的基团如烯类、炔类都能发生π→π*跃迁,非共轭的π→π*
跃迁所吸收的波长较短。 • 具有共轭双键的化合物,相间的π键与π键形成大π键,由于大π键各能
• 4、溶剂效应 • 由于溶剂的极性不同引起某些化合物的吸收峰的波长、强
度及形状产生变化,这种现象称为溶剂效应。一般溶剂效 应有以下规则:当溶剂由非极性变为极性时,对于n→π* 跃迁类型化合物,吸收产生蓝移,并且吸收强度增大,对 于π→π*跃迁类型的化合物,吸收产生红移,并且吸收强 度减弱。
第三节 光的吸收定律
要用于多组分同时测定。
二、影响光吸收定律的主要因素
• 根据吸收定律,在理论上,吸光度对溶液浓度作图所得的 直线的截距为零,斜率为εb。实际上吸光度与浓度关系有 时是非线性的,或者不通过零点,这种现象称为偏离光吸 收定律。
• 如果溶液的实际吸光度比理论值大,则为正偏离吸收定律; 吸光度比理论值小,为负偏离吸收定律。
高锰酸钾的光吸收曲线
• (1)KMnO4溶液对不同波长的光的吸收程 度不同,对绿色光区中 525nm的光吸收程度 最大(此波长称为最大吸收波长,以λmax表 示),所以吸收曲线上有一高峰。在进行光 度测定时,通常都选择在λmax处来测量,这 时可得到最大的灵敏度。
• (2)不同浓度的 KMnO4溶液吸收曲线相似, λmax不变。所不同的是吸收峰峰高随浓度的 增加而增高。这个特性可作为物质定量分析 的依据。
3、比尔定律的局限性引起偏离
• 严格地说,比尔定律是一个有限定律,它只适用于浓度小 于0.01mol/L的稀溶液。因为浓度高时,吸光粒子间平均 距离减小,以致每个粒子都会影响其邻近粒子的电荷分布。 这种相互作用使它们的摩尔吸光系数ε发生改变,因而导 致偏离比尔定律。为此,在实际工作中,待测溶液的浓度 应控制在0.01mol/L以下。
2、紫外吸收光谱中常用的术语
• 1、生色团(或发色团) • 分子中含有不饱和键,能吸收外来辐射时并引起n-*和-*跃迁,可
产生此类跃迁或吸收的结构单元,称为生色团。 • 如乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基、腈基—CN。 • 2、助色团 • 含有未成键n电子,本身不产生吸收峰,但与生色团相连时,能使生
