2019年中考化学总复习教材考点梳理第二单元探秘水世界第2课时构成物质的微粒元素课件鲁教版
2019年中考化学黄金知识点系列专题12构成物质的微粒原子机构

2019年中考化学黄金知识点系列专题12构成物质的微粒原子机构聚焦考点☆温习理解一、构成物质的微粒:分子、原子、离子等微粒1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质3、由离子构成的物质:氯化钠、氢氧化钠、高锰酸钾等4、物质构成的描述:物质由××分子(或原子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
二、分子1、基本性质:(1)质量、体积都很小;(2)在不停地运动且与温度有关。
温度越高,运动速率越快例:水的挥发、品红的扩散;(3)分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
(4)同种物质的分子的性质相同,不同物质的分子的性质不同。
2、分子的构成:分子由原子构成。
分子构成的描述:①××分子由××原子和××原子构成。
②一个××分子由几个××原子和几个××原子构成。
3、含义:分子是保持物质化学性质的最小粒子。
例:氢分子是保持氢气化学性质的最小粒子4、从分子和原子角度的应用(1)物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类不变。
发生化学变化时,分子种类发生改变。
(2)纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
(3)单质与化合物单质的分子由同种原子构成;化合物的分子由不同种原子构成。
三、原子1、含义:原子是化学变化中的最小粒子。
例:氢原子、氧原子是电解水中的最小粒子2、化学反应的实质:在化学反应中分子分裂为原子,原子再重新组合成新的分子。
四、离子(1)、概念:带电的原子或原子团(2)、分类及形成:阳离子(由于原子失去电子而形成)带正电阴离子(由于原子得到电子而形成)带负电注意:原子变为离子时,质子数、元素种类没有改变;电子数、最外层电子数发生了改变。
鲁教版九上化学第二单元知识总结

鲁教版九上化学第二单元探秘水世界第一节运动的水分子一、微粒观点1、物质都是由肉眼看不见的、极其微小的微粒构成的2、构成物质的微粒在不断的运动3、微粒之间有空隙【知识解读】1、构成物质的基本微粒是指分子、原子、离子,它们的体积质量都很小,肉眼看不见。
灰尘满天,就不能说微粒在不断运动,原因是灰尘肉眼看得见,是固体小颗粒,不是微粒。
2、分子间的间隔与温度与压强有关:温度越高分子间的间隔越大:如热胀冷缩;压强越大分子间的间隔越小,如:空气加压压缩,体积减小。
3、水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量是,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)二、纯净物和混合物纯净物:由单一物质组成的物质混合物:由由两种或两种以上的物质组成的物质【知识解读】1、从微观角度把握概念:纯净物里只有一种分子,混合物是由两种或两种以上的分子构成的2、混合物与纯净物的判断:①自然界中的物质、食品饮料、溶液、合金都是混合物;纯净物一般都是按化学名称命名,即根据名称可知道其组成。
②纯净的空气是混合物,冰水混合物是纯净物。
③自然界中的水是混合物,只有说“水”“纯净水”“蒸馏水”时才是纯净物。
三、水的净化方法(重点、难点)水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
【知识解读】1、沉降包括静置沉降和吸附沉降。
净水过程中先静置自然沉降后,再加明矾进行化学沉降。
2、明矾:吸附水中的悬浮的杂质而沉降;活性炭:吸附水中细小的杂质。
氯气、漂白粉:消毒杀菌3、吸附、沉降、过滤只能除去不溶性固体杂质,使浑浊的水变清澈,但是不能除去溶于水的杂质;要除去水中可溶性杂质,要用蒸馏法。
鲁教版初中化学-第二单元-探秘水世界知识点梳理
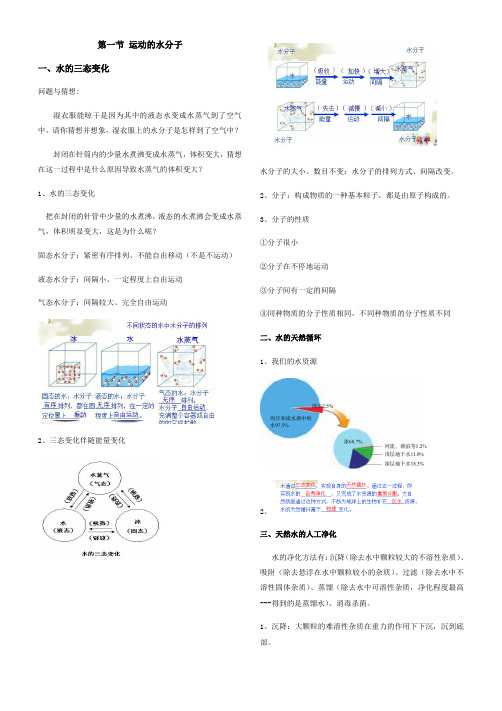
第一节运动的水分子一、水的三态变化问题与猜想:湿衣服能晾干是因为其中的液态水变成水蒸气到了空气中,请你猜想并想象,湿衣服上的水分子是怎样到了空气中?封闭在针筒内的少量水煮沸变成水蒸气,体积变大,猜想在这一过程中是什么原因导致水蒸气的体积变大?1、水的三态变化把在封闭的针管中少量的水煮沸,液态的水煮沸会变成水蒸气,体积明显变大,这是为什么呢?固态水分子:紧密有序排列、不能自由移动(不是不运动)液态水分子:间隔小、一定程度上自由运动气态水分子:间隔较大、完全自由运动2、三态变化伴随能量变化水分子的大小、数目不变;水分子的排列方式、间隔改变。
2、分子:构成物质的一种基本粒子,都是由原子构成的。
3、分子的性质①分子很小②分子在不停地运动③分子间有一定的间隔④同种物质的分子性质相同,不同种物质的分子性质不同二、水的天然循环1、我们的水资源2、三、天然水的人工净化水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
1、沉降:大颗粒的难溶性杂质在重力的作用下下沉,沉到底部。
2、过滤:(1)过滤器的制作(2)过滤装置及注意事项(3)实验分析:过滤后的滤液仍然浑浊,可能的原因有哪些?液面高于滤纸边缘;滤纸破了;盛接滤液的烧杯不干净等。
3、吸附:活性炭吸附剂,可以吸附一些有颜色、有气味的杂质。
4、蒸馏:5、自来水厂净水6、硬水:含有较多可溶性钙,镁矿物质的天然水软水:不含或含较少钙,镁矿物质的水区分:在等量的硬水和软水中,分别滴加等量的相同肥皂出现较多泡沫的是软水,出现泡沫较少或没有泡沫转化:设法消除或减少硬水中的钙,镁矿物质,在生活中在实验室常用蒸馏法,工业上用离子交换法或药剂软化法。
危害:用硬水洗涤衣服,既浪费肥皂又洗不净衣服;锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重的还可以引起锅炉爆炸(水垢可有稀盐酸除去:CaCO3+2HCl=CaCl2+H2O+CO2↑)。
初中化学《微粒构成物质》单元教学设计以及思维导图

微粒构成物质适用年级九年级所需时间课内共用10课时,每周4课时;课外共用2课时主题单元学习概述本单元教材“探秘水世界”,实际上是要以水为代表物,引领学生探究物质的构成、组成及变化之秘,让学生在开始化学学习之初,就初步形成从微粒的观点看物质、看物质的变化的基本观念,初步建立物质构成的微粒观、物质组成的元素观是本单元最为重要的教学目标。
主题单元规划思维导图主题单元学习目标(1)通过对水三态变化实质及水的天然循环的分析,从分子的角度认识水的三态及其转化,从而认识构成物质的基本粒子—分子的基本特征,初步认识物质的微粒性。
通过对天然水成分的分析和净化天然水的探究活动,了解吸附、沉降、过滤和蒸馏等净化水的常用方法,了解纯净物和混合物的概念,初步形成物质分类的思想。
(2)通过对水的分解(水的电解)和水的合成(氢气燃烧)过程的微观分析,初步认识物质发生化学变化的实质。
了解化合反应和分解反应的概念。
(3)通过对科学家研究原子结构历史的分析,知道原子是由原子核和核外电子构成的,初步认识原子内部各粒子的数量关系,了解原子核外电子的分布及其在化学变化中的表现。
学会科学表示原子质量大小的方法——相对原子质量。
(4)通过人类认识对物质组成基本成分—元素的认识历程分析,理解什么是元素?学习用元素符号表示常见的元素,知道元素的简单分类,了解单质和化合物的概念及两者之间的区别与联系。
初步认识元素周期表的结构,并能从元素周期表中找到指定元素的相关信息。
对应课标专题一:1.知道硬水与软水的区别。
2.了解吸附、沉降、过滤和蒸馏等净化水的常用方法。
3.认识物质的三态变化及其转化。
4.区分纯净物和混合物。
5. 认识物质的多样性。
专题二:1.认识物质的微粒性,知道分子是构成物质的微粒。
2.能用微粒的观点解释某些常见的现象。
3.认识化学变化的基本特征,初步了解化学反应的本质。
4.初步认识常见的化合反应、分解反应。
专题三:1.知道原子、离子等都是构成物质的粒子。
初中中考化学复习讲义课件 中考考点全攻略 主题2 第9讲 物质构成的微粒 元素

片刻酒商、酒鬼闻风而来……这与下列化学原理相关的
是( )
B
▪ A.分子的质量很小,分子是我们肉眼看不见的微粒
▪ B.分子的体积很小,分子在不停地运动着
▪ C.分子之间有间隙,因此造成了物质的三态变化
▪ D.分子的体积、质量都很小,但分子是真实存在的
▪ 用微观粒子的观点解释现象 ▪ 3.(2020·凉山州)杜甫的绝句《沙暖睡鸳鸯》
2.元素周期表 (1)发现及编制者:俄国化学家门捷列夫。 (2)编排结构 ①横行:每一横行为一个周期,共有 7 个周期。 ②纵列:每一纵列为一个族,共 16 个族。
[点拨:有18个纵列,8、9、10三个纵列共同组成一个族]
(3)周期表中的一些规律 同一周期的元素,原子的电子层数相同;由左往右,最外层电子数依次从 1 递增至 8;第一周期为气体元素,其他周期的元素由金属→非金属→稀 有气体变化。同一族的元素,最外层电子数相等,从上到下,电子层数递 增,化学性质相似。
[原因:由元素原子的最外层电子数决定]
▪ (4)元素周期表中每一格的信息(以碳元素为例)
▪ 1.元素的化学性质由原子最外层电子数决定,最外层 电子数相等,化学性质一定相似。( )
×
▪ 2.同种元素的原子质子数相等,则质子数相等的粒子 一定属于同种元素。
▪( )
×▪ 3.单质由同种元素组成,则由同种元素组成的物质一
[元素、物质属于宏观,只讲种类,不讲个数]
▪ ②元素符号表示的意义
▪ a.宏观:表示某种元素,有时还表示某种由 原子构成的物质,如Fe。
▪ b.微观:表示某种元素的原子,如元素符号 “O”既表示氧元素,又表示1个氧原子;2O
[带“子”只属于能微观表,如示原2子个、分氧子、原离子子,既。讲种类也讲个数]
2019年中考化学一轮复习第二单元探秘水世界第2课时物质构成的奥秘练习

第2课时物质构成的奥秘姓名:________ 班级:________ 限时:______分钟1.(2018·岳阳中考)地壳中含量最多的元素是( )A.Si B.AlC.O D.Fe2.(2018·泰州中考)下列物质由离子构成的是( )A.二氧化碳B.水C.金刚石D.氯化钠3.(2019·原创题)计算能力达到每秒百亿亿次的“天河三号”超级计算机,其试验平台在2018年下半年正式启用。
超级计算机的芯片是由非金属单质硅制成,构成硅的微粒为( )A.离子B.原子C.分子D.电子4.(2018·重庆中考)碳12是指含6个中子的碳原子。
下列对氧16和氧18两种氧原子的说法正确的是( )A.质子数相同B.质量相同C.电子数不相同D.16和18表示原子个数5.(2019·易错题)下列有关原子的说法正确的是( )A.原子能构成分子,不能直接构成物质B.碳12原子和碳13原子的中子数相同C.原子在化学变化中不能再分,只能重新组合D.原子中一定含有质子、中子、电子6.(2018·甘肃中考)元素观、微粒观是化学的重要观念。
下列有关元素和微粒的说法不正确的是( )A.分子、原子和离子都是构成物质的粒子B.同种元素的原子核内质子数与中子数一定相等C.元素的原子序数与该元素原子核电荷数在数值上相同D.在物质发生化学变化时,原子的种类不变,元素的种类也不会改变7.(2018·临沂中考)从分子的角度解释下列事实,错误的是( )A.酒香不怕巷子深——分子在不断地运动B.1滴水大约有1.67×1021个水分子——分子很小C.醋酸是酸的,蔗糖是甜的——不同种分子性质不同D.将空气液化,体积变小——分子体积变小8.(2019·原创题)中国诗词既蕴含人文思想,又焕发理性光辉。
对下列诗句的化学解释不合理的是( )A.有麝自来香,不用大风扬——分子在不断地运动B.炉火照天地,红星乱紫烟——一氧化碳还原氧化铁C.朱门酒肉臭,路有冻死骨——肉中含有的蛋白质是六大营养素之一D.美人首饰侯王印,尽是沙中浪底来——发生化学变化9.(2018·新疆中考)如图是探究分子运动的实验。
2019中考化学高频考点剖析 专题十一构成物质的微粒(学案)
备考2019中考化学高频考点剖析专题十一构成物质的微粒考点扫描☆聚焦中考构成物质的微粒,是每年中考的必考内容之一,考查的知识点包括原子的发现史、原子结构和性质等;相对原子质量;原子核外电子排布;离子的概念、分类、书写等。
总体来看,难度系数低,以选择和填空题为主。
结合2017和2019年全国各地中考的实例,我们从三个方面进行构成物质微粒问题的探讨:(1)原子、分子和离子;(2)核外电子排布;(3)现象的微观解释和构成物质的微粒;考点梳理☆温习理解一、原子1、原子发现史(1)道尔顿:原子,是最小的实心球体。
(2)汤姆森:英国科学家汤姆森发现,认为原子在一定的条件下是可分的。
并设计了一个原子模型,认为原子像葡萄干布丁,其中葡萄干是带的电子,布丁是带正电的物质。
(3)卢瑟福:α粒子轰击金箔实验现象及分析:①大多数α粒子穿过金箔,方向,说明原子内部有。
②部分α粒子方向偏转,带正电的α粒子与带正电的原子核产生,方向偏转。
③极少数α粒子被反弹过来说原子核的比α粒子大很多。
结论:原子是由和构成。
2、原子结构原子核(带)(带正电)(1)原子()中子()核外电子(带)(2)核电荷数:原子核所带。
(3)原子质量几乎全部集中在上,但原子核体积很小,原子的体积由核外电子决定。
(4)在原子中,质子数==3、原子或分子的基本性质1、质量和体积都;2、粒子之间都有;3、粒子总在;4、保持物质化学性质的微粒,决定于构成该物质的微粒是什么,如由分子构成的物质,保持其化学性质的最小微粒就是 ,由原子构成的物质,保持其化学性质的最小微粒就是 。
保持水的化学性质的粒子是 ;保持铁的化学性质的粒子是 。
同种分子化学性质 ,不同种分子化学性质 。
4、相对原子质量(1)定义:一个原子质量与一个 的质量的 的比值就是相对原子质量。
(2)公式:相对原子质量= 数+ 数(3)理解:①相对原子质量不是个质量是个 ; ②有单位,是“ ”常省略不写;③相对原子质量之比等于原子实际质量之比;④引入相对原子质量是为了书写、记忆和运算 。
中考化学专题复习 专题2 构成物质的微粒课件
量为
,硫原子的质子数为
,该元素的原
子易
(填“得”或“失”)电
子。
解析:根据元素周期表中的一格可知(kě zhī),汉字下面的数字表示 相对原子质量,硫元素的相对原子质量为32.06.由硫原子的结构 示意图可知(kě zhī),圆圈内的数字是16,硫原子原子核内有16个质 子;最外层弧线上的数字是6,最外层电子层上有6个电子,在化
12/8/2021
第二页,共十一页。
【知识(zhī shi)网络】
定义:保持由其构成的物质的 化学性质的最小粒子
分子(fēn特zǐ) 点:微粒性、运动性、间隔性
粒构 成
(gòuchéng)
物 质
原子
的
微
构成:由原子构成(注:由分子构成的物质包括气体非金属单 质、非金属化合物、酸类、有机物等)
定义: 化学性质中的最小粒子
定义:带电(dài diàn)的原子或原子团
分类(fēn阳离子:如Fe2+、Na+、NH4+ lèi) 阴离子:如O2-、OH-、S042-
构成:由离子构成的物质包括金属氧化物、碱类、盐类等。
要求掌握氯化钠是由 离
构成的。离子
子 离子与 核电荷数 >核外电子数,该粒子为阳离子,如Na+
(lízǐ) 原子的 核电荷数 = 核外电子数,该粒子为原子,如Na
4.元素的化学性质(huàxué xìngzhì)与其原子最外层电子数的关
系
元素
最外层电子数 得失 元素化学
电子 性质
稀有气体元素 8个(He最外层电
子数为2•)
金属元素
少于4个
失去
比较稳定 不稳定
非金属元素
中考总复习化学2-第10讲 构成物质的微粒、元素 (2)
3.元素周期表的规律 (1)同一周期的元素,原子的电子层数相同;由左往右,最外层电子数依次从 1递增至8(第一周期除外);第一周期为气体元素,其他周期的元素种类依次 为金属→非金属→稀有气体。 (2)同一族的元素,最外层电子数相同,化学性质相似(氢除外);从上到下, 电子层数递增。
【归纳总结】 周期数=原子核外电子层数,如钠原子核外有3个电子层,则钠元素位于元素 周期表的第三周期。
知识考点清单 考点 1 构成物质的微粒
1.构成物质的微粒有① 分子、原子、离子 。 2.由② 分子 构成的物质,如氢气、氧气、水、二氧化碳等。 由③ 原子 构成的物质,如铁、铜、氦气、金刚石、硫等。 由④ 离子 构成的物质,如氯化钠、硫酸铜等。
【归纳总结】各微粒之间的关系:
考点 2 分子和原子 1.分子和原子的异同
B.
——铝原子
C. 2He——2个氦元素
D. 2NO2——2个二氧化氮分子
9
10
返回命题点导航
10.(2014·河北6题,2分)分析推理是化学学习中常用的思维方法。下列分 析推理正确的是 ( B ) A.浓硫酸具有吸水性,所以浓盐酸也具有吸水性 B.O2和O3的分子构成不同,所以它们的化学性质不同 C.离子是带电荷的微粒,所以带电荷的微粒一定是离子 D.酸雨的pH小于7,所以pH小于7的雨水一定是酸雨
分子
原子
定 义
分子是⑤ 保持物质化学性质 的最 小粒子
原子是⑥ 化学变化中 的最小粒子
性 质
质量小、体积小;不断运动;有间隔;同种粒子的化学性质相同
联 系
分子是由原子构成的。分子、原子都是构成物质的微粒
区 别
在化学变化中,⑦
分子
可以再分,而⑧
