第三单元化学能与电能的转化
江苏省徐州市高中化学 专题2 化学反应与能量转化 第三单元 化学能与电能的转化(第1课时)化学能转化为电能

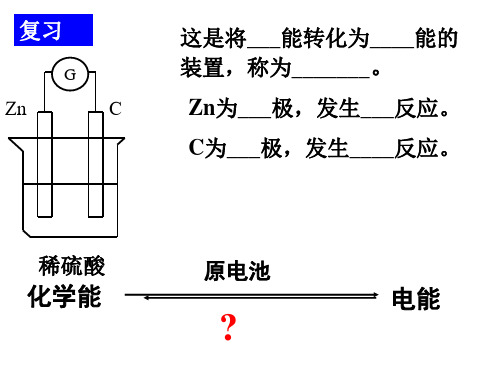
2-3-1 化学能转化为电能锁定目标 找准方向备 注 1、初步认识原电池的原理和一般构成条件;2、抓住氧化还原反应是原电池工作原理的本质。
通过实验不断体现出由实践—认识—再实践—再认识的认知过程。
自我构建 快乐无限预习时要好好阅读课本,体会化学能转化为电能的意义及书写电池总反应的方法对照课本41页图2-7完成表格 [求知探究]一、化学能转化为电能 (一)原电池原理探究实验1、将一块锌片和一块铜片分别插入装有稀硫酸溶液的烧杯中,观察实验现象。
实验2、将一块锌片和一块铜片同时插入装有稀硫酸溶液的烧杯中,观察实验现象。
实验3、用导线把锌片和铜片连接,再同时插入装有稀硫酸溶液的烧杯中,观察实验现象。
实验4、在锌片和铜片之间连接一个电流计后,再同时插入装有稀硫酸溶液的烧杯中,观察实验现象。
实验现象结论实验1锌片上 。
铜片上 。
化学方程式: , 说明金属活动性性: Zn Cu 。
实验2锌片上 。
铜片上 。
实验3 铜片上 。
实验4 电流计指针 。
产生了 。
1、原电池的定义:我们把__________________________的装置为原电池(二)原电池工作原理:以Zn 、Cu 原电池为例项目 Zn Cu 电极反应 电子得失 反应类型 电极性质总反应 能量转化合作探究 携手共进(三)原电池知识总结 原电池的概念和原理(1) 特点:把 能转化为 能的装置 (2) 电极名称及电极反应正极:电子 的极, 电极 (活泼或不活波),发生 反应 负极:电子 的极, 电极 (活泼或不活波),发生 反应 电子流向:电子在外电路沿导线从 极流向 极电解质溶液中离子流向:溶液中 离子移向正极, 离子移向负极。
(填 正/负) (3)原电池的构成条件1、必须有_______________溶液;2、两个电极,其中一个相对较___________的金属为负极,另一个相对较__________的金属或非金属导体为正极。
两个电极直接或间接地连接在一起,并插入电解质溶液中去。
苏教化学必修2专题2第三单元 化学能与电能的转化(共19张PPT)

病例分析
病例分析
病例分析
你能为她开一个药方吗?
H+ Zn2+ H+
SO42-
H2SO4 负极:电子流出
℮-
负极 【氧化反应】
正极【还原反应】
电解质溶液
阴离子
阳离子
实验探究-----原电池构成的条件之一
实验装置
能否产生 电流
不能
能
能
构成原电
池条件一 活泼性不同的两个电极
实验探究-----原电池构成的条件之二
实验序号
实验 4,5
实验装置
能否产生电 流
一、原电池
1、定义:把化学能转化为电能的装置
问题探究
该原电池的工作原理是怎样的?
2、工作原理: 氧化还原反应
I
氧化剂(H+)在铜极上 得到电子,发生还 原反应
G
e-
e-
2H+ + 2e- = H2
Cu
正极
还原剂(Zn)失去电 子,发生氧化反应
Zn - 2e- = Zn2+
Zn
负极
正极:电子流入
H2
2-3-1化学能转化为电能
活动与探究 实验1 实验2 实验3
实验现象
解释或结论
锌片表面有气泡产 生,锌片逐渐溶解 铜片表面没有气泡 产生,不溶解 锌片表面有气泡产 生,锌片逐渐溶解 铜片表面没有气泡 产生,不溶解
锌与稀硫酸反应 铜与稀硫酸不反 应
锌与稀硫酸反应 铜与稀硫酸不反 应
大量气泡从铜片逸 出,但不溶解。锌 片部分溶解。
(工作原理) 正极(Cu):电子流入的极(一般是较不活泼金
属或导电非金属)。
2H+ + 2e-=H2↑ 发生还原反应
苏教化学必修2专题2第三单元 化学能与电能的转化(共25张PPT)
观察与比较
阴极
阳极
原电池
电解池
一、电解原理
1、电解概念:
电解池
概念——电能转化为化学能的装置。
(1)与直流电源相连 构成(2)两个电极(正阳,负阴)
(3)有电解质溶液或熔融电解质 (4)形成闭合回路
交流与讨论
2、电解池的工作原理
石
铁
墨
电
电
极
极
ClNa+
思考1、接通电源前、后熔融 氯化钠中的Na+和Cl-各向 哪个方向移动?
4、写出下列装置的电极反应,并标明氧化 反应、还原反应
Fe
Cu
Fe
Cu
A Cu
氯化铜 溶液
C
B C
稀硫酸 Cu
硝酸银溶液 C
D 氯化铜溶液
思考与交流2 原电池与电解池的比较 e
失去电子 氧化反应
负极
正极
得到电
子还原
反应
阳离子得 电子发生 还原反应
电解质溶液
阴极
-+
e
阳极
电极材料或阴离 子失电子发生氧
电解池
概念——电能转变为化学能的装置。
(1)与直流电源相连 构成 (2)两个电极(正阳,负阴)
(3)电解质溶液或熔融电解质 (4)形成闭合回路
(1)电解氯化铜溶液
阳极
阴极
电解 反应
现象
电极反应式
有气泡产生,使湿润 的淀粉-KI溶液变蓝
2Cl--2e- =Cl2↑
颜色加深,碳棒上有 红色物质生成
Cu2++2e- =Cu
铅=蓄2P电bS池O的4+2充H2电O 过程—— 电解池
阴极: PbSO4 +2e- = Pb+SO42阳极: PbSO4+ 2H2O = PbO2+SO42-+4H++2e电池总反应:2PbSO4+2H2O= Pb+ PbO2+2SO42- +4H+
高中化学专题6化学反应与能量变化第三单元化学能与电能的转化第1课时化学能转化为电能苏教版必修第二册

图2
① ② ③ 棒的质量 ④ 棒的质量 ⑤溶液的质量
[解析] 不参加反应,因此 不变,②不符合图像变化;负极反应式为 ,正极反应式为 ,则 棒的质量逐渐减少, 棒的质量逐渐增加, 逐渐减小,①③符合图像变化,④不符合图像变化;由电极反应式可知,每溶解 铁转移 电子,有 银从溶液中析出,故随着反应的进行,溶液的质量减小,⑤符合图像变化。故C正确。
正
还原
(4) 电极反应式为_ _________________。(5)总的电极反应式为_ _______________________。(6)外电路中的电子是从_ _______(填电极材料,下同)电极流向________电极。(7)溶液中阴离子向_ _______电极移动。(8)若反应过程中有 电子发生转移,则生成的氢气在标准状况下体积为_ ________。
(5)该原电池的总反应为锌与稀硫酸生成硫酸锌和氢气,反应的离子方程式为 。(6)外电路中电子由负极经导线流向正极,即由锌 电极经导线流向 铜电极。(7)原电池中,溶液中阴离子向负极移动,即向锌 电极移动。(8)正极反应: ,由电极反应可知转移 电子生成 氢气,则 电子发生转移时生成 氢气,标准状况下体积为 。
对点演练6 [2023江苏徐州树恩高级中学月考]某学生学完原电池的知识后,设计如图所示柠檬水果电池,观察到外电路的电流从电极 流向电极 。如果他选择了铁为 极,则 极应该是( )
A
A.锌 B.石墨 C.银 D.铜
[解析] 外电路的电流从电极 流向电极 ,则 是正极, 是负极。锌的活动性强于铁,锌、铁构成原电池,锌是负极,A符合题意;石墨、铁构成原电池,铁为负极,石墨为正极,B不符合题意;铁的活动性强于银,铁、银构成原电池,铁是负极,银是正极,C不符合题意;铁的活动性强于铜,铁、铜构成原电池,铁是负极,铜是正极,D不符合题意。
[推荐学习]【小初高学习】高中化学专题2化学反应与能量转化第三单元化学能与电能的转化第1课时化学能转
![[推荐学习]【小初高学习】高中化学专题2化学反应与能量转化第三单元化学能与电能的转化第1课时化学能转](https://img.taocdn.com/s3/m/11009defd5bbfd0a795673f7.png)
第1课时 化学能转化为电能一、原电池工作原理 1.实验探究2.原电池的概念原电池是将化学能转化为电能的装置; 原电池的反应本质是氧化还原反应。
3.原电池的构成条件理论上,自发的氧化还原反应均可构成原电池。
具体条件是:(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)。
(2)溶液:两电极均插入电解质溶液中。
(3)导线:两电极用导线相连,形成闭合回路。
4.原电池的工作原理 (1)分析下图并填空原电池总反应式:Zn+2H+===Zn2++H2↑。
(2)能量转化:化学能转变为电能。
例1如图所示装置能够组成原电池的是_______________________________________。
其他不能构成原电池的说明理由:_____________________________________________。
考点原电池工作原理题点原电池的形成条件与判断方法答案EFG A装置的两个电极的活泼性相同,电子不会流动形成电流;B装置为非电解质溶液,不能发生氧化还原反应;C装置电解质溶液在两个分开的装置中,不成形成闭合回路;D装置无导线连接电极,不能形成闭合回路。
它们均不能构成原电池思维启迪原电池的判定方法:一看反应原理(能否自发地进行氧化还原反应);二看构成条件(两极一液成回路:两个活泼性不同的电极,插入电解质溶液中,装置形成闭合回路)。
例2如图,电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )A.B极为原电池的正极B.A、B、C分别可以为Zn、Cu和稀盐酸C.C中阳离子向A极移动D.A极发生氧化反应答案 C解析原电池中,负极金属失去电子,发生氧化反应溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。
二、原电池原理的应用1.钢铁的电化学腐蚀(1)电化学腐蚀金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
第三单元---化学能与电能的转化

第三单元---化学能与电能的转化————————————————————————————————作者:————————————————————————————————日期:第三单元化学能与电能的转化本课提要通过制作简易原电池的实验,了解原电池的概念和原理;掌握化学能与电能的转化关系及其应用。
本课重难点原电池的原理课前准备【温故】氧化还原反应是有_转移的化学反应。
在氧化还原反应中,失去电子的物质是_,还原剂发生__反应,表现出__;得到电子的物质是,氧化剂发生反应,表现出。
【知新】化学电源是利用化学反应,使转化为,电解(如电解水和电解氧化铝等)、电镀(在物质表面镀上一层金属)是将____转化为____。
课堂在线【实验探索1】观察实验现象并记录。
实验现象结论Cu、Zn片同时插入稀硫酸中______________能与硫酸反应,不能与硫酸反应用导线将Cu、Zn片连接______________——在导线中间连接一个灵敏电流计______________电流产生【问题探究】思考下列问题,完成下列填空。
(1)锌片和铜片用导线连接前后..插入稀硫酸中,出现的现象不同,为什么?____________________________(2)锌片的质量有无变化?溶液中c(H+)如何变化?____________________________(3)锌片和铜片上变化的反应式怎样书写?____________________________(4)电子流动的方向如何?电流的方向如何?____________________________1.原电池的定义──将转变为的装置叫做原电池。
2.原电池的电极及反应式:锌片的质量,溶液中的c(H+) ,电子流动方向,电流方向,溶液中SO42—移动方向。
锌片(负极)反应式:_________________( 反应);铜片(正极)反应式:(反应);总反应式:。
【实验探索2】实验现象结论Al—Al插入稀硫酸中,在导_________________电流产生线中间连接一个灵敏电流计Al—C插入稀硫酸中,在导线_________________电流产生中间连接一个灵敏电流计Cu—Al插入酒精中,在导线_________________电流产生中间连接一个灵敏电流计3.原电池的工作原理:(1)__________________________;(2)__________________________;(3)__________________________。
高中化学 专题二 第三单元 第1课时《化学能转化为电能 化学电源》课件(苏教版必修2)
(3)铜锌原电池。
图 2-3-1 Zn ,电极反应式: Zn -2e-===Zn2+ 氧化 反应)。 负极:___ ________________(_____
++2e-===H ↑ Cu 2H 还原 正极:___,电极反应式:_________________(____ 反应)。 2
Zn+2H+===Zn2++H2↑ 。 总反应式:________________________ Zn→Cu 用电极表示)。 电子流向:___________(
池的电解质溶液中,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断:原电池的负极总是 失电子发生氧化反应,而正极总是得电子发生还原反应。 (5)根据现象判断:溶解的一极为负极,增重或有气泡放出 的一极为正极。
电极反应式、原电池反应式的书写 1.书写方法 (1)首先判断原电池的正、负极,负极发生氧化反应,正极
电池,使产生 H2 的速率加快。 2.比较金属的活动性强弱
原电池中,一般活动性较强的金属为负极,活动性较弱的 金属为正极。例如有两种金属 A 和 B,用导线连接后插入到稀 硫酸中,观察到 A 极溶解,B 极上有气泡产生,由原电池原理 可知,金属活动性:A>B。
3.设计原电池
从理论上说,任何一个氧化还原反应都可以设计成原电池。 例如反应 Cu+2FeCl3===2FeCl2+CuCl2 可设计成如图 2-3-3
4.(2011 年广东广州检测)将纯锌片和纯铜片按图 2-3-5
所示的方式插入同浓度的稀硫酸中一段时间,以下叙述正确的 是( C ) 。
图 2-3-5 A.甲中铜片是负极 B.两烧杯中铜片表面均无气泡产生 C.产生气泡的速度甲比乙快 D.两烧杯中溶液的 pH 均减小
苏教版高中化学必修2-专题二 第三单元 化学能和电能 的转化 课件 (共18张PPT)
(2)
(3)
形成条件二:活泼性不同的两个电极
负极:较活泼的金属 正极:较不活泼的金属、
或可以导电的非金属,如石墨等
实验探究形成原电池的条件
(4)
(5)
形成条件三:电极需接触电解质溶液
实验探究形成原电池的条件
形成条件四:必须形成闭合回路
小结
原电池 构成
负极: 较活泼金属(Zn)
正极: 较 不 活 泼 金 属 (Cu)
化学能转化为电能
请你当医生
格林太太是位漂亮、开朗、乐观的妇女。当她 开怀大笑的时候可以发现一口整洁的牙齿中镶有 两个假牙。其中一颗是黄金制的——这是富有的 标志,另一颗是不锈钢制的,这是一次车祸留下 的痕迹。令人百思不解的是,自从车祸以后,她 经常头痛,夜间失眠、心情烦躁。医生绞尽脑汁, 格林太太的病仍无好转。
或C
电解质溶液: H2SO4溶液
试一试 1.判断下列装置能否构成原电池,若能,标出 电负极、写出电极反应式及电池反应式
Fe Ag √
C CuSO4 (aq)
√
提升练习
利用反应 Cu + 2FeCl3 = 2FeCl2 + CuCl2 设计一个原电池装置。 ①画出装置图;②标明电极材料和电解质溶液;③ 写出电极反应式。
一位年轻的化学家为格林太太揭开了病因。
实实验验21
现象: 锌片溶解,且表面
无明显现象产生。
1.Zn片 有气泡产生。 ,Cu片片:
Zn
Cu
溶解但无气泡(纯锌)
Cu片:
稀硫酸
不溶解但有气泡
【问题】
e- →
Zn
Cu
1.Zn片上发生什么反应?
2.Cu片上发生什么反应?
高中化学专题6第三单元化学能与电能的转化第1课时化学能转化为电能学案苏教版必修第二册
第三单元化学能与电能的转化第1课时化学能转化为电能新课程标准1.理解化学能与其他形式能量的转化。
2.理解原电池的概念及工作原理。
3.认识化学能转化为电能的实际应用。
学业质量水平合格性要求1.能举出化学能转化为电能的实例,能辨识简单原电池要素,并能分析原电池的工作原理。
(水平1)2.以原电池为例认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。
(水平2)等级性要求1.能设计实验认识构成原电池的条件及其原理,提高实验探究能力。
(水平3)2.能举例说明化学能转化为电能的实例并了解其应用。
(水平4)图说考点基础知识——自学·思记·尝试[新知预习]一、原电池工作原理1.实验探究[实验1、2现象] 实验1、2中现象相同,均为锌片周围________________,铜片周围________________。
[实验结论] 锌与稀硫酸________________,铜与稀硫酸________。
原因:锌在金属活动性顺序中位于氢前面,能置换酸中氢;铜片在金属活动性顺序中位于氢后面,________置换酸中氢。
[实验3、4现象] 锌片周围________________,铜片周围________________;实验4中电流计指针________。
[实验结论] 锌、铜用导线连接后插入稀硫酸溶液中,导线中有________产生。
2.原电池(1)概念:将____能转变为____能的装置。
(2)以锌—铜—稀硫酸原电池为例)Zn电极Cu电极(3)构成条件:3.钢铁的电化学腐蚀:(1)实验探究:钢铁表面吸附一层水膜,形成的电解质溶液里(2)电化学腐蚀:不纯的金属与电解质溶液接触,发生________反应,比较活泼的金属________被氧化,这种腐蚀叫作________。
【学而思】(1)(想一想)是否所有的化学反应理论上都可以设计成原电池?(2)(情景思考)在Zn-H2SO4-Cu原电池中,H+得到的电子是Cu失去的吗?在这个过程中Cu起什么作用?你怎样知道导线中有电子通过?(3)(思维升华)若将铜锌原电池中的Cu电极换成石墨,可以吗?为什么?(4)钢铁在干燥的空气中长时间不易生锈,但在潮湿的空气里很快就会生锈,纯的铁片在潮湿的空气里也不容易生锈,这是什么原因呢?二、原电池原理的应用1.加快氧化还原反应的速率(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时的相互干扰减小,使反应速率增大。
高中化学2-专题2-第三单元-化学能与电能的转化
电解池外电路电子的流动方向
e-
e-
e-
e-
e-
e-
电离与电解的比较
条件
电离
电解质溶于水或受 热融化状态
电解
电解质电离后,再 通直流电
阴阳离子定向移动, 过 电解质电离成为自由 在两极上失得电子成
移动的离子。如: 程 CuCl2=Cu2++2Cl-
为原子或分子。如: CuCl2=通=电Cu+Cl2↑
专题2 化学反应与能量转化 第三单元 化学能与电能的转化
三、电能转化为化学能
三、电能转化为化学能
思考
CuCl2=Cu2++2Cl- H2O H++OH-
1. 通电前,氯化铜溶液中有哪些离子?运动 情况如何?
2. 通电时,离子的运动情况有什么改变? 3. 当离子定向移动到电极表面时,发生的是 什么类型的反应?
特点
只产生自由移动的离子
发生氧化还原反应生 成了新物质
联系 电解必须建立在电离的基础上
原电池和电解池知识总结比较表
内容
原电池
电解池电极判断较活金属做负极阴极:连接电源负极的 一极
电极反应
负极发生氧化反应
阳极氧化反应 阴极还原反应
电子移动方向 从负极流向正极
能量转变
化学能变为电能
从阳极流向阴极 电能变为化学能
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学能与电能的转化
[随堂基础巩固]
1.下图装置能够组成原电池的是( )
2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可
能为( )
A.铝 B.铜
C.锡 D.硅
3.某原电池反应的离子方程式为:Fe+2H+===Fe2++H2↑,则下列说法正确的是( )
A.HNO3为电解质溶液 B.锌为原电池正极
C.铁极质量不变 D.铜为原电池正极
4.常用的纽扣电池为银锌电池,它分别以锌和氧化银为电极。放电时锌极上的电极反应
是Zn+2OH--2e-===Zn(OH)2,氧化银极上的反应是Ag2O+H2O+2e-===2Ag+2OH-,下
列判断中,正确的是( )
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是负极,发生还原反应,氧化银是正极,发生氧化反应
D.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
5.如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。
(1)B为原电池的________极,金属活泼性:A________B(填“>”或“<”);若电极有:Zn、
Fe、Cu、Ag四种金属棒,且已知B为Cu,则A为________。
(2)若电解质溶液有稀H2SO4和AgNO3溶液,则C应为________。
参考答案:
2
1、解析:根据原电池的形成条件进行分析解答。(1)由较活泼的电极与较不活泼的电极
构成原电池的两极,可排除A选项;(2)要有电解质溶液,可排除D选项;(3)一般能自发地
发生氧化还原反应,可排除C选项。答案:B
2、解析:据题意可知该金属的活泼性比锌弱,但在金属活动性顺序表中排在H的前面,
故选C。答案:C
3、解析:由原电池反应可知,负极应为铁,正极为比铁活动性差的电极,电解质溶液
应为非氧化性酸。A项中,HNO3为电解质溶液,被还原的不是H+而是NO-3,还原产物是
NO而不是H2,A错;B项中,锌比铁活泼,正极不能是锌,B错;C项中,铁为负极,电
极反应为:Fe-2e-===Fe2+,铁极质量减小,C错;D项中,铜不如铁活泼,可以作正极,D
正确。答案:D
4、解析:放电时是原电池。负极是较活泼金属,还原性物质,发生氧化反应;正极是
较不活泼金属或导体,氧化性物质,发生还原反应。
答案:A
5、解析:据题意可知,B为原电池负极,A为正极,所以金属活泼性:
A
答案:(1)负 < Ag (2)AgNO3溶液
