一轮复习_原电池原理完整.
2025年高考化学一轮复习基础知识讲义—化学电源及工作原理(新高考通用)

2025年高考化学一轮复习基础知识讲义—化学电源及工作原理(新高考通用)【必备知识】1.分类一次电池:一次电池就是放电之后不可再充电的电池。
常见的一次电池有锌锰干电池、锌银电池。
二次电池:二次电池又称可充电电池或蓄电池。
充电电池中能量的转化关系是:化学能电能,常见的二次电池有铅蓄电池、镉镍电池、锂离子电池等蓄电池等。
2.工作原理电池电极反应装置图碱性锌锰电池总反应:Zn +2MnO 2+2H 2O===2MnO(OH)+Zn(OH)2;负极:Zn +2OH --2e -===Zn(OH)2;正极:2MnO 2+2H 2O +2e -===2MnO(OH)+2OH -银锌电池总反应:Zn +Ag 2O +H 2O===Zn(OH)2+2Ag负极反应:Zn +2OH --2e -===Zn(OH)2正极反应:Ag 2O +H 2O +2e -===2Ag +2OH -锂电池Li -SOCl 2电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电解液是LiAlCl 4-SOCl 2总反应:4Li +2SOCl 2===4LiCl +SO 2↑+S负极反应:4Li -4e -===4Li +正极反应:2SOCl 2+4e -===SO 2↑+S +4Cl -铅酸蓄电池总反应:Pb +PbO 2+2H 2SO 42PbSO 4+2H 2O ;负极:Pb +SO 2-4-2e -===PbSO 4;正极:PbO 2+4H ++SO 2-4+2e -===PbSO 4+2H 2O【微点拨】①可逆电池的充、放电不是可逆反应。
②负接负后作阴极,正接正后作阳极。
【易错辨析】1.太阳能电池不属于原电池()2.可充电电池中的放电反应和充电反应互为可逆反应()3.铅酸蓄电池工作时,当电路中转移0.1mol电子时,负极增重4.8g()(SO42-:96)【答案】 1.√ 2.× 3.√【题型突破】1、(2019·浙江4月选考,12)化学电源在日常生活和高科技领域中都有广泛应用。
高三一轮复习原电池的工作原理课件

详细描述
这道题目要求学生能够区分不同类型的原电池,如干电池、 纽扣电池、燃料电池等,并理解其在日常生活和工业生产 中的应用。
总结词
掌握原电池的工作原理是解决这类题目的核心。
详细描述
这道题目要求学生能够根据原电池的工作原理,分析电池 的输出电压、电流和电阻等参数,并理解这些参数对电池 性能的影响。
习题三:原电池的工作原理实验
通过实验操作,提高学生的实验 技能和观察能力。
实验材料
实验步骤
步骤1
准备实验材料,搭建原电池装置。将铜片和锌片插入稀硫酸中,用导 线连接铜片和锌片,并将电流表接入电路。
步骤2
观察并记录实验现象。观察电流表的读数变化,记录实验过程中的电 子转移和电流形成情况。
步骤3
分析实验结果。根据实验现象,分析原电池的工作原理,理解电子转 移和电流形成的过程,掌握原电池的组成和各部分的作用。
电极反应是指在电极上发生的氧化还 原反应,分为负极反应和正极反应。
电极反应是原电池工作原理的重要组 成部分,决定了电池的输出电压和电 流。
负极反应是电子转移的来源,通常是 金属失去电子被氧化;正极反应则是 电子的接受者,通常是一种氧化剂获 得电子被还原。
CHAPTER
原电池的应用
化学电源
干电池
充电电池
步骤4
总结实验结论。总结原电池的工作原理,理解原电池的能量转化方式, 并能够将实验结论应用到实际生活中。
CHAPTER
原电池的工作原理习题及解 析
习题一:原电池的基本概念
01
总结词
02
详细描述
03
总结词
04
详细描述
习题二:原电池的种类及应用
总结词
高三化学一轮复习原电池化学电源课件

定义
原电池是一种将化学能转化为电 能的装置,由两个电极、电解质 溶液和隔膜组成。
组成要素
正极、负极、电解质溶液、隔膜 和外壳等。
原电池工作原理及反应方程式
工作原理
原电池通过氧化还原反应将化学能转 化为电能。在原电池中,负极发生氧 化反应,正极发生还原反应,电子从 负极经外电路流向正极,形成电流。
反应方程式
化学电源根据工作原理分为一次电池 、二次电池和燃料电池。
化学电源主要由正极、负极、电解质 和隔膜组成。
一次电池通过一次性反应产生电能; 二次电池通过可逆反应反复充放电; 燃料电池通过燃料与氧化剂的反应产 生电能。
化学电源性能评价标准及方法
化学电源性能评价主要包括能 量密度、功率密度、使用寿命 、安全性和环保性等方面。
严格按照实验步骤进行操作,注意连 接电源和用电器的正确性,确保实验 结果的准确性。
注意电源极性
在使用化学电源时,要注意电源的极 性,确保正负极与用电器的要求相匹 配。
实验安全注意事项及应急处理措施
注意安全使用化学药品
在实验过程中,要注意安全使用化学药品,避免直接接触或吸入 有害物质。
遵守实验室规则
相对电动势E(相对)
非标准状态下测得的电动势
影响电动势的因素
温度、压力、电解质浓度、电极材料等
常见原电池电动势计算实例解析
01
02
03
氢氧燃料电池:E=0.4V
甲烷燃料电池:E=0.7V
锌锰干电池:E=1.5V
04
铅蓄电池:E=2.0V
04
化学电源工作原理及性能评价
化学电源工作原理简述
化学电源是通过化学反应将化学能转 化为电能的装置。
以锌-铜-稀硫酸原电池为例,负极: Zn - 2e^- = Zn^2+,正极:2H^+ + 2e^- = H2↑
高三一轮复习原电池的工作原理PPT课件
•
X电极上发生的电极反应为________。
三、金属的腐蚀与防护
钢铁生锈
Cu2(OH)2CO
3
铜器表面生成铜绿
一、金属的腐蚀:
1. 含义:
金属或合金与周围接触到的气体或液体发生 反应而氧损化耗还的原现象。
2. 本质:
金属单质失电子被氧化成阳离子
M – ne→Mn+
3、金属腐蚀的类型: (1)化学腐蚀
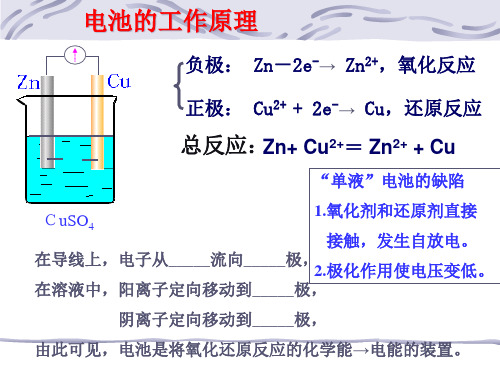
阴离子定向移动到_____极,
由此可见,电池是将氧化还原反应的化学能→电能的装置。
双液电池
盐桥制法: 1)将热的琼胶溶液倒入U形管中,
将冷却后的U形管浸泡在KCl 饱和溶液中即可。 2)将KCl饱和溶液装入U形管, 用棉花堵住管口即可。
盐桥的作用:
1)避免氧化剂和还还剂直接接触 2)连通原电池的内电路 3)平衡溶液中的离子电荷
• 依据氧化还原反应: • 2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) • 设计的原电池如图所示:
A
盐桥 电流计
X
Ag
• 请回答下列问题: CuSO4溶液
Y
• (1)电极X的材料是________;电解质溶液Y是_______。
• (2)银电极为电池的________;
[交流研讨]
你知道自行车的金属部件采用了什么样的防护措施吗?
烤蓝
烤漆
镀铬
涂机油 涂凡士林
镀锌
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
高三化学一轮复习原电池基础知识课件

Zn2+
Cu2+ H+ SO42- OH-
活泼性较弱
正极
非金属(C)
氧化剂(Cu2+)在 2、电子流入一极,得到电子一极
铜极上得到电子, 发生还原反应
电子 电流
流入 流出
,发生 。
还原 反应,
Cu2++2e- = Cu
3、阳离子移向的一极
4、一般工作后质量增加的电极, 或者工作后,有气泡冒出的电极
5、一般方程式中化合价降低电极
Zn+Cu2+= Zn2++Cu
正极
铜锌原电池工作原理
Zn+2H+ = Zn2+ +H2↑
负极
Cu
Zn
实验原理
构成条
氧
件闭两电氧
化
合个解化
还 原
回电质还 路极溶原
液反
反
应
应
二、带盐桥的原电池
盐桥:在U型管中装满用饱和KCl溶液和琼脂作 成的冻胶
由于将锌片和铜片置于稀硫酸的原电池,不但 效率低,而且时间稍长电流就很快减弱,因此 不适合实际应用。
小结:书写电极反应式应注意以下几点: 1、电极反应是一种离子反应,遵循书写离子反应所有规则(如“拆”、“平”) 2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应 即得到另一极反应; 3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关 (如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在); 4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中 它与水结合成OH-;
Zn-2e-=Zn2+
2025年高考化学一轮总复习课件 第6章 第21讲 原电池和化学电源

③盐桥中的NO移向___C__u_(_N_O__3)_2__溶液。
第六章 化学反应与能量
高考一轮总复习 • 化学
返回导航
微考点1 原电池的构成及工作原理 1.(2024·河北衡水高三检测)如图所示为锌铜原电池。下列叙述正
第六章 化学反应与能量
高考一轮总复习 • 化学
返回导航
[解析] 该双液电池Fe为负极,失去电子,石墨为正极,得到电 子;盐桥中的阳离子K+朝正极移动,移向FeCl3溶液。Fe为负极,石墨 为正极,电池负极反应:Fe-2e-===Fe2+,故A错误;原电池中阳离子 移向正极,石墨电极为正极,故盐桥中K+移向FeCl3溶液,故B错误;当 有6.02×1023个电子转移时,根据电池负极反应:Fe-2e-===Fe2+,Fe 电极减少28 g,故C错误;据分析,根据电荷守恒可得,电池总反应为 Fe+2Fe3+===3Fe2+,故D正确。
第六章 化学反应与能量
高考一轮总复习 • 化学
返回导航
4.原电池中的三个移动方向
电子方向 电流方向
离子迁移方向
从__负____极流出沿导线流入___正___极 从__正____极沿导线流向___负___极 电解质溶液中,阴离子向__负____极迁移,阳离子 向___正___极迁移
第六章 化学反应与能量
第六章 化学反应与能量
高考一轮总复习 • 化学
返回导航
(11)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子 向正极移动。( × )
[提示] 阳离子向正极移动,阴离子移向负极。 (12)某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐 桥内可以是含琼脂的KCl饱和溶液。( × ) [提示] 琼脂中的Cl-会进入AgNO3溶液和Ag+反应。
高考一轮复习:原电池
落实基础 ( 放电过程 ) 1.定义 原电池是将 化学能 转变为电能 的装置。 2.工作原理 如图以铜锌原电池为例:
CuSO4溶液
“双液”原电池
“单液”原电池
e
(逐渐溶解)
Zn-2e-==Zn2+
(Cu片变粗)
Cu2++2e-==Cu
氧化反应
负极
正极 还原反应
CuSO4溶液
1.会判断正负极(活泼金属作负极); 2.会书写电极反应式,判断反应类型、现象; 3.会判断电子、电流、离子流向;
Zn(负极) Cu(正极) Cu(正极) Zn(负极) 正极 4.会简单计算; Cu2+、H+(阳离子) SO42-(阴离子) 负极
笔记
(逐渐溶解)
Zn-2e-==Zn2+ e
KCl
(Cu片变粗)
考查角度三 常见的化学电源 例3(1)碱性锌锰原电池 负极:材料是 ,电极反应 为 。 正极:材料是 ,电极反应 为 。 总反应:
Zn+2MnO2+2H2O 2MnOOH+Zn(OH)2
。
(2)铅蓄电池 负极:材料是 应为 。 正极:材料是 应为 。 总反应: 。
,电极反 ,电极反
Pb+PbO2+2H2SO4 2PbSO4+2H2O
-
2+
2.(2016辽宁葫芦岛调研) 氢氧燃料电池, 如图所示,a、b均为惰性电极。下列叙述 不正确的是( B )
A.a 电极是负极,该电极上发生氧化反应 B.b 极反应是 O2+4OH -4e 2H2O C.总反应方程式为 2H2+O2 2H2O D.使用过程中电解质溶液的 pH 逐渐减小
2017高三化学一轮复习原电池 化学电源
2017高三化学一轮复习原电池化学电源在高三化学的学习中,原电池和化学电源是非常重要的知识点。
一轮复习时,我们要对这部分内容进行全面、深入的梳理和巩固,为后续的学习打下坚实的基础。
一、原电池的基本原理原电池是将化学能转化为电能的装置。
其工作原理基于氧化还原反应,在两个不同的电极上分别发生氧化反应和还原反应,从而形成电子的定向移动,产生电流。
以铜锌原电池为例,锌片作为负极,发生氧化反应:Zn 2e⁻=Zn²⁺;铜片作为正极,发生还原反应:Cu²⁺+ 2e⁻= Cu。
电子由负极(锌片)通过外电路流向正极(铜片),溶液中的离子则在电池内部进行定向移动,形成闭合回路。
理解原电池的工作原理,关键在于把握以下几点:1、电极的判断:通常较活泼的金属作为负极,较不活泼的金属或能导电的非金属作为正极。
但也有特殊情况,比如镁、铝在氢氧化钠溶液中构成原电池时,铝是负极。
2、电子和离子的移动方向:电子从负极流出,经外电路流向正极;溶液中的阳离子向正极移动,阴离子向负极移动。
3、电极反应式的书写:要根据所给的电解质溶液和电极材料,准确判断氧化还原反应,并正确书写电极反应式。
二、原电池的构成条件要形成一个原电池,需要满足以下几个条件:1、有两种不同的活动性不同的电极材料,其中一种能够与电解质溶液发生自发的氧化还原反应。
2、电极要插入电解质溶液中。
3、要形成闭合回路,包括外电路和内电路。
4、能自发进行的氧化还原反应。
这四个条件缺一不可。
只有同时满足这些条件,原电池才能正常工作,实现化学能向电能的转化。
三、常见的原电池类型1、锌锰干电池锌锰干电池是最常见的一次电池。
分为酸性和碱性两种。
酸性锌锰干电池中,负极是锌筒,正极是石墨棒,电解质溶液是氯化铵和氯化锌的混合溶液。
碱性锌锰干电池中,负极是锌粉,正极是二氧化锰,电解质是氢氧化钾溶液。
2、铅蓄电池铅蓄电池是一种二次电池,可以反复充电和放电。
放电时,负极是铅,电极反应为:Pb + SO₄²⁻ 2e⁻= PbSO₄;正极是二氧化铅,电极反应为:PbO₂+ 4H⁺+ SO₄²⁻+ 2e⁻=PbSO₄+ 2H₂O。
高三化学一轮复习原电池-化学电源省公开课获奖课件说课比赛一等奖课件
化学
真题再现
探究考题 感悟考向
考向1:原电池原理及应用 1.(2023新课标全国理综Ⅰ)微生物电池是指在微生物旳作用下将化 学能转化为电能旳装置,其工作原理如图所示。下列有关微生物电 池旳说法错误旳是( A ) A.正极反应中有 CO2 生成
B.微生物促进了反 应中电子的转移 C.质子通过交换膜 从负极区移向正极区
则下列说法一定错误的是( C )
A.Cd作负极,Co作正极 B.原电池工作时,电子从负极沿导线流向正极 C.根据阴阳相吸原理,盐桥中旳阳离子向负极(甲池)移动 D.甲池中盛放旳是CdCl2溶液,乙池中盛放旳是CoCl2溶液
化学
梳理整合
考点三:化学电源
1.一次电池(以碱性锌锰干电池为例)
负极(Zn),电极反应式:
化学
2.Li SOCl2 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解
液是 LiAlCl4 SOCl2。电池的总反应可表示为 4Li+2SOCl2 4LiCl+S+SO2。
请回答下列问题:
(1)电池旳负极材料为
,发生旳电极反应为
。
(2)电池正极发生旳电极反应为
。
答案:(1)Li 4Li-4e- 4Li+ (2)2SOCl2+4e- 4Cl-+S+SO2
(3)构成 闭合回路 (两电极接触或用导线连接)。
(4)能自发地发生氧化还原反应。
化学
题组例练
题组一 原电池工作原理旳考察 1.有关电化学知识的描述正确的是( D ) A.CaO+H2O Ca(OH)2,可以放出大量的热,故可把该反应设计成原电 池,把其中的化学能 转化为电能 B.某原电池反应为 Cu+2AgNO3 Cu(NO3)2+2Ag,装置中的盐桥中可以 是装有含琼胶的 KCl 饱和溶液 C.原电池的两极一 定是由活动性不同的两种金属组成 D.缠有铜丝的铁片放入 CuSO4 溶液中也能形成原电池
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由于盐桥(如KCl) 的存在,其中阴离子Cl向ZnSO4溶液扩散和迁移, 阳离子K+则向CuSO4溶液 扩散和迁移,分别中和 过剩的电荷,保持溶液 的电中性,因而放电作 用不间断地进行,一直 到锌片全部溶解或 CuSO4 溶液中的 Cu2+几乎完全 沉淀下来。若电解质溶 液与KCl溶液反应产生沉 淀,可用NH4NO3代替KCl 作盐桥。
与原 电 池 相关的概念
电子流向:负极流向正极 外电路 电流方向:正极流向负极 1.电路: 阴离子: 向负极移动
内电路
阳离子;
向正极移动
负极: 电子流出的一极
2.电极:
正极: 电子流入的一极
3.电极反应式:
负极: Zn-2e-= Zn2+
正极: 2H++ 2e-= H2↑
4.总反应式: Zn+ 2H+ = Zn2+ + H2↑
Cu +2e ===Cu Cu片 ,电极反应式:___________________ 正极:________ 。 Zn+ Cu2+===Zn2++Cu 电池反应:______ ________________________________ _____。
2+
-
(2)电子移动方向 负极 释放,经__________ 外电路 沿导线流入________ 正极 , 电子由________
4.电极反应式的书写和电子移动方向(如图20-1)
此电池的优点: 能产生持续、稳定的电流。 盐桥的作用: (1)使整个装置构成通路, 代替两溶液直接接触。 (2)平衡电荷。 (1)电极反应式 - 2+ Zn===Zn + 2e Zn片 ,电极反应式:___________________。 负极:________
阳离子 移向正极,在其表面得电子被 电解质溶液中的__________ 还原 ,形成一个闭合回路。 ________
在整个装置的电流回路 中,溶液中的电流通路 是靠离子迁移完成的。 Zn失去电子形成的Zn2+进 入ZnSO4溶液,ZnSO4溶液 因Zn2+增多而带正电荷。 同时,CuSO4则由于Cu2+ 变为Cu ,使得 SO42-相 对较多而带负电荷。溶 液不保持电中性,这两 种因素均会阻止电子从 锌片流向铜片,造成电 流中断。
请根据氧化还原反应 :
Cu +2 Fe =
3+
Cu2+
+ 2Fe
2+
设计成原电池。你有哪些可行方案? 负极: Cu Cu – 2e- = Cu2+
正极: 比Cu不活泼的金属或石墨 2Fe3+ + 2e- = 2Fe2+
电解质溶液:Fe2(SO4 )3、FeCl3等
若是采用烧杯和盐桥装置图,采用的电解质溶液又是 什么?试画出原电池的装置简图。
第八单元
化学反应及能量
原 电 池
第八单元 │ 电化学知识框图
知识框图
第八单元 │ 电化学知识框图
考纲导学
考纲要求 命题预测
1.原电池的工作原理。运用原电池 1.了解原电池的工 工作原理书写电极方程式或正误判断, 作原理,能写出电极反 以及金属腐蚀的类型判断与防护是近几 应和电池反应方程式。 年高考的重点,常以选择或填空的形式 了解常见化学电源的种 进行考查,难度中等。 类及其工作原理。 2.对新型化学电源的考查。近年来 2.理解金属发生电化 这一考点成为高考命题的必考点和区分 学腐蚀的原因、金属腐 点,通常是以新型(燃料电池、固体熔 蚀的危害、防止金属腐 融电解质等)电池,对其工作原理分析 蚀的措施。 及电极方程式的书写为主,难度较大。
习题:
1.下列哪几个装置能形成原电池?
Zn Cu
Fe
Cu
Zn
Zn
Zn
Cu
A
V H SO
2
B
V
H2SO4
C
Cu
X
H 2 SO 4
Zn
D
X
Cu
4
酒精
Fe
Cu
V
E
F
X
M
NaCl溶液
X
H2SO4 H2SO4
V
N
H 2S O 4
3.原电池的两极
强 的金属,发生________ 氧化 反应。 负极:活泼性______ 弱 的金属或导体,发生________ 还原 反应。 正极:活泼性______
电解质溶液和电极材料的选择
电解质溶液一般要能够与负极发生反应。但若是两个 半反应分别在两个烧杯中进行,则左右两个烧杯中的 电解质溶液应 与电极材料具有相同的阳离子。
(电池的电极必须导电)
①活泼性不同 的两种金属。如锌铜原电池,锌作负极,铜作正极 ②金属和非金属。如锌锰干电池,锌作负极,石墨棒作正极 ③金属和化合物。如铅蓄电池,铅版作负极,PbO2作正极 ④惰性电极。如氢氧燃料电池中,两根电极均可用Pt
原电池电极方程式的书写原则与技巧
①电极反应是氧化还原反应,要遵循质量 守恒、电子守恒及电荷守恒。另外还要遵守以 下两个原则: a. 共存原则: 注意介质对电极产物的影响, 物质得失电子后在不同的介质环境中所存在的 形式不同。如电解质溶液的酸碱性不同,在酸 性条件下,碳元素以 CO2 释放出去,而碱性条 2- 件下,碳元素则以 CO3 形式存在;O2 放电时, + 在酸性溶液中它与 H 结合成 H2O, 在碱性溶液 - 中与 H2O 结合成 OH 。
微观判断 电子流出的极 ——负极
(根据电子 电子流入的极 ——正极 流动方向)
宏观判断: ①根据电极材料 较活泼的电极材料 ——负极
②根据原电池电极 发生的反应
较不活泼的电极材料——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极 ③根据电极增重还是减重 工作后 质量减少的电极 ——负极 ④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极
Байду номын сангаас
►
探究点一
【知识梳理】 1.原电池
原电池
一 原电池的工作原理
化学能 转化为________ 电能 的装置。 把__________ 2.形成条件 本质条件:能自发进行的氧化还原反应 金属活动性 不同的金属或由 (1)两个电极由两种______________
__________________ 金属和其他导电 的材料(非金属或某些氧化物等)组成。 (2)电解质溶液。 (3)形成闭合回路。
• 下列关于原电池的叙述正确的是( B ) • A、构成原电池的正极和负极必须是两种 不同的金属 • B、原电池是将化学能转变为电能的装置 • C、原电池中电子流出的一极是负极,该 极被还原 • D、原电池放电时,电流的方向是从负极 到正极
原电池电极的判断和电极方程式的书写
原电池正负极的判断
原电池的正负极的判断方法
