考点训练:质量守恒定律
专题质量守恒定律与化学方程式

宏观:物质种类一定改变 两个一定改变微观:构成物质的粒子一定改变 一个可能改变:分子总数可能改变
4.应用 (1)解释反应前后物质的质量变化及用质量差确定某一物质的质量。 (2)推断反应物或生成物的化学式。 (3)确定物质的组成元素。 (4)进行各物质间量的计算。
考点二 化学方程式 1.书写原则 (1)必须遵守___客__观__事__实_____。 (2)必须遵循__质__量__守__恒__定__律__。 2.书写步骤 (1)将_反__应__物___的化学式写在左边,将___生__成__物___的化学式写在右边 ,中间用短线连接,并在短线上方注明____反__应__条__件____。 (2)在化学式的前边配上适当的数字使短线两边各___原__子____的个数 相等,体现出___质__量__守__恒__定__律____,然后将短线改为_____等__号____。
3.验证实验:当有气体参加反应或反应有气体生成时,该反应必须 在____密__闭____容器内进行才能验证质量守恒定律。
记忆技巧
理解质量守恒定律抓住:“五个不变”“两个一定改变”及“一个可能改变”,即:
反应物、生成物总质量不变
宏观元素种类不变
五个不变
原子种类不变
微观原子数目不变 原子质量不变
(3)若反应中有气体或沉淀生成,应该在该化学式右边注明 “___↑__”或“___↓____”;如果反应物也有气体或不溶性固体,则无须注 明。
记忆技巧 化学方程式的书写步骤可总结为: “一写”“二配”“三注”。
气体和沉淀,箭头来标明。
3.化学方程式的含义 (1)“质的意义”:表示反应物、生成物、反应条件 (2)“量的意义”:表示反应物与生成物各物质之间的质量比; (3)“粒子的个数比”:表示反应前与反应后粒子间的化学计量数关 系。 (4)体现出质量守恒定律。
专题09质量守恒定律

专题09质量守恒定律1.质量守恒定律2.质量守恒定律的原因3.化学方程式的意义4.化学方程式的书写知识点一质量守恒定律1.质量守恒定律的内容(1)概念:是指参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(2)研究对象:化学变化。
(3)注意事项:①质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。
②“参加反应的各物质”,没有参加反应的物质不包括在内(如催化剂、过量的物质)。
③“生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。
【典例1】★★☆☆☆1.反应A+B=C+D中,5gA和5gB恰好完全反应,生成8gC,则2.5gA完全反应,生成D的质量( )A.2g B.4g C.1g D.2.5g [答案]: C[解析]: 根据质量守恒定律可以知道,5gA和5gB恰好完全反应生成D的质量为:5g+5g-8g=2g因此,按照比例进行转化2.5gA完全反应,生成D的质量1g。
2.化学兴趣小组对某化学反应进行了探究,并将实验测的得结果填写在下表中,请你分析并填空:(1(2)C物质可能是该反应的________________ (填“反应物”、“生成物”或“催化剂”)。
(3)反应后D物质的质量是___________g。
[答案]:(1)化合反应(2)催化剂(3)32[解析]: 根据质量守恒定律可知:反应后质量减少的物质是反应物,质量增加的物质是生成物。
由于A的质量减少,A是反应物,B的质量减少,所以B也是反应物,C在反应前后质量没有改变,所以C既不是反应物也不是生成物,有可能是该反应的催化剂,也可能没有参加反应。
由此可见,D的质量一定会增加,D是生成物,两种物质生成一种物质,该反应属于化合反应,参加反应A的质量是20 g,B参加反应的质量是10 g,反应物的总质量是30 g,也就是生成了30 g D,则反应后D物质的质量是2 g+30 g=32。
【训练1】★★☆☆☆1.在化学反应中A+B=C+D中,80gA和2gB和恰好完全反应,生成40gB,则生成C的质量是_____g。
化学质量守恒定律知识点-+典型题及答案
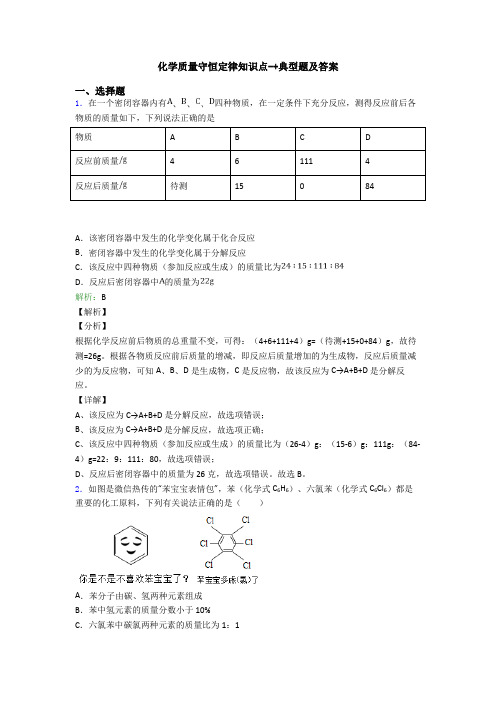
化学质量守恒定律知识点-+典型题及答案一、选择题1.在一个密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法正确的是物质A B C D反应前质量461114反应后质量待测15084A.该密闭容器中发生的化学变化属于化合反应B.密闭容器中发生的化学变化属于分解反应C.该反应中四种物质(参加反应或生成)的质量比为D.反应后密闭容器中的质量为解析:B【解析】【分析】根据化学反应前后物质的总重量不变,可得:(4+6+111+4)g=(待测+15+0+84)g,故待测=26g。
根据各物质反应前后质量的增减,即反应后质量增加的为生成物,反应后质量减少的为反应物,可知A、B、D是生成物,C是反应物,故该反应为C→A+B+D 是分解反应。
【详解】A、该反应为C→A+B+D 是分解反应,故选项错误;B、该反应为C→A+B+D 是分解反应,故选项正确;C、该反应中四种物质(参加反应或生成)的质量比为(26-4)g:(15-6)g:111g:(84-4)g=22:9:111:80,故选项错误;D、反应后密闭容器中的质量为26克,故选项错误。
故选B。
2.如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是()A.苯分子由碳、氢两种元素组成B.苯中氢元素的质量分数小于10%C.六氯苯中碳氯两种元素的质量比为1:1D.六氯苯有6个碳原子和6个氯原子构成解析:B【解析】【分析】【详解】A、苯是由苯分子构成的,苯是由碳元素与氢元素组成的,说法错误;故不符合题意;B、苯中氢元素的质量分数为16100%7.7%<10%16+126⨯⨯≈⨯⨯,说法正确;故符合题意;C、由六氯苯的化学式C6Cl6。
可知,其中碳元素和氯元素的质量比为:(12×6):(35.5×6)=12:35.5,说法错误;故不符合题意;D、一个六氯苯分子由6个碳原子和6个氯原子构成,说法错误;故不符合题意;故选B【点睛】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。
中考冲刺考点16质量守恒定律-中考化学备考之黄金考点聚焦(解析版).docx

聚焦考点☆温习理解1、内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2、解释:由于化学反应的过程,实际上就是参加反应的各物质的原子重新组合生成其他物质的过程,因此在反应的前后,原子的种类没有改变,原子的个数没有增减,原子的质量也没有改变,所以物质的总质量、元素的种类和质量在反应前后均保持不变。
[拓展] 化学反应前后各元素的种类、质量均不变。
3、化学反应前后:(1)一定不变宏观:反应物、生成物的总质量不变;元素的种类、质量不变微观:原子的种类、数目、质量不变(2)一定改变宏观:物质的种类一定改变微观:分子的种类一定改变(3)可能改变:分子总数可能改变,也可能不改变4.应用:(1)解释有关化学反应中物质的质量变化现象。
(2)确定某物质的组成或化学式。
(3)求算化学反应中某种物质或元素的质量。
(4)判断化学反应的类型。
[注意] ①在化学反应前后,物质的总体积不一定不变;②在化学反应前后,分子的种类会发生改变,分子的个数不一定相等;③质量守恒定律的应用对象是化学变化,对于物理变化,不能用质量守恒定律解释名师点睛☆典例分类类型一、推求化学式【例1】(2013福建莆田)NH2Cl消毒时,发生反应NH2Cl+H2O=X+HCl0,其中X的化学式是A.H2 B.N2 C.NH3 D.N2H4【点睛】由已知反应推求未知物质的化学式,可根据质量守恒定律的微观解释,化学反应前后原子的种类和数量不变进行推求.类型二、推求物质的组成【例2】 12.(2013四川绵阳)二甲醚是一种应用前景广阔的清洁燃料,完全燃烧二甲醚4.6g,生成C028.8g,H2O 5.4g,下列判断不正确的是A.二甲醚由C、H两种元素组成B.二甲醚中C、H元素的质量比为4:1C.二甲醚中H的质量分数为13% D.4.6g二甲醚完全燃烧消耗O29.6g【点睛】由题中叙述推求未知物质的元素组成,可根据质量守恒定律的微观解释,化学反应前后原子的种类和数量不变进行推求.可确定元素组成,有具体数据可确定分子构成类型三、化学方程式的书写【例3】2.(2014届北京市丰台区第一学期期末)下列化学方程式书写正确的是A .4 Fe +3O 2=======点燃2Fe 2O 3 B .H 2+O 2=======点燃H 2O 2C .4Al +3O 2=2Al 2O 3D .2P +5O 2=======点燃2P 2O 5课时作业☆能力提升1.(2014届北京市大兴区第一学期期末)反应H 2 + Cl 2=======点燃2HCl 中,反应前后没有..改变的是 A .分子的种类 B .原子的种类 C .元素的化合价 D .物质的种类2.(2013江苏镇江)下列化学方程式能正确表示所述内容的是A .铁丝在氧气中燃烧:4Fe+3O 2=======点燃2Fe 2O 3 B .实验室制备CO 2:CaCO 3=======高温CaO+CO 2↑ C .盐酸除铁锈:Fe 2O 3+6HCl═2FeCl 3+3H 2OD .CO 2通入CaCl 2溶液中:CO 2+CaCl 2+H 2O═CaCO 3↓+2HCl 【答案】C 【解析】试题分析:A 、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式应为:3Fe+2O 2=======点燃Fe 3O 4;B 、实验室制备CO 2采用大理石或石灰石与稀盐酸反应,生成氯化钙、水和二氧化碳,正确的化学方程式为:CaCO 3+2HCl═CaCl 2+H 2O+CO 2↑;C 、该化学方程式书写完全正确;D 、二氧化碳与CaCl 2溶液不反应,故该化学方程式书写错误,故选C 。
3.3质量守恒定律与化学方程式(2013年版)【中考化学专题复习】
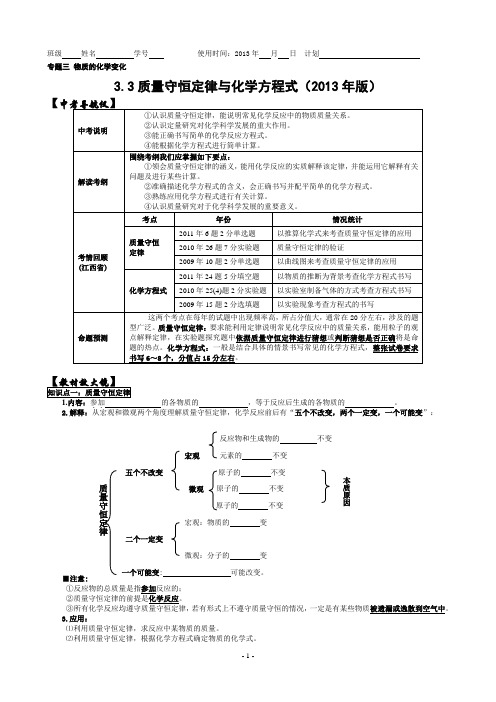
反应物和生成物的 不变 宏观 元素的 不变五个不改变 原子的 不变微观 原子的 不变原子的 不变宏观:物质的 变二个一定变微观:分子的 变一个可能变: 可能改变。
质量守恒定律本质原因班级 姓名 学号 使用时间:2013年 月 日 计划 专题三 物质的化学变化3.3质量守恒定律与化学方程式(2013年版)【中考导航仪】中考说明①认识质量守恒定律,能说明常见化学反应中的物质质量关系。
②认识定量研究对化学科学发展的重大作用。
③能正确书写简单的化学反应方程式。
④能根据化学方程式进行简单计算。
解读考纲围绕考纲我们应掌握如下要点:①领会质量守恒定律的涵义,能用化学反应的实质解释该定律,并能运用它解释有关问题及进行某些计算。
②准确描述化学方程式的含义,会正确书写并配平简单的化学方程式。
③熟练应用化学方程式进行有关计算。
④认识质量研究对于化学科学发展的重要意义。
考情回顾 (江西省)考点 年份情况统计质量守恒 定律2011年6题2分单选题 以推算化学式来考查质量守恒定律的应用 2010年26题7分实验题 质量守恒定律的验证2009年10题2分单选题 以曲线图来考查质量守恒定律的应用 化学方程式2011年24题5分填空题以物质的推断为背景考查化学方程式书写 2010年25(4)题2分实验题 以实验室制备气体的方式考查方程式书写 2009年15题2分选填题以实验现象考查方程式的书写命题预测这两个考点在每年的试题中出现频率高,所占分值大,通常在20分左右,涉及的题型广泛。
质量守恒定律:要求能利用定律说明常见化学反应中的质量关系,能用粒子的观点解释定律,在实验题探究题中依据质量守恒定律进行猜想或判断猜想是否正确将是命题的热点。
化学方程式:一般是结合具体的情景书写常见的化学方程式,整张试卷要求书写6~8个,分值占15分左右。
【教材放大镜】知识点一:质量守恒定律1.内容:参加..的各物质的 ,等于反应后生成的各物质的 。
3.3.1化学方程式质量守恒定律

2020浙教版八年级下科学同步提高必刷题训练第3章空气与生命3.31 化学方程式——质量守恒定律◆要点1 质量守恒定律的内容1.宏观解释:在化学反应中,参加化学反应的各物质的质量总和等于反应生成的各物质的质量总和.2.微观解释:在化学反应前后,原子的种类和数量都没有改变,原子的质量也不改变,因此反应前后各物质的质量总和是一样的.◆要点2 使用质量守恒定律时应该注意的事项1.一切化学反应都遵循质量守恒定律.质量守恒定律对化学变化有意义、对物理变化无意义.2.只适用于质量守恒,而不是体积或分子数目守恒.3.在反应前的各物质的质量总和中,不包括反应物剩余部分的质量.Δ基础题系列1.(2020•浙江模拟)在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有Zn2(OH)2CO3.若该物质通过化合反应生成。
反应物除了Zn外,还有N2、O2、CO2、H2O中的()A.一种B.两种C.三种D.四种【答案】C【知识点】化学反应前后,元素的种类不变,原子的种类、总个数和质量不变。
【解析】碱式碳酸锌中不含有氮元素,因此空气中的氮气没有参加反应;含有碳元素和氢元素,因此空气中的二氧化碳和水参加了反应;根据物质的化学式可知,如果锌只和水、二氧化碳反应时不能得到碱式碳酸锌,因此空气中的氧气参加了反应,即若该物质通过化合反应生成。
反应物除了Zn外,还有O2、CO2、H2O等三种物质。
2.(2019秋•兰溪市校级月考)水在直流电的作用下可以分解,在此过程中没有发生变化的是()A.水分子的数目B.原子的种类C.物质的种类D.分子的种类【答案】B【知识点】物理变化中分子不变,改变的是分子之间的间隔和排列方式;化学变化中分子一定改变。
分子是保持物质化学性质的最小粒子。
【解析】A、水在直流电作用水分子被分解,所以水分子的数目发生了改变,故A不符合题意;B、水在直流电作用水分子被分解,但是氢原子和氧原子不变,所以构成水分子的原子种类不变,故B 符合题意;C、水在直流电作用水分子被分解,所以物质的种类发生了改变,故C不符合题意;D、水在直流电作用水分子被分解,所以水分子的种类发生了改变,故D不符合题意。
质量守恒定律》习题(含答案及解析)
质量守恒定律》习题(含答案及解析) 质量守恒定律》练题一、单选题(本大题共24小题,共48.0分)1.科学家探索用CO除去SO2,该研究涉及的一个反应SO2+2CO=2X+S,则X为()A.CO2B.CC.S2D.COS2.在化学反应前后:①物质的化学性质②原子的种类③元素的种类④反应物的质量总和与生成物的质量总和。
其中一定不发生变化的是()B.①③④3.汽车尾气是空气污染的元凶之一,使用催化净化装置可有效减少尾气污染。
下图是一种处理汽车尾气的反应微观示意图,下列有关说法正确的是()C.该反应可以减少NO2的排放4.关于下列观点中错误的有A.②③④5.偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空。
该化学方程式为C2H8N2+2N2O4=2X↑+3N2↑+4H2O↑。
下列说法正确的是()B.偏二甲肼中碳的质量分数为40%6.下图中的四位同学对H2+Cl2=2HCl的认识中,不正确的是()C.7.下列关于化学方程式C+O2→CO2的读法,错误的是()D.碳加上氧气点燃等于二氧化碳8.在一个密闭内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是()C.反应后密闭中甲的质量为22gD。
在该反应中,丙、丁的质量变化之比为3:49.XXX同学从中获得以下信息:①该反应反应物是硫和氧气;②反应发生条件是点燃;③反应前后元素种类和原子个数不变;④反应前后分子总数保持不变;⑤参加反应的硫和氧气的质量比为2:1.正确的信息是①②④⑤。
10.化学方程式不能提供的信息是化学反应的快慢。
11.某物质在空气中燃烧生成二氧化碳和水,则关于这种物质的组成描述正确的是该物质一定含有碳元素和氢元素,可能含有氧元素。
12.图中相同的球表示同种元素的原子。
下列说法错误的是该反应生成物的分子个数比为1:1.13.下列有关质量守恒定律的认识,不正确的是质量守恒定律揭示了化学变化中宏观物质间的质量关系,与微观过程无关。
中考化学精练本 第一部分 考点过关练 模块三 物质的化学变化 主题十二 质量守恒定律
考点 1:质量守恒定律的验证(2022 年考查 3 次,2021 年考查 2 次)
1.(2017·成都)用如图所示装置验证质量守恒定律,能达到实验目的的
物质组合是
( C)
A.锌和稀硫酸
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.氯化钠和稀盐酸
考点 2:质量守恒定律的应用(2022 年考查 7 次,2021 年考查 6 次,2020
4.[时事热点](2022·成都七中三模)为实现“碳中和”的目标,可以在
一定条件下将二氧化碳转化为其他物质,其中一种工艺的主要反应微观
示意图如下所示。对此反应分析不正确的是
( C)
A.X 的微观示意图可表示为
B.甲、乙的质量比为 11∶2
C.反应中所有元素的化合价
都发生变化
D.反应前后分子的数目发生改变
B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少
D.没有等锥形瓶冷却就再次称量
8.(2022·郴州)某纯净物 A 在空气中完全燃烧,配平的化学反应方程式 为:A+3O2=点==燃==2CO2+3H2O,请回答下列问题: (1)物质 A 中含有的元素有_C_、C、HH、、OO__(填元素符号); (2)求 9.2 g A 中含有的碳元素的质量是_4_.4.88g_g__。
受上述研究启发,小丽对相关实验进行了深入探究。
(3)在白磷燃烧前后质量测定实验中(如图),气球的作用有形形成成密密闭空 间间,,使瓶使内瓶气内压保气持压在保一定持范在围一内,定防范止围瓶塞内因,压防强过止大瓶而塞冲闭出因空(压合理强即 可即过可大))而。冲出(合理
(4)小丽认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不
2.[九上 P98T2(3)变式]现将 20 g A 和足量 B 在一定条件下充分反应,生成
【金牌学案】中考化学复习考点全突破专题训练卷 专题11 质量守恒定律与化学方程式
1 第三部分 物质的化学变化专题11 质量守恒定律与化学方程式(训练时间:90分钟 分值:100分)一、选择题(每题3分,共48分)1.物质X 是一种重要的阻燃剂,工业上用三氧化二锑(Sb 2O 3)生产X ,反应的化学方程式为:Sb 2O 3+2H 2O 2===X +2H 2O(已配平),则X 的化学式为( )A .Sb 2O 5B .SbO 2C .HSbO 3D .H 3SbO 4【解析】依据质量守恒定律,化学反应前后各种原子的种类和数目不变可以确定X 的化学式为Sb 2O 5。
【答案】A2.摩托罗拉公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH 3OH +3X +4NaOH===2Na 2CO 3+6H 2O ,其中X 的化学式为( )A .O 2B .COC .CO 2D .H 2【解析】根据质量守恒定律可知,化学反应前后原子的种类和个数不变,生成物中共有12个O 原子,而反应物中仅出现了6个O 原子,然后结合方程式及X 前的化学计量数,推知X 的化学式为O 2。
【答案】A3.对某化学反应前、后的判断中,不正确的是( )A .物质的质量总和一定相同B .元素的种类和质量一定相同C .物质的分子个数一定相同D .原子的总数和质量一定相同【解析】此题考查质量守恒实质的理解。
化学反应前后,物质的总质量、元素的种类和质量、原子的种类和质量都不变,但物质的分子个数可能变化,也可能不变。
答案为C 。
【答案】C4.化学方程式是描述化学反应的语言,正确的化学方程式是( )A .CuO +H 2O===Cu(OH)2B .2NaOH +CuSO 4===Na 2SO 4+Cu(OH)2↓C .4Fe +3O 2=====点燃2Fe 2O 3D .Mg +HCl===MgCl 2+H 2↑【解析】选项A 违背客观事实,氧化铜与水不反应;选项C 违背客观事实,铁丝在氧气中燃烧生成Fe 3O 4;选项D 违背了质量守恒定律,化学方程式没有配平。
聚焦中考化学【第8讲 质量守恒定律(考点梳理 方法归纳)】
第8讲 质量守恒定律质量守恒定律1.内容:参加化学反应的各物质的__质量__总和等于反应后生成的各物质的__质量__总和,这个规律叫做质量守恒定律。
2.微观解释:物质在发生化学反应前后,各物质的质量总和相等,是因为在一切化学反应中,反应前后原子的__种类__没有改变,原子的__数目__没有增减,原子的__质量__也没有变化,所以,化学反应前后各物质的质量总和必然相等。
3.化学反应前后的“622”(即:6个不变,2个改变,2个可能变)(1)“6个不变”⎩⎪⎨⎪⎧宏观⎩⎨⎧①元素的 种类 不变②元素的质量不变③物质的 总质量 不变微观⎩⎨⎧④原子的 种类 不变⑤原子的 数目 不变⑥原子的 质量 不变(2)“2个改变”⎩⎨⎧①宏观:物质的 种类 改变②微观:分子的 种类 改变(3)“2个可能变”⎩⎨⎧① 分子 的数目可能改变②元素的 化合价 可能改变4.质量守恒定律的应用(1)质量守恒定律①质量守恒定律适用的范围是化学变化而不是物理变化;②质量守恒定律揭示的是质量守恒而不是其他方面的守恒,物体的体积不一定守恒; ③质量守恒定律中“参加反应的”不是各物质质量的简单相加,而是指真正参与了反应的那部分质量,反应物中可能有一部分没有参加反应;④质量守恒定律的推论:化学反应中,反应前各物质的总质量等于反应后各物质的总质量。
(2)质量守恒定律的应用①解释反应前后物质的质量变化及质量差,确定某一物质的质量;②推断反应物或生成物的化学式; ③确定物质的组成元素;④判断化学方程式书写是否正确。
质量守恒定律的验证判断下列各题的正误:1.一切变化都遵守质量守恒定律( )2.3 g NaCl 溶于10 g 水中得到13 g NaCl 溶液,遵循质量守恒定律( )3.某纯净物在氧气中燃烧生成二氧化碳和水,则该物质中一定含有碳、氢、氧三种元素( )4.化学反应前后分子种类和个数一定发生改变( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
七巧板同步训练
http://huaxue.mqms.cn QQ:153725464 浠水县麻桥中学 罗旺明
1
第27讲 质量守恒定律
考点直击
1. 能运用质量守恒定律进行简单的计算。
2. 能用原子-分子论分析质量守恒的原因。
典题例释
例1.(09黄冈)在一密闭容器内有氧气、二氧化碳、
水蒸气和一种未知物W,在一定条件下充分反应,
测得反应前后各物质的质量如下表所示,则下列
说法中错误的是
物质 氧气 二氧化碳 水蒸气 W
反应前
质量/g
50 1 1 23
反应后
质量/g
2 45 28 x
A.根据质量守恒定律,x的值应为0
B.反应后的生成物是二氧化
碳和水
C.物质W只含碳和氢两种元
素
D.物质W一定含碳、氢、
氧三种元素
[解析]:比较反应前后物质的质量发现:O2质量减
少48g,所以O2是反应物;CO2质量增加44g,所
以CO2是生成物;水蒸气质量增加27g,所以水蒸
气是生成物。根据质量守恒定律可知,生成质量
总和为44g+27g=71g,故W在反应中是反应物,
质量为71g-48g=23g,剩余的W为23g-23g=0g。
经计算还会发现,生成物中氧元素的总质量多于
48g,所以W中一定还含氧元素。
[答案]:C
考点训练
1.(09连云港)如右图所示:2个甲分子反应生成
1个丙分子和3个乙分子,下列判断不正确...的是
A.该反应的基本反应类型是分解反应
B.参加反应的甲物质属于化合物
C.该化学反应中原子的种类发生了改变
D.根据质量守恒定律可推知,1个乙分子中含有
2个A原子
2.(09常州)下列现象能用质量守恒定律解释的是
A.化学反应中常伴随热量变化,有的放热,有
的吸热
B.100g干冰完全汽化成100g气体
C.10gNaCl溶解在90g水中,成为100gNaCl溶
液
D.一定量的煤完全燃烧后生成的所有物质的质
量之和大于煤的原质量
3.(09兰州)已知某两种物质在光照条件下能发生
化学反应,其微观示意图如下:(说明:一种小球
代表一种原子)则下列说法不正确的是
A.该反应属于置换反应
B.图示中共有4种分子
C.该图示说明在化学变化中分子可分,原子不可
分
D.以上反应符合质量守恒定律
4.(09黔东南)下列叙述完全符合质量守恒定律的是
A.水结成冰前后,质量保持不变
B.50mL水和50 mL乙醇混合后总体积小于100 mL
C.在100g过氧化氢溶液中,含有30g过氧化氢和
70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g
二氧化碳
5.(09宜昌)下列对化学反应前后质量变化的解释,
不符合质量守恒定律的是
A.高锰酸钾受热分解后固体剩余物的质量减小,
是因为放出了氧气
B.蜡烛燃烧后质量变小,是因为蜡烛受热形成了
石蜡蒸气
C.细铁丝在氧气中燃烧后,质量增大,是因为生
成物中含有氧的质量
D.白磷在密闭容器中燃烧,反应前后总质量不变,
是因为生成物都没有逸散
6.(09海南) W、X、Y、Z四种物质在一定条件下
充分反应后,测得反应前后各物质的质量如下:
物质
W X Y Z
反应前质量g
2 22 34 0
反应后质量g 2 40 待测
16
下列说法错误的是
A.W在反应中可能是催化剂
B.该反应中生成X的质量为40g
C.该反应属于分解反应
D.该反应中Y全部参加反应
7.(09无锡)一定条件下,在一个密闭容器内发生
+
+3乙
甲 甲 丙
表示A原子 表示B原子
b.收集气
七巧板同步训练
http://huaxue.mqms.cn QQ:153725464 浠水县麻桥中学 罗旺明
2
某反应,测得反应过程中各物质的质量如下表所示下列叙述正确的是 物质 A B C D 第一次测得的质量/g 50 4 4.6 1 第二次测得的质量/g 待测 20 23 4.2 A.上述反应属于化合反应 B.该反应中C与D的质量变化之比为23:4 C.第二次测得A的质量为12.4g D.该反应中共生成D的质量为4.2g 8.(09杭州)据报道,科学家发明了一种“月球制氧机”,这种“月球制氧机”可利用聚焦太阳能产生的高温加热月球土壤,制得氧气。据此可推测月球土壤中一定含有 A.氧化物 B.氧气 C.水 D.氧元素 9.(09德州)2008年4月8日安徽省阜南县一所小学又发生一起误把亚硝酸钠当食盐的中毒事件,确保食品安全的警钟再次敲响,亚硝酸钠(NaNO2)外观与食盐极相似,有咸味,区别它们的有效方法是隔绝空气加热,没有明显变化的是食盐,能分解放出刺激性气味气体的是亚硝酸钠,此气体可能是 A、SO2 B、NH3 C、N2 D、NO2 10.(09金华)某校科学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样一个实验:让水蒸气通过一根烧红的枪管,生成丁一种气体。同学们对这个实验很感兴趣。 [问题] 红热的铁与水蒸气反应生成的气体是什么? [猜想] 猜想一:生成的气体可能是氧气。 猜想二:生成的气体可能是氢气。 [探究] 为验证生成的气体是什么,该组同学在老师的指导下,设计了如图实验装置,并收集反应产生的气体(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。A试管内装有铁粉,B烧瓶中装有一定量的水,提供反应所需水蒸气。 (1)该装置中需加热的仪器为 (填字母)。 (2)图中C装置在实验中起到了安全瓶的作用。若没有C装置,实验结束时,先熄灭加热设备,再把导管移出水面,这样操作可能会导致 。 (3)该组同学对所收集的气体进一步实验发现:该气体不溶于水,比空气轻,并且能燃烧。请你通过
分析反应物的组成,结合实验现象,判断反应生
成的气体是 。
(4)该反应在生成气体的同时,还生成了一种黑色粉
末状固体,则组成黑色固体的元素应该是
(填元素符号)。
11.(09肇庆)兴趣小组同学为了弄清即将维修的沼
气池中气体的成分,进行了有关实
验。请你与他们一起完成以下探究
活动:
【收集气体】将不加盖的矿泉水瓶装
满水,用细绳吊入池中,再用木棍
拨动使瓶中的水全部倒出(见右
图),然后迅速拉起矿泉水瓶,盖
上瓶盖。这种方法属于 集气法。
【对气体猜想】
猜想Ⅰ.全部是CH4;
猜想Ⅱ.全部是CO;
猜想Ⅲ.全部是CO2;
猜想Ⅳ.是CH4和CO2的混合气体。
【实验和推断】
(1)若“现象a”为石灰水变浑浊,则说明气体中
含有 气体。
(2)步骤②的目的是 ;步
骤③“注水装置”应选右
图中的 (填序号)。
(3)若“现象b”为杯壁有
水雾出现,有同学认为
“猜想Ⅰ或Ⅳ”成立,其
反应方程式为:
;另有同学认为此现
象不能证明收集到的气体中一定含有氢元素,理
由是 ;要排除这种干
扰可采取的措施是 。
(4)采取(3)中的排除干扰措施后:若“现象a、
b”无明显现象,“现象c”石灰水变浑浊,则证
明“猜想 ”成立;若“现象a、c”均为石灰
水变浑浊,“现象b”为杯壁有水雾,则证明“猜
想 ”成立。
ⅰ ⅱ
现象b
干冷烧杯罩在火焰上方
杯壁涂有澄清石灰水
的烧杯罩在火焰上方
现象c
4
5
瓶中
气体
振荡
1
加“注水装置”
3
2
振荡
瓶中剩
余气体
导出气体,点燃
NaOH溶液
适 量
现象a
滴入2滴
澄清石灰水
