LexA酵母双杂交系统简介
酵母双杂交系统的原理及应用

酵母双杂交系统的原理及应用酵母双杂交系统由Fields和Song等首先在研究真核基因转录调控中建立。
典型的真核生长转录因子,如GAL4、GCN4、等都含有二个不同的结构域: DNA结合结构域(DNA-binding domain)和转录激活结构域(transcription-activating domain)。
前者可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因的上游,转录激活结构域可同转录复合体的其他成分作用,启动它所调节的基因的转录。
二个结构域不但可在其连接区适当部位打开,仍具有各自的功能。
而且不同两结构域可重建发挥转录激活作用。
酵母双杂交系统利用杂交基因通过激活报道基因的表达探测蛋白-蛋白的相互作用。
主要有二类载体: a 含DNA -binding domain的载体; b 含DNA-activating domain的载体。
上述二类载体在构建融合基因时,测试蛋白基因与结构域基因必须在阅读框内融合。
融合基因在报告株中表达,其表达产物只有定位于核内才能驱动报告基因的转录。
例如GAL4-bd具有核定位序列(nuclear-localization sequence),而GAL4-ad没有。
因此,在GAL4-ad 氨基端或羧基端应克隆来自SV40的T-抗原的一段序列作为核定位的序列。
双杂交系统的另一个重要的元件是报道株。
报道株指经改造的、含报道基因(reporter gene)的重组质粒的宿主细胞。
最常用的是酵母细胞,酵母细胞作为报道株的酵母双杂交系统具有许多优点: 〈1〉易于转化、便于回收扩增质粒。
〈2〉具有可直接进行选择的标记基因和特征性报道基因。
〈3〉酵母的内源性蛋白不易同来源于哺乳动物的蛋白结合。
一般编码一个蛋白的基因融合到明确的转录调控因子的DNA-结合结构域(如GAL4-bd,LexA-bd);另一个基因融合到转录激活结构域(如GAL4-ad,VP16)。
激活结构域融合基因转入表达结合结构域融合基因的酵母细胞系中,蛋白间的作用使得转录因子重建导致相邻的报道基因表达(如lacZ),从而可分析蛋白间的结合作用。
酵母双杂交系统原理(一)

酵母双杂交系统原理(一)酵母双杂交系统1. 什么是酵母双杂交系统?•酵母双杂交系统是一种常用的蛋白质相互作用研究方法,用于测试两个蛋白质是否相互作用,并进一步研究其相互作用的特点和机制。
•这个系统基于酵母菌(酿酒酵母或拟南芥酵母)的特性,当两个蛋白质相互作用时,可以触发酵母的生长或表达特定的报告基因。
2. 酵母双杂交系统的原理•酵母双杂交系统基于两个重要的分子域:DNA结合域(DBD)和激活域(AD)。
•DBD通常来自于一个转录因子,可以与DNA结合并调节基因的转录水平。
•AD则是一个激活域,可以与其他蛋白质相互作用并激活报告基因的表达。
•在酵母双杂交系统中,将待测蛋白的DBD与一个对照蛋白的AD 融合,构建成DBD-融合蛋白,而待测蛋白的AD与一个对照蛋白的DBD融合,构建成AD-融合蛋白。
•当两个融合蛋白相互作用时,DBD和AD相互结合,激活报告基因的表达,从而观察到酵母生长或报告基因的表达。
3. 酵母双杂交系统的应用•酵母双杂交系统广泛应用于蛋白质相互作用和功能研究领域。
•可以用于筛选蛋白质相互作用的伙伴,发现新的蛋白质复合物。
•可以用于研究蛋白质的亚细胞定位和功能等特性。
•可以用于研究蛋白质结构和功能的变异。
•可以用于研究蛋白质与其他生物分子(如DNA、RNA、小分子化合物等)的相互作用。
•可以用于研究蛋白质的信号传导途径和调控机制。
4. 酵母双杂交系统的优缺点优点:•酵母双杂交系统是一种简单、快速、高通量的方法,可以同时测试多个蛋白质相互作用。
•可以研究蛋白质相互作用的强度和特异性。
•可以在活细胞环境下进行研究,更接近生物体内的情况。
缺点:•酵母双杂交系统可能存在假阳性和假阴性的问题,需要进行进一步的验证。
•酵母双杂交系统对蛋白质的折叠状态和局部结构要求较高,对于某些复杂蛋白质可能不适用。
•酵母双杂交系统无法直接观察蛋白质相互作用的动力学过程,只能得到静态的结果。
总结酵母双杂交系统是一种重要的蛋白质相互作用研究方法,基于酵母菌的特性,通过构建融合蛋白实现对蛋白质相互作用的测试。
酵母双杂交系统

4.寻找具有药物治疗作相互作 用的多肽、如果靶蛋白是药物设计的目标的话, 可以得到一些具有药物治疗作用的小分子多肽 药物 。Yang等证明了一段Leu-X-Cys-X-GIu 多肽可以和成视网膜细胞瘤(Rb)蛋白相互结合。 为这项研究打下了基础。
5.寻找与调控蛋白相互作用的化 合物
用以确定有相互作用的两个蛋白,在 恢复转录活性的双杂交系统中加入某一 分子化合物后。再检测报告基因的表达 强度,可以寻找抑制蛋白一蛋白相互作 用的小分子化合物。
6.蛋白质相互作用图谱的绘制
随着基因组研究计划的发展,以及mRNA 在不同组织器官及不同发育阶段的表达图 谱的构建(body map),蛋白质在不同时空 状态下相互作用图谱的构建也逐渐展开。 在双杂交系统的BD及AD均接上cDNA库,让 它们随机表达蛋白,这样检测报告基因表 达的可能是A-B,B-c⋯⋯等一系列崭新的 蛋白一蛋白相互作用,据此可以绘出A-B -C的蛋白联系图谱。
母菌株含有特定报告基因,并已经去除相应转
录因子的编码基因,因此本身无报告基因的转 录活性。如果X、Y蛋白在酵母核内发生相互 作用,导致了BD与AD在空间上的接近,从而 激活UAS下游启动子调节的报告基因的表达,
使转化体可在特定的缺陷培养基上生长。通过 筛选阳性菌落即可检测 “诱饵”和 猎物”蛋
白间的相互作用。
当GAL4的DNA结合区与DNA上游的激活序列(upstream activating sequence,UAS)结合,其转录激活区则能有效 地激活UAS下游报告基因的转录;当两者不能通过中间 序列结合,任一区域都不会激活下游报告基因的转录. 酵母双杂交系统将待研究的两个蛋白质,其中之一与 DNA结合区蛋白质构建成第一个融合蛋白,另外一个与 转录激活LacZ基因还可以与
酵母双杂交原理ppt演示

当两个蛋白质之间发生相互作用时,DNA结合域和转录激活域之间的空间构象发生 变化,从而激活报告基因的表达。
酵母双杂交系统的应用领域
蛋白质相互作用研究
通过酵母双杂交系统可以检测蛋白质 之间的相互作用,为研究蛋白质的功 能和调控机制提供有力支持。
将诱饵蛋白基因克隆到表达载 体中,转化大肠杆菌进行表达。
通过亲和纯化技术,如镍柱亲 和纯化,分离纯化诱饵蛋白。
目的
• 制备钓饵蛋白,用于与诱饵蛋白进行相互作用筛 选。
目的
• 将诱饵蛋白和钓饵蛋白导入酵母细胞中, 通过相互筛选找到与诱饵蛋白相互作用的 蛋白质。
目的
• 验证筛选得到的阳性克隆是否真正与诱饵蛋白相互作用。
03 酵母双杂交系统的应用实 例
蛋白质相互作用研究
01 02
蛋白质相互作用研究
酵母双杂交系统能够用于研究蛋白质之间的相互作用,通过将两个蛋白 质分别与转录激活域和转录抑制域融合,观察它们之间的相互作用是否 会导致转录活性的变化。
验证已知相互作用
利用酵母双杂交系统可以验证已知的蛋白质相互作用,从而验证相关生 物学过程的机制。
缺点
由于酵母双杂交系统依赖于真核生物的转录调控机制,因此对于某些在酵母中 不表达或表达水平较低的蛋白质可能无法检测到相互作用。此外,酵母双杂交 实验也可能受到非特异性干扰因素的影响。
02 酵母双杂交系统的实验流 程
目的
• 制备诱饵蛋白,用于筛选与钓饵蛋白相互作用的蛋白质。
步骤
设计诱饵蛋白的基因序列,确 保其在大肠杆菌中表达,并具 有可纯化的标签。
酵母双杂交
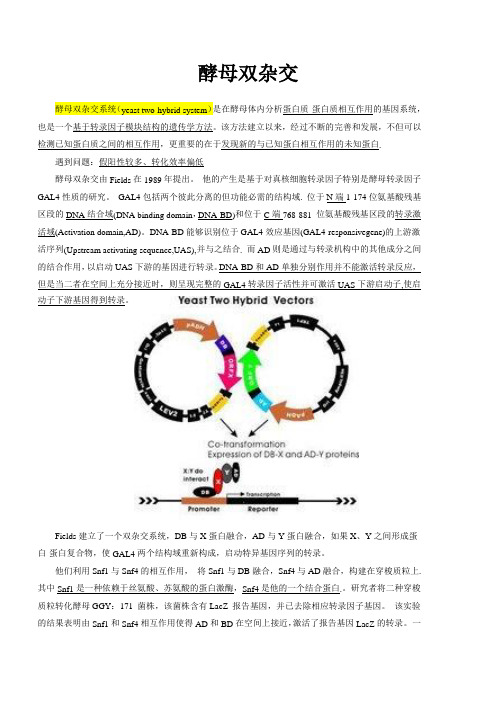
酵母双杂交遇到问题:假阳性较多、转化效率偏低酵母双杂交由Fields在1989年提出。
他的产生是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究。
GAL4包括两个彼此分离的但功能必需的结构域. 位于N端1-174位氨基酸残基区段的DNA结合域(DNA binding domain,DNA-BD)和位于C端768-881 位氨基酸残基区段的转录激活域(Activation domain,AD)。
DNA-BD能够识别位于GAL4效应基因(GAL4-responsivegene)的上游激活序列(Upstream activating sequence,UAS),并与之结合. 而AD则是通过与转录机构中的其他成分之间的结合作用,以启动UAS下游的基因进行转录。
DNA-BD和AD单独分别作用并不能激活转录反应,但是当二者在空间上充分接近时,则呈现完整的GAL4转录因子活性并可激活UAS下游启动子,使启动子下游基因得到转录。
产生原理双杂交系统的建立得力于对真核生物调控转录起始过程的认识。
细胞起始基因转录需要有反式转录激活因子的参与。
80年代的工作表明,转录激活因子在结构上是组件式的(modular), 即这些因子往往由两个或两个以上相互独立的结构域构成, 其中有DNA结合结构域(DNA binding domain,简称为DB)和转录激活结构域(activation domain,简称为AD),它们是转录激活因子发挥功能所必需的。
前者可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因的上游,转录激活结构域可同转录复合体的其他成分作用,启动它所调节的基因的转录。
二个结构域不但可在其连接区适当部位打开,仍具有利用酵母双杂交筛选基因各自的功能,而且不同两结构域可重建发挥转录激活作用。
酵母双杂交系统利用杂交基因通过激活报道基因的表达探测蛋白-蛋白的相互作用。
单独的DB虽然能和启动子结合,但是不能激活转录。
《酵母双杂交系统》课件

01
明确研究目标,确定需要验证的蛋白间相互作用或筛选与特定
蛋白相互作用的候选蛋白。
挑选合适的酵母菌株
02
根据研究目的选择适合的酵母菌株,如用于筛选候选蛋白的酵
母菌株或用于验证已知相互作用蛋白的酵母菌株。
构建诱饵和猎物蛋白的表达载体
03
将目的蛋白分别克隆到酵母表达载体上,构建诱饵和猎物蛋白
的表达载体。
应用领域
蛋白质互作网络研究
利用酵母双杂交系统可以大规模地筛选蛋白质之间的 相互作用,构建蛋白质互作网络。
疾病机制研究
通过研究疾病相关蛋白的相互作用,有助于深入了解 疾病的发生和发展机制。
药物靶点发现
发现新的药物靶点,为药物研发提供新的思路和方向 。
02
酵母双杂交系统的实验流程
准备阶段
确定研究目的
基因表达调控研究
研究转录因子与DNA的结合
利用酵母双杂交系统可以筛选与特定DNA序列结合的转录因子,进而研究其在基因表达调控中的作用 。
发现新的转录因子
通过与已知转录因子的相互作用筛选,可以发现新的转录因子,进一步揭示基因表达调控的机制。
药物发现与设计
寻找药物靶点
利用酵母双杂交系统可以筛选与药物作用靶点相互作用的蛋白质,为药物发现提供潜在 的靶点。
对生命科学领域的影响与贡献
促进基础研究
酵母双杂交系统作为一种强大的研究工具,有助于深入揭示生命 过程的奥秘,推动生命科学领域的基础研究。
疾病机制与治疗研究
通过研究疾病相关蛋白的相互作用,为疾病机制的解析和药物研发 提供有力支持。
生物技术产业
酵母双杂交系统的应用有助于推动生物技术产业的发展,如新药发 现、生物制品开发等。
酵母双杂交技术1
发展背景
酵母双杂交系统是由Fields等在1989年提出的一种在活细 胞中鉴定蛋白质相互作用的遗传系统。
酵母双杂交系统的建立得力于对真核细胞调控转录起始
过程的认识。研究发现,许多真核生物的转录因子都是由 两个可以分开的、功能上相互独立的结构域组成的。
酵母双杂交系统是一种在酵母细胞内分析 蛋白质相互作用的技术。 它可用于: 检验蛋白质间的相互作用; 分析蛋白质相互作用的结构域; 发现新的作用蛋白质。
酵母双杂交技术的原理
基于对真核生物基因调控转录起始过程的认识。 基因转录不仅需要有特定的DNA顺式序列结构,而且也需 要有反式转录激活因子的参与。 转录激活因子往往由两个或两个以上相互独立的结构域构 成,其中有DNA结合结构域(DNA binding domain, DB)和转录激活 结构域(activation domain, AD), 它们都是能激活基因转录,但不同转录激活因子 的DB和AD形成的杂合蛋白仍然具有正常的激活转录的功能。
酵母双杂交操作主要流程
1. 2. 3. 4. 5. 6. 分别构建BD和AD融合蛋白载体 分别将重组载体转化酵母菌细胞 对酵母转化子进行自激活检测 将重组载体共转化酵母菌细胞 检测报告基因表达产物 分析酵母双杂交实验结果
酵母双杂交技术的优点:
1. 是一种细胞内蛋白质相互作用研究技术,比体外的蛋白 质相互作用技术更接近生物体内的真实情况。
如果要研究两个蛋白之间有无相互作用,可以把这两 个蛋白分别与DB和AD形成的融合蛋白。 与DB 融合的蛋白称为“诱饵”(bait), 与AD融合的蛋白称为“猎物”(prey)。 如果这两个蛋白能发生相互作用, 这两个融合蛋白上的 DB和AD就能重新形成有活性的转录激活因子, 从而激活报告 基因(reporter gene)的转录与表达。通过检测报告基因的 表达产物, 可判别“诱饵”和“猎物”这两个蛋白质之间是 否存在相互作用。
酵母双杂交原理介绍
酵母双杂交技术酵母双杂交技术¾酵母双杂交系统( two-hybridsystem) 也叫相互作用陷阱( interaction trap),是1989年由Song和Field基于酵母的细胞内检测蛋白间相互作用的遗传系统建立的。
¾酵母双杂交技术是一种有效的真核活细胞内研究方法,在蛋白质相互作用的研究方面得到了广泛的应用并取得了许多有价值的重要发现。
在此基础上又发展了反向双杂交,三杂交及核外双杂交等多项技术。
Stanley Field酵母双杂交技术的提出2.酵母双杂交原理介绍酵母中,半乳糖代谢所需的基因被两个调节蛋白所控制:GAL4,GAL80当存在半乳糖时,GAL4蛋白与UAS上游的基因中的GAL4效应元件结合,激活转录。
不存在半乳糖时,GAL80结合GAL4阻碍转录激活。
2.酵母双杂交原理介绍完整的酵母转录因子GAl4分为结构上可以分开的、功能上又相互独立的2个结构域。
一个是位于N端1-174位氨基酸残基区段的DNA结合域(DNA binding domain, DNA-BD)。
另一个是位于C端768~881位氨基酸残基区段的转录激活域(Activation domain,AD)。
酵母双杂交技术原理很多真核生物的位点特异转录激活因子通常具有两个可分割开的结构域,即DNA特异结合域(DNA-binding domain,BD)与转录激活域(Transcriptional activation domain ,AD)。
这两个结构域各具功能,互不影响。
但一个完整的激活特定基因表达的激活因子必须同时含有这两个结构域,否则无法完成激活功能。
酵母双杂交系统组成酵母双杂交系统由三个部分组成:(1)与BD融合的蛋白表达载体,被表达的蛋白称诱饵蛋白(bait);(2)与AD融合的蛋白表达载体,被其表达的蛋白称靶蛋白(prey);(3)带有一个或多个报告基因的宿主菌株。
常用的报告基因有HIS3,URA3,LacZ和绿色荧光蛋白等2.酵母双杂交原理介绍一个酵母双杂交系统包括3个部分:带有1个或多个报告基因的宿主菌株;与GAL4-BD 融合表达蛋白,被表达的蛋白称为旅馆诱饵蛋白(bait);GAL4-AD 融合表达载体,被表达的蛋自称为靶蛋白(prey)。
酵母双杂交系统课件
简称为DB)和转录激活结构域(activation domain,简称 为AD) • 报道株 :经改造的、含报道基因的重组质粒的宿主细胞。 最常用的是酵母细胞。
• 酵母细胞作为报道株的酵母双杂交系统具有许多优点①易 于转化、便于回收扩增质粒;②具有可直接进行选择的标 记基因和特征性报道基因;③酵母的内源性蛋白不易同来 源于哺乳动物的蛋白结合。
阳性克隆的进一步鉴定
B a i t p r o 文t 档e i仅n 供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
LexA B42 BD
No Transctiption
LexA operator
Promoter LEU2 and Lac2 reporter genes
DNA-AD
• i. GAL4蛋白质是一个调控基因,控制半乳糖利用酶类 基因的表达,这些基因的5’-端存在UAS序列;
• ii. GAL4存在两个结构域:N-端(1-147)具有UAS-DNA结 合域(DNA-binding domain, BD), C-端(768-881)具有转录 激活结构域(transcriptional activation domain, AD)。二个 结构域不但可在其连接区适当部位打开,仍具有各自的功 能,而且不同两结构域可重建发挥转录激活作用。单独的 DB虽然能和启动子结合,但是不能激活转录
Library protein
No Transctiption
LexA operator
Promoter LEU2 and Lac2 reporter genes
Bait protein LexA
酵母双杂交筛选简介和流程
酵母双杂交筛选简介和流程实验原理蛋白的酵母双杂交实验是以酵母的遗传分析为基础,研究反式作用因子之间的相互作用对真核基因转录调控影响的实验。
很早就已知道,转录活化蛋白可以和 DNA 上特异的序列结合而启动相应基因的转录反应。
这种DNA 结合与转录激活的功能是由转录活化蛋白上两个相互独立的结构域即 DNA 结合结构域(Binding Domain, BD)和转录活化结构域(Activation Domain, AD)分别来完成的,并且这两个结构域对于基因的转录活化都是必须的。
目前酵母双杂交实验采用的系统有 LexA 系统和 Gal4 系统两种。
在 LexA 系统中,DNA 结合结构域由一个完整的原核蛋白 LexA 构成,转录活化结构域则由一个 88 个氨基酸的酸性的大肠杆菌多肽B42 构成,它在酵母中可以活化基因的转录; 在 Gal4 系统中,BD 和 AD 分别由 Gal4蛋白上不同的两个结构域(1-147aa 与 768-881aa)构成。
在利用 GAL4 系统筛选 cDNA 文库或研究蛋白间的相互作用时,DNA 结合结构域与靶蛋白即“诱饵”相结合,转录活化结构域与文库蛋白或要验证的蛋白相结合。
一般情况下,单独的 BD 可以与 GAL4 上游活化序列(GAL UAS)结合但不能引起转录,单独的 AD 则不能与 GAL UAS 结合,只有当 BD 与AD 分别表达的融合蛋白由于相互作用而导致两者在空间上相互靠近时,BD 与 AD 才能与GAL UAS 结合并且引起报道基因的转录。
在 BD 与 AD 要导入的酵母菌 AH109 中,通过基因工程的方法在 GAL4 UASs 和启动子的下游构建了 3 个报道基因——ADE2,HIS3,MEL1(或 LacZ),因此可以通过营养缺陷筛选和酵母菌表型的改变来筛选或验证两个蛋白之间是否存在相互作用。
GAL4 系统的原理如图所示:酵母双杂交 GAL4 系统筛选 cDNA 文库实验流程GAL 系统所用酵母菌株与载体1). GAL 系统所用酵母菌株2). GAL 系统所用各种质粒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LexA酵母双杂交系统简介一、LexA酵母双杂交系统的设计原理报告质粒p8op-LacZ的GAL4 UAS编码序列被完全去除,因此在缺乏LexA融合激活剂的情况下,报告基因LacZ的转录活性为零,该基因的筛选标志为URA3,可以作为有自主复制能力的质粒存在于酵母EGY48菌株中,也可以被整合到EGY48基因组DNA上。
质粒pLexA的筛选标志为HIS3,在双杂交系统中用于表达DNA-BD(202个氨基酸残基组成的LexA蛋白)与目标蛋白(钓饵,Bait)的融合蛋白,该融合体的表达受酵母强启动子ADH1的调控,选择与报告基因的操纵子LexA×8结合。
质粒pB42AD的筛选标志为TRP1,在其供外源基因插入的多克隆位点(EcoR I与Xho I)上游,含有SV40核定位(SV40 nuclear localization)、HA(血凝素)及AD(来自于E.coli的88个氨基酸残基组成的B42蛋白)等几种编码序列,共同组成可以启动报告基因转录表达的激活成份。
在酵母EGY48的基因组中还整合有另一个报告基因Leu,它与LacZ报告基因具有相同的操纵子-LexA,但两者启动子不同。
根据双杂交系统的原理,如果某一复合物同时具有DNA-BD和AD的活性,即可激活报告基因的转录和表达。
分别将待测蛋白X、Y的编码序列插入pLexA质粒载体和pB42AD质粒载体的多克隆位点中,然后共同转入含有报告基因的酵母菌株,如果蛋白X与Y能相互作用,则启动报告基因的转录和表达,通过检测报告基因的表达情况,就可以间接反映蛋白X、Y是否具有相互作用以及作用的强弱。
如果将蛋白Y换为取自组织或血液的cDNA文库,则可用X从该文库中筛选出能与其相互作用的蛋白,并且可以获得编码这些蛋白的cDNA。
二、商品化酵母双杂交系统的组成1.载体质粒:pLexA、pB42AD、p8op-LacZ、pB42AD-DNA文库2.酵母菌株:EGY48、EGY48(p8op-LacZ)、YM4271(EGY48的伴侣菌株)3.大肠杆菌菌株:E.coli KC8株4.对照质粒:质粒用途pLexA-53,pB42AD-T阳性对照pLexA-Pos(LexA/GAL4 AD融合蛋白〕阳性对照pLexA-Lam(LaminC蛋白少与其它蛋白相互作用)假阳性检测质粒5.引物:pLexA测序引物及pB42AD测序引物。
三、酵母双杂交实验的基本流程1.将报告基因p8op-LacZ转化酵母EGY48菌株,用培养基SD/-Ura筛选。
2.同时构建或扩增DNA文库,并纯化足够的质粒以转化酵母细胞。
3.构建DNA-BD/靶蛋白质粒pLexA-X,作为钓饵(bait)。
4.将上述钓饵质粒pLexA-X转化EGY48(p8op-LacZ)细胞株,用SD/-His/-Ura筛选;并用固体诱导培养基SD/Gal/Raf/-His/-Ura检测此DNA-BD/靶蛋白是否具有直接激活报告基因的活性,以及对酵母细胞是否具有杀伤毒性。
转化质粒选择培养基克隆生长情况说明(含有Gal/Raf)pLexA-Pos SD/-His,-Ura蓝阳性对照pLexA SD/-His,-Ura白阴性对照PlexA-X SD/-His,-Ura白没有直接激活活性PlexA-X SD/-His,-Ura蓝具有直接激活活性PlexA-X SD/-His,-Ura菌落不能生长酵母细胞毒性4-1.如果pLexA-X -半乳糖苷酶的信号作用。
能够自动激活报告基因,则设法去除其激活活性部位、或者将LacZ报告基因整合入基因组,减少4-2.如果pLexA-X虽然不会自动激活报告基因,但对酵母宿主细胞有毒性,则需要与纯化的文库DNA同时转化酵母。
5.如果pLexA-X既不会自动激活报告基因,也不具有毒性,则可以与纯化的文库DNA同时、或顺序转化酵母细胞,并检测质粒转化效率。
转化质粒SD固体培养基LacZ表型对照1pLexA-Pos Gal/Raf/-His/-Ura蓝对照2pLexA-53Gal/Raf/-His/-Trp/-Ura/-Leu蓝+pB42AD-T实验pLexA-X Gal/Raf/-His/-Trp/-Ura/-Leu待测+pB42AD-文库5-1.用SD/-His/-Trp/-Ura培养基选择阳性共转化子,并扩增,使宿主细胞中的质粒在诱导前达到最大拷贝数。
-半乳糖苷酶无表达。
5-2.上述重组子转至含X-gal的固体诱导培养基SD/Gal/Raf/-His/-Trp/-Ura/-Leu,观察LacZ及Leu报告基因的表达情形,蓝色克隆即为阳性。
白色克隆为假阳性,说明Leu虽有表达,但5-3.同时用LacZ、Leu两个报告基因的目的,是为了尽可能消除实验的假阳性误差,譬如:AD融合蛋白不与目标蛋白结合,而直接与启动子序列结合域结合等情况。
由于2个报告基因的启动子不同,出现上述假阳性的几率就大大减少了。
5-4.将蓝色阳性克隆进行1次以上的划种,尽可能分离克隆中的多种文库质粒。
6.阳性克隆的筛选6-1.随机选取50个阳性克隆,扩增、抽提酵母质粒,电转化E.coli KC8宿主菌,抽提大肠杆菌中的质粒,酶切鉴定是否具有插入片段及排除相同的文库质粒。
6-2.如果重复的插入序列较多,可另取50个阳性克隆来分析。
最后得到数种片段大小不同的插入序列,再转化新的宿主细胞,检测是否仍为阳性克隆。
7. 用质粒自然分选法(Natural Segregation)筛除只含有AD-文库杂合子的克隆7-1.将初步得到的阳性克隆接种SD/-Trp/-Ura液体培养基,培养1-2天,含有HIS3编码序列的BD-靶质粒在含有外源His培养基中,将以10%-20%左右的频率随机丢失。
C孵育2-3天。
7-2.将上述克隆,转铺固体培养基SD/-Trp/-Ura,307-3.再挑取生长的单克隆,转入SD/-Trp/-Ura和SD/-His/-Trp/-Ura培养基中,筛选His 表型缺陷的克隆,即得到只含有AD-文库杂合子的重组子。
7-4.将His表型缺陷的克隆转化固体诱导培养基SD/Gal/Raf/-Trp/-Ura,以验证AD-文库能否直接激活报告基因的表达,弃去阳性克隆,保留阴性克隆。
8.酵母杂合试验(Yeast Mating)确定真阳性克隆如下表所示,在酵母EGY48及其对应的YM4271宿主细胞中分别转入相应的质粒或文库DNA,通过杂合实验确筛选pLexA-靶DNA与pB42AD-文库确实具有相互作用的真阳性克隆。
质粒1(in YM4271)质粒2(in EGY48)LacZ表型Leu表型pLexA pB42AD白不能生长pLexA-靶DNA pB42AD白不能生长pLexA pB42AD-文库白不能生长pLexA-靶DNA pB42AD-文库蓝真阳性pLexA-Lam pB42AD-文库白不能生长9. 阳性克隆的进一步筛选和确证9-1.扩增初步确定的阳性克隆,抽提酵母DNA。
该DNA为混合成份,既含有酵母基因组DNA,也含有3种转化的质粒DNA。
9-2.将上述DNA电转化E.coli KC8宿主菌。
由于在大肠杆菌中,具有不同复制起始调控序列的质粒不相容;同时利用营养缺陷型筛选。
因此,在M9/SD/-Trp培养基上,只有含有AD-文库质粒的转化菌才能生长,将其扩增、并抽提质粒DNA,酶切鉴定。
9-3.用pLexA-靶DNA与pB42AD-库DNA一一对应、共转化只含有报告基因的酵母菌EGY48中,先到SD/-His/-Trp/-Ura板扩增,并与后面的诱导板形成对照,说明报告基因的表达与诱导AD融合蛋白的表达有关,再确证LacZ、Leu报告基因的表达。
9-4.扩增与靶DNA相互作用的文库DNA,进行序列分析及进一步的结构、功能研究。
10. 对双杂交系统阳性结果的进一步研究10-1.用不同的双杂交系统验证10-1-1.将载体 pLexA与pB42AD互换后进行双杂交实验。
10-1-2.选择不同的双杂交系统,如:以GAL4转录激活子为基础的双杂交系统。
10-1-3.将文库质粒移码突变后,再与靶质粒作用,报告基因是否仍能被激活。
-半乳糖苷酶水平,比较作用强度变化。
10-1-4.去除或突变特定结合位点,定量检测10-2.用试剂盒提供的引物测定插入片段的DNA序列,证明其编码区域。
10-3.用其它的检测方法,如:亲和色谱法或免疫共沉淀法来证明双杂交系统筛选的蛋白之间的具有相互作用。
10-4.进一步研究靶蛋白与筛选蛋白之间的功能关系构建于AD载体的cDNA文库的扩增1.自-80℃冰箱取出含有cDNA文库的甘油菌,臵于冰浴中缓慢化冻。
2.用新鲜的LB培养液在1.5ml离心管中将上述甘油菌1:106和1:108稀释。
l l加入90 3.取稀释菌液各10 90mm);37℃倒臵培养过夜或30℃培养24-36hr,计数平板上单克隆菌落数。
LB培养液在1.5ml离心管中振荡混匀,涂布LB/Amp平板(4.确定待扩增的cDNA文库滴度(cfu/ml)=克隆数×108(1:106稀释)或克隆数×1010(1:108稀释)。
5.按照>150mm),共100块;37℃倒臵培养过夜。
2-4×104cfu/平板的浓度,涂布LB/Amp 平板(6.在超净工作台上,在所有生长菌落的平板上加适量LB培养液,将菌落刮下,转入2000ml LB/Amp培养液中,37℃振荡培养2-4hr。
7.留取适量培养菌液以50%无菌甘油稀释至25%终浓度,分装,保存于-80℃。
8.其余培养菌液离心8000xg×10min,4℃收集细菌;用质粒DNA纯化试剂盒大量抽提质粒DNA。
LB液体培养基,121℃,15lb/in2灭菌15minA.bacto-Tryptone10.0gB.bacto-Yeast Extract 5.0gC.NaCl10.0gD.ddH2O →1000 ml* LB固体培养平板为含有1.5%琼脂(Agar)LB培养基。
** LB/Amp培养基为含有Amp g/ml的LB培养基。
50-100构建于AD载体的cDNA文库的纯化1.质粒DNA提取缓冲液名称缓冲液配方g/ml RNase P1悬浮缓冲液50mM Tris-HCl(pH8.0);10mM EDTA;100 AP2裂解缓冲液200mM NaOH;1% SDSP3中和缓冲液 3.0M Kac(pH5.5)QBT平衡缓冲液750mM NaCl;50mM MOPS(pH7.0);15%异丙醇;0.15% Triton X-100QC洗涤缓冲液 1.0 M NaCl;50mM MOPS(pH7.0);15%异丙醇QF洗脱缓冲液 1.25 M NaCl;50mM Tris-HCl(pH8.5);15%异丙醇2.培养菌液离心6000xg×10min,4℃,每500ml培养物(下同)的沉淀重悬于50ml P1缓冲液。
