溶液吸附法测量固体物质的比表面
溶液吸附法测定固体比表面积

2 -1 2 -1
次甲基蓝原始溶液 2g·dm ;次甲基蓝标准溶液 0.1g·dm ;颗粒活性炭。 三、实验步骤 1.活化样品 将活性炭置于瓷坩埚中放入 500℃马福炉中活化 1h(或在真空箱中 300℃活化 1h), 然后 置于干燥器中备用。 2.溶液吸附 取 50mL 带塞锥形瓶 5 只,分别准确称取活化过的活性炭约 0.1g,按照下表给出的比例 配制不同浓度的次甲基蓝溶液 50mL,塞上包有锡纸的软木塞,然后放在振荡器上振荡 3h。 编号 V(次甲基蓝溶液)/mL V(蒸馏水)/mL 3.配制次甲基蓝标准溶液 用台称分别称取 2g、4g、6g、8g、11g 浓度为 0.3126×10 mol·dm 的标准次甲蓝溶液 于 100mL 容量瓶中,用蒸馏水稀释至刻度,待用。 4.原始溶液的稀释 为了准确测定原始溶液的浓度,在台称上称取浓度为 0.2%的原始溶液 2.5g 放入 500mL 容量瓶中,稀释至刻度。 5.平衡液处理 样品振荡 3h 后,取平衡溶液 5mL 放入离心管中,用离心机旋转 10min,得到澄清的上 层溶液。分别取 5g 澄清液放入 500mL 容量瓶中,并用蒸馏水稀释到刻度。 6.选择工作波长 用某一待用标准溶液,以蒸馏水为空白液,在 600nm~700nm 范围 内测量吸光度,以最 大吸收时的波长作为工作波长。 7.测量吸光度。 在工作波长下, 依次分别测定五个标准溶液的吸光度, 以及稀释以后的原始溶液及平衡 溶液的吸光度。 四、注意事项 1.标准溶液的浓度要准确配制,原始溶液及吸附平衡后溶液的浓度都应选择适当的范围, -3 -3 本实验原始溶液的浓度为 2g·dm 左右,平衡溶液的浓度不小于 1g·dm 。 2.活性炭颗粒要均匀,且五份称重应尽量接近。 3.振荡时间要充足,以达到吸附饱和,一般不应小于 3h。 五、数据处理 1.把数据填入下表 稀释后原始溶液的吸光度:1.332 标准溶液 A 平衡溶液 A 标准溶液称 取量 浓 度 /(mol/L) 2g 0.289 1 2.121 2.作 A—C 工作曲线。 2g 0.0626 4g 0.125 6g 0.188 8g 0.25 11g 0.344 4g 0.662 2 0.466 6g 1.257 3 0.137 8g 1.672 4 0.118 11g 1.999 5 0.044
溶液吸附法测定固体比表面积实验报告

实验目的:1.了解固体比表面积的测定方法;2.掌握溶液吸附法的原理和操作步骤;3.掌握实验数据的处理和结果分析方法。
实验原理:1.固体比表面积是指单位质量的固体样品所具有的表面积,通常用平方米/克来表示;2.溶液吸附法是利用气体或液体在样品表面上的吸附作用来测定固体比表面积的一种方法;3.溶液吸附法的基本原理是通过在较低温度下,用已知浓度的试剂溶液对固体样品进行吸附,然后通过测定吸附剂溶液中溶质的浓度变化,计算出固体比表面积。
实验仪器和药品:1.比表面积测定仪;2.甲醛溶液;3.乙二醇溶液。
实验步骤:1.将测定仪清洗干净,并将样品装入测定仪中;2.根据实验要求,选择合适的试剂溶液,并将溶液装入测定仪;3.在恒定温度下,将溶液加入测定仪中,并记录下溶质浓度变化的数据;4.根据实验数据,计算出固体比表面积。
实验数据处理与结果分析:1.将实验得到的数据进行整理和处理,获得准确的吸附剂溶液中溶质浓度变化曲线;2.根据吸附剂溶液中溶质浓度的变化,计算出固体的比表面积;3.对比不同样品的比表面积数据,进行结果分析和讨论。
结论:在本实验中,我们通过溶液吸附法成功地测定了固体样品的比表面积,并获取了准确的实验数据。
通过对比不同样品的比表面积数据,可以得出结论:溶液吸附法是一种简单、快捷、准确的测定固体比表面积的方法。
我们还发现不同样品的比表面积差异较大,说明样品的性质和制备方法对比表面积有较大的影响。
实验中存在的问题和改进方法:1.实验中部分数据出现了较大的误差,可能是由于实验操作不规范或仪器设备故障引起的。
在以后的实验中,应该加强对仪器设备的维护和保养,同时要注意在实验操作过程中要严格按照操作规程进行;2.在实验操作中,应该严格控制实验条件,确保溶液的浓度和温度等因素的稳定,从而获得更加准确可靠的实验数据。
实验的意义和应用价值:1.固体比表面积是一个重要的物理学特性参数,对于催化剂、吸附剂等材料的性能评价具有重要意义;2.溶液吸附法作为一种常用的测定固体比表面积的方法,具有操作简单、结果准确和易于控制实验条件等优点,因此具有较高的实用价值和广泛的应用前景。
实验4溶液吸附法测定固体比表面积

实验四溶液吸附法测定固体比表面一、实验目的1、了解溶液吸附法测定固体比表面的原理和方法。
2、用溶液吸附法测定活性炭(硅藻土、碱性层析氧化铝)的比表面。
3、掌握分光光度计工作原理及操作方法。
二、实验原理1、朗伯-比尔定律(光吸收原理)根据光吸收定律,当入射光为一定波长的单色光时,某溶液的吸光度与溶液中有色物质的浓度及溶液层的厚度成正比:A = lg(l0/I) =abc式中:A :吸光度;Io:入射光强度;I:透射光强度;a:摩尔吸收系数,与吸收物质的性质及入射光的波长入有关;b:液层厚度;c:溶液浓度。
一般来说光的吸收定律可适用于任何波长的单色光,但同一种溶液在不同波长所测得的吸光度不同,如果把吸光度A对波长入作图可得到溶液的吸收曲线,为了提高测量的灵敏度,工作波长一般选在A值最大处。
亚甲基蓝溶液在可见区有二个吸收峰:445nm和665nm,但在445nm处活性炭吸附对吸收峰有很大的干扰,固本实验选用的工作波长为665nm。
2、亚甲基蓝结构及吸附特征亚甲基蓝具有以下矩形平面结构:阳离子大小为17.0 >7.6 >3.25 X0-3O m3o亚甲基蓝的吸附有三种取向:平面吸附投影面积为135X10-20m2,侧面吸附投影面积为75X10-20m2,端基吸附投影面积为39X0-20m2。
对于非石墨型的活性炭,亚甲基蓝是以端基吸附取向,吸附在活性炭表面。
3、朗格缪尔(Langmuir)单吸附理论朗格缪尔吸附理论的基本假设是:固体表面是均匀的,吸附时单分子层吸附,吸附剂一旦被吸附质覆盖就不能再吸附,在吸附平衡时,吸附和脱附建立动态平衡;吸附平衡前,吸附速率与空白表面积成正比,解吸速率与覆盖度成正比。
水溶性染料的吸附已经应用于测定固体表面积比表面,在所有的染料中亚甲基蓝具有最大的吸附倾向。
研究表明,在一定浓度范围内,大多数固体对亚甲基蓝的吸附是单分子层吸附,符合朗格缪尔吸附理论。
但当原始溶液的浓度过高时,会出现多分子层吸附,而如果平衡浓度过低,吸附又不能达到饱和,因此原始溶液的浓度以及平衡后的浓度应选择在适当的范围。
固体从溶液中的吸附实验报告

固体从溶液中的吸附实验报告院(系)生化系年级 10级专业化工姓名学号课程名称物化实验实验日期 2012 年 11月 29 日实验地点 3栋指导老师一、实验目的:1·熟悉溶液吸附法测定固体比表面的原理和实验方法。
2•测定活性炭的比表面。
二、实验原理:吸附能力的大小常用吸附量Γ表示之。
Γ通常指每克吸附剂上吸附溶质的物质的量。
吸附量Γ的大小与吸附平衡时溶质的浓度C有关,常用的关联式有两个:(1)Freundlich经验公式:式中,x 表示吸附溶质的物质的量(mol);m 表示吸附剂的质量(g);c 表示吸附平衡时溶液的浓度(mol/L);k,n表示经验常数,由温度、溶剂、吸附质与吸附剂的性质决定。
以lg Γ对lgc 作图可得一直线,由直线的斜率和截距可求得n 和k。
(2)Langmuir吸附方程:式中,Γ∞表示饱和吸附量;C 表示吸附平衡时溶液的浓度;K 为常数.用c/Γ对c 作图得一直线,由此直线的斜率和截距可求得Γ∞,并进一步计算出吸附剂的比表面积S 0S 0(m 2/g)=三、实验准备:1.仪器:电动振荡器、分析天平、碱式滴定管、带塞锥形瓶(5个)、移液管、锥形瓶2:药品:活性炭;HAC(0.4mol ·ml -3);NaOH (0.1mol ·ml -3);酚酞指示剂。
四、实验步骤: 1.3.4. 五、注意事项1.溶液的浓度配制要准确,活性炭颗粒要均匀并干燥2. 醋酸是一种有机弱酸,其离解常数Ka = 1.76×10-5 ,可用标准碱溶液直接滴定,化学计量点时反应产物是NaAc ,是一种强碱弱酸盐,其溶液pH 在8.7 左右,酚酞的颜色变化范围是8-10,滴定终点时溶液的pH 正处于其内,因此采用酚酞做指示剂,而不用甲基橙和甲基红。
直到加入半滴NaOH 标准溶液使试液呈现微红色,并保持半分钟内不褪色即为终点。
3.变红的溶液在空气中放置后,因吸收了空气中的CO2,又变为无色。
比表面积测定

Determination of Specific Surface —Solution Adsorption实验原理比表面(1克固体物质所具有的总面积)是粉末多孔性物质的一个重要特征参数,它在催化、色谱、环保、纺织等许多生产和科研部门有着广泛的应用。
本实验是利用亚甲基蓝染料水溶液吸附法测定微球硅胶的比表面,因为亚甲基蓝在所知的染料中具有最大的吸附倾向,可被大多数固体物质所吸附,在一定的条件下为单分子层吸附,即符合朗格谬尔吸附等温式。
根据单分子层次吸附理论,当吸附达到饱和时,吸附质分子铺满整个吸附表面而不留空位,此时1克吸附剂吸附吸附质分子所占的表面积,等于所吸附吸附质的分子数与每个分子在表面层所占面积的乘积。
式中:S :比表面cm 2/g A :亚甲基蓝分子平均截面积81.3×10-16cm 2M :亚甲基蓝的摩尔质量373.9 N A :阿佛加德罗常数W :硅胶的重量(克) ΔW :硅胶饱和吸附时亚甲基蓝的重量(克)本实验的关键是测定ΔW ,所测试样的ΔW 不能太小(即比表面不能太小),否则误差较大,也就是说本方法测定比表面较大的试样所得结果较为满意。
亚甲基蓝水溶液在可见光区有两个吸收峰(445纳米和665纳米)。
用722型分光光度计测定吸附前后溶液吸光度变化,按右式计算: 式中:C 0:吸附前溶液的浓度(mg/ml ) C :吸附达单层饱和后溶液浓度(mg/ml )V :溶液的体积(ml ) 10-3:毫克(mg )转化为克(g )的系数仪器和试剂722型分光光度计 1台 康氏振荡机 1台容量瓶100mL 8个 碘量瓶100mL 1只吸耳球 1个 移液管50mL 、25mL 各1支刻度吸管10mL 1支 亚甲基蓝贮备液(500×10-3mg/ml )微球硅胶实验步骤1、比表面的测定1)配制亚甲基蓝浓度为50×10-3mg/ml 溶液准确分配浓度为500×10-3mg/ml 亚甲基蓝贮备液10ml 加到100ml 容量瓶中,用水稀释至刻度,摇匀。
物理化学 溶液吸附法测定固体物质的比表面
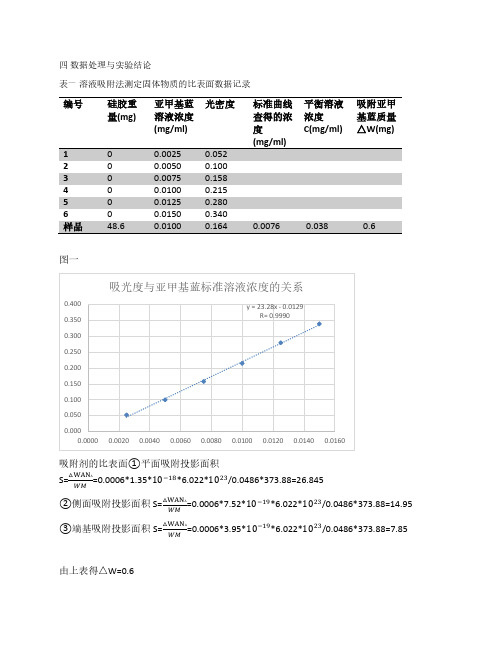
四 数据处理与实验结论表一 溶液吸附法测定固体物质的比表面数据记录编号硅胶重量(mg)亚甲基蓝溶液浓度(mg/ml) 光密度标准曲线查得的浓度平衡溶液浓度C(mg/ml) 吸附亚甲基蓝质量△W(mg) 2 0 0.0050 0.100 3 0 0.0075 0.158 4 0 0.0100 0.215 5 00.0125 0.280 图一吸附剂的比表面①平面吸附投影面积S=△WAN AWM=0.0006*1.35*10−18*6.022*1023/0.0486*373.88=26.845②侧面吸附投影面积 S=△WAN AWM =0.0006*7.52*10−19*6.022*1023/0.0486*373.88=14.95 ③端基吸附投影面积S=△WAN AWM=0.0006*3.95*10−19*6.022*1023/0.0486*373.88=7.85由上表得△W=0.6五.实验讨论实验中测定吸光度与标准溶液的浓度的关系时得到吸光度与浓度的标准工作曲线y = 23.28x - 0.0129 R= 0.9990≈1 所以曲线拟合性较好。
六.思考题1公式(9-1)的应用要求的条件?测量比表面较大的试样所得的结果较为满意2产生实验结果的偏差荡后吸取清液时为什么不能吸取上硅胶?实验要测量的是硅胶吸附后的甲基蓝溶液的浓度,吸上硅胶可能会导致硅胶中的甲基蓝重新析出,影响光密度和实验结果。
3比表面的测定与温度,吸附质的浓度,吸附平衡的时间有什么关系?温度高时吸附量低,反而吸附量高,吸附质的浓度至少要能满足吸附剂达到饱和吸附时所需的浓度但溶液不能太浓,否则会出现多层吸附震荡要达到饱和吸附时所需时间,吸附剂颗粒大小不要相差太大。
4亚甲基蓝吸附投影面积A对测定比表面有什么影响?如何测定?S=△WAN A亚甲基蓝吸附吸附于吸附剂上有三种取向,平面吸附投影侧面吸附投影端基吸附WM投影。
不同投影方式有不同的面积,从而影响比表面。
溶液吸附法测固体比表面积

溶液吸附法测固体比表面积实验报告溶液吸附法测固体比表面积一、实验目的:1.用次甲基蓝水溶液吸附法测定颗粒活性炭的比表面积。
2.了解朗缪尔单分子层吸附理论及用溶液法测定比表面的基本原理。
二、实验原理见预习报告三.仪器和试剂:1、仪器722型光电分光光度计及其附件1台;康氏振荡器1台;容量瓶(500mL)6个;容量瓶(50mL,100mL)各5个;2号砂心漏斗1只,带塞锥形瓶(100mL)5个;滴管若干;移液管若干。
2、试剂次甲基蓝(质量分数分别为0.2%和0.1%的原始溶液和标准溶液);颗粒状非石墨型活性炭。
四、实验步骤:1.样品活化:将颗粒活性炭置于瓷坩埚中,放入500℃马弗炉中活化1h,然后置于干燥器中备用。
试验中用到的活性炭为颗粒状,已经由老师制备好,此步骤略去。
2.平衡溶液:取5个洁净干燥的100mL带塞锥形瓶,编号,分别准确称取活性炭约0.1g 置于瓶中,记录活性炭的用量。
按下表中的数据配制不同浓度的次甲基蓝溶液,然后塞上磨口瓶塞,放置在振荡器上振荡适当时间,振荡速率以活性炭可翻动为(实验所用振荡器100r左右为宜)吸附样品编号 1 2 3 4 5V(w0.2%次甲基蓝溶液)/mL 30 20 15 10 5 V(蒸馏水)/mL 20 30 25 40 45 样品振荡达到平衡后,将锥形瓶取下,用玻璃漏斗(塞上棉花)过滤,得到吸附平衡后溶液。
分别量取滤液1g,放入500mL容量瓶中,并用蒸馏水稀释至刻度,待用。
3.原始溶液为了准确称取质量分数约为0.2%的次甲基蓝原始溶液(此浓度为一近似值,故需进一步测量),称取1g溶液放入500mL容量瓶中,并用蒸馏水稀释至刻度,待用。
4.次甲基蓝标准溶液的配制用移液管吸取0.5mL,1mL,1.5mL,2mL,2.5mL质量分数0.01%标准次甲基蓝溶液于100mL容量瓶中。
用蒸馏水稀释至刻度,即得2×10-6、4×10-6、6×10-6、8×10-6、10×10-6的标准溶液,待用。
溶液吸附法测量固体物质的比表面积(详细参考)

实验十 溶液吸附法测量固体物质的比表面积一、实验目的:1.了解溶液吸附法测定固体比表面的原理和方法。
2.用溶液吸附法测定活性炭的比表面。
3.掌握分光光度计工作原理及操作方法。
二、实验原理:本实验采用溶液吸附法测定固体物质的比表面。
在一定温度下,固体在某些溶液中吸附溶质的情况可用Langmuir 单分子层吸附方程来处理。
其方程为KcKcm+Γ=Γ1式中:Γ为平衡吸附量,单位质量吸附剂达吸附平衡时,吸附溶质的物质的量(mol ·g-1);Γm 为饱和吸附量,单位质量吸附剂的表面上吸满一层吸附质分子时所能吸附的最大量(mol ·g-1);c 为达到吸附平衡时,吸附质在溶液本体中的平衡浓度(mol ·dm-3);K 为经验常数,与溶质(吸附质)、吸附剂性质有关。
吸附剂比表面S 比 : S 比 =ΓmLA式中:L 是阿伏加德罗常数;A 是每个吸附质分子在吸附剂表面占据的面积。
配制不同吸附质浓度c0的样品溶液,测量达吸附平衡后吸附质的浓度c ,用下式计算各份样品中吸附剂的吸附量mVc c )(0-=Γ 式中:c0是吸附前吸附质浓度(mol ·dm-3);c 是达吸附平衡时吸附质浓度(mol ·dm-3);V 是溶液体积(dm3);m 是吸附剂质量(g )。
Langmuir 方程可写成Kc cm m Γ+Γ=Γ11 根据改写的Langmuir 单分子层吸附方程,作Γc~c 图,为直线,由直线斜率可求得Γm甲基兰的摩尔质量为373.9g ·mol -1。
假设吸附质分子在表面是直立的,A 值取为1.52×10-18m 2。
三、实验步骤:1.样品活化2.溶液吸附取5只洗净的干燥的带塞锥形瓶编号,分别用分析天平准确称取活化过的活性炭0.1g ,至于瓶中,分别配置五种浓度的次甲基蓝50ml ,振荡4-6h ,分别移取滤液2ml 放入250ml 容量瓶中,并定容,待用; 3.原始溶液处理4.次甲基蓝标准溶液的配制用移液管分别移取0.4、0.6、0.6、1.0、1.2、1.4ml 的0.3126×10-3mol/L 标准次甲基蓝溶液于100ml 容量瓶中,用蒸馏水稀释至刻度,待用; 5.工作波长的选择:665nm 6.测量吸光度四、数据记录及处理:1.实验基础数据2.作A-CA3.求次甲基蓝原始溶液的浓度和平衡溶液的浓度 C 将实验测定的稀释后原始溶液的吸光度,从 A —C 工作曲线上查得对应的浓度,然后乘以稀释倍数 100,即为原始溶液的浓度;计算得:0.0019 mol/L 将实验测定的各个稀释后的平衡溶液吸光度,从 A —C 工作曲线上查得对应的浓度,然 4.计算吸附溶液的初始浓度 C 05.计算吸附量由平衡浓度 C 及初始浓度 C 0数据,由Γ=(C-C 0)V/m6.作朗缪尔吸附等温线:以Γ 为纵坐标,C 为横坐标0.0400.0420.0440.0460.0480.0500.0520.0540.0560.0580.060吸附量ΓC/(mol/L)7.求饱和吸附量作C/Γ-C 图,由图求得饱和吸附量Γ∞。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液吸附法测量固体物质的比表面
一、实验目的
1、了解溶液吸附法测量固体物质的比表面的原理方法;
2、用溶液吸
附法测定活性炭的比表面;3、掌握分光光度计的原理及使用方法。
二、
实验原理
1、平衡吸附量T、吸附剂比表面S的关系
固体在某些溶液中吸附溶质的情况与固体对气体的吸附很相似,可用Langmuir方程来处理:T=Tm某Kc/(1+Kc)
T为平衡吸附量mol/g,Tm为饱和吸附量mol/g,c为平衡浓度mol/l,K为经验常数。
S=Tm某L某A
S为吸附剂比表面,L为阿伏伽德罗常数,A为每一个吸附质分子在
吸附剂表面占据的面积。
c/T=c/Tm+1/(Tm某K)
根据实验数据,做出c/T-c的图像,直线斜率可求出Tm。
综上计算
可得,T=(c0-c)V/m,式中c0为吸附前吸附质的浓度,c为平衡时吸附
质的浓度,V为溶液体积,m为吸附质量。
2、比表面积物理意义是通常称
1g固体所占有的总表面积为该物质的比表面积S。
一般比表面积大、活性
大的多孔物,吸附能力强。
活
性炭具有很强的吸附能力原因活性炭是用木材、煤、果壳等含碳物质
在高温缺氧条件下活化制成,它具有巨大的比表面积(500-1700m2/g)。
活性炭结在结构上有两大特点:一是内部与表面孔隙发达。
二是比表面积大。
孔隙结构越发达比表面积越大,其吸附功能越强。
2、分光光度计的使用开机预热30min。
调整波长665nm。
准备空白溶液、标准溶液、待测溶液分别装入同一规格的比色皿中,
放于比色皿架内。
调整模式为\透射比\。
空白溶液置于测量位置,开仓门保证示数为0%,关闭仓门保证示数
为100%,若不是,则手动调整。
重复数次。
调整模式为\吸光度\。
标准液、待测液分别置于测量位置,读取吸光度。
调整模式为“浓度直读”,标准液置于测量位置,调整示数为其浓度
值或其浓度值的10n倍。
再次按下“模式键”,现实仍为“浓度直读”,测量待测液浓度。
三、仪器与试剂
分光度光度计722型、恒温振荡器、锥形瓶(磨口100ml)、容量瓶(100ml,50ml)、移液管(10ml刻度、20ml、25ml)、活性炭、滴管、
亚甲基蓝水溶液(10-3mol/l)。
四、操作步骤
(1)、用0.0001g精度的天平称取100.0mg左右活性炭6份,分别
放入6只洗干净干燥的100ml磨口锥形瓶中,用移液管在锥形瓶中分别加
入亚甲基蓝水溶液及去离子水。
将六只锥形瓶瓶塞盖好,放在恒温振荡器中振荡1-3天,直至达到吸附平衡。
(2)配制标准溶液:1某10-5mol/l 的亚甲基蓝水溶液。
(3)吸附平衡后用分光光度计在665nm分别测其浓度。
若浓度过大(吸光度>0.8)用去离子水稀释一定倍数后测定。
(4)实验完毕后清洗比色皿:先用酸洗,后用自来水洗,再用去离子水洗。
五、数据记录与处理
1103.2
21012525505.00E-0
44.15E-062.45E-04
3103.73020506.00E-041.39E-052.83E-04
4100.73515507.00E-043.74E-053.29E-04
5101.14010508.00E-044.89E-053.71E-04
6102.1500501.00E-031.19E-044.31E-04
亚甲基蓝水溶液(ml)20去离子水水溶液(ml)30溶液体积(ml)吸附前浓度(mol/l)吸附平衡后浓度(mol/l)吸附量T(mol/g)504.00E-043.88E-061.92E-04
1、室温;26.8℃
2、利用originl作出c/T-c的图像如下:
0.35BLinearFitofB0.300.250.20B0.150.100.050.00-
0.000010.000000.000010.000020.000030.000040.000050.000060.000070
.000080.000090.000100.000110.000120.00013A
从图中可以读出斜率为2229.53651g/mol,即可计算得到饱和吸
附量Tm=4.49某10-4mol/g。
3、计算活性炭的比表面积为:
S=Tm某L某A=4.49某10-4mol/g某6.022某10^23mol-1某1.52某
10-18m2=411.0m2/g。
六、思考题
1、如何确定吸附质浓度c是已达吸附平衡的浓度?
答:在一定时间间隔里测定相同体积的吸附质溶液质量,若是质量不
再变化则说明已达到吸附平衡状态。
2、本实验中,溶液浓度太浓时,为什么要稀释后再测量?答:本实
验利用分光光度计来测溶液的浓度,其中测定浓度是通过测定溶液对
665nm光的吸光度来间接测定的。
当物质可吸收的单色光通过溶液时,光
强度就会因被吸收而减弱,其减弱程度与浓度相关。
吸光度A=KcL,其中,K为比例常数,L为溶液层厚度,c为溶液
浓度。
可见当波长长度确定,溶液池厚度确定是,A与C成线性关系。
若溶液浓度过大,则A的测量误差会较大,线性关系不良好,影响对浓度
的测定。
七、实验讨论及注意事项注意事项
(1)测定溶液吸光度时,须用滤纸轻轻擦干比色皿外部,以保持比色
皿暗箱内干燥。
(2)测定原始溶液和平衡溶液的吸光度时,应注意没有活性炭颗粒在
比色皿内。
(3)活性炭颗粒要均匀,且三份称重应尽量接近。
(4)测定吸光度时要按从稀到浓的顺序,每个溶液应该测定3到4次,求其平均值。
误差分析:
(1)就操作过程而言,本实验需要多次量取溶液,称量质量,配制
特定浓度的溶液、稀释溶液,在此过程中的偶然误差不可避免,对实验结
果有一定影响。
(2)比色皿的规格对于实验会有影响。
在操作过程中,空白溶液与标准液长期放于分光光度计中,其温度势
必会稍有上升,高于待测液温度。
这对实验结果也有一定影响。
(3)本
次实验,我们近似认为活性炭吸附溶质的情况可以使Langmuir单分子层
吸附方程来处理。
但是,实际吸附过程不可避免的存在多层吸附问题。
这
对实验结果有着一定影响。
(4)活性炭具有吸湿性,在称量过程中可能对质量稍有影响。
