初中化学用语(全)
九年级化学用语大全(1至8单元)

九年级化学用语大全(1至8单元)一、元素符号氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne 钠Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W二、化学式氧气 O2 氢气 H2 氮气 N2 氟气 F2 氯气 Cl2 氦气 He 氖气 Ne 氩气 Ar 溴 Br2 碘 I2 臭氧 O3 碳 C 硫 S 磷 P 硅 Si 碳60 C60 铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银Hg 钠 Na 水 H2O 过氧化氢 H2O2 二氧化碳 CO2 一氧化碳 CO 二氧化氮 NO2 一氧化二氮 N2O 一氧化氮 NO 二氧化硅 SiO2 五氧化二磷 P2O5 二氧化硫 SO2 三氧化硫 SO3 二氧化氯 ClO2 氧化钠 Na2O 氧化镁 MgO 氧化铝 Al2O3 氧化钾 K2O 氧化钙 CaO 二氧化锰 MnO2 四氧化三铁 Fe3O4 氧化铁 Fe2O3 氧化亚铁 FeO 氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO 盐酸 HCl 硫酸H2SO4 硝酸 HNO3 碳酸 H2CO3 磷酸 H3PO4 氨气 NH3 氨水NH3H2O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2 氢氧化钡 Ba(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜Cu(OH)2 乙酸 CH3COOH 甲烷 CH4 乙醇 C2H5OH 葡萄糖 C6H12O6 淀粉 (C6H10O5)n 蔗糖 C12H22O11 氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl2 氯化钙 CaCl2 氯化镁 MgCl2 氯化铝 AlCl3 氯化锌ZnCl2 氯化铁 FeCl3 氯化亚铁 FeCl2 氯化铜 CuCl2 氯化银AgCl 硫酸钾 K2SO4 硫酸钠 Na2SO4 硫酸钡 BaSO4 硫酸钙 CaSO4 硫酸镁 MgSO4 硫酸铝 Al2(SO4)3 硫酸锌 ZnSO4 硫酸铁Fe2(SO4)3 硫酸亚铁 FeSO4 硫酸铜 CuSO4 硫酸银 Ag2SO4 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸钙 Ca(NO3)2 硝酸钡 Ba(NO3)2 硝酸镁 Mg(NO3)2 硝酸铝 Al(NO3)3 硝酸锌 Zn(NO3)2 硝酸铁Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铜 Cu(NO3)2 硝酸银 AgNO3 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钾 K2CO3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸钡 BaCO3 碳酸镁 MgCO3 碳酸锌ZnCO3 碳酸亚铁 FeCO3 碳酸银 Ag2CO3 氯化铵 NH4Cl 硝酸铵NH4NO3 硫酸铵 (NH4)2SO4 碳酸氢铵 NH4HCO3 碳酸铵 (NH4)2CO3 磷酸钙 Ca3(PO4)2三、常见的离子符号氧离子 O2- 氟离子 F- 硫离子 S2- 氯离子 Cl- 钠离子 Na+ 镁离子 Mg2+ 铝离子 Al3+ 钾离子 K+ 钙离子 Ca2+ 氢离子 H+ 锂离子 Li+ 铍离子 Be2+ 铁离子 Fe3+ 亚铁离子 Fe2+ 铜离子 Cu2+ MnO4-ClO3-NO3-锌离子 Zn2+ 银离子Ag+ 钡离子 Ba2+ 碘离子 I- 溴离子 Br- HCO3-MnO42-SO42-CO32-氢氧根离子 OH- 硝酸根离子氯酸根离子高锰酸根离子NH4+PO43-SO32-碳酸氢根离子硫酸根离子碳酸根离子锰酸根离子亚硫酸根离子磷酸根离子铵根离子4P+5O22P2O5 点燃四、化学方程式S+ O2 SO2点燃1、红磷在氧气中燃烧3Fe+2O2 Fe3O4点燃2、硫在氧气中燃烧2KMnO4 K2MnO4+MnO2 + O2↑ △3、铁丝在氧气中燃烧4、加热高锰酸钾2H2O22H2O+ O2↑ MnO22KClO32KCl+3O2↑ MnO2△5、过氧化氢溶液与二氧化锰混合2Hg + O22HgO2HgO2Hg +O2↑△△6、加热氯酸钾与二氧化锰的混合物7、在氧气中加热汞H2 + Cl22HCl点燃8、氧化汞受热分解9、氢气在氯气中燃烧2H2+ O22H2O点燃2H2O2H2↑+ O2↑ 通电10、氢气在氧气中燃烧2Mg+ O22MgO点燃11、电解水4Al+3O22Al2O3点燃12、镁条在氧气中燃烧2Cu + O22CuO△13、铝箔在氧气中燃烧H2 + CuO Cu+H2O△14、铜在空气中加热C+ O2 CO2点燃15、氢气还原氧化铜2C+ O22CO点燃16、木炭在氧气中完全燃烧C +2CuO2Cu+ CO2↑ 高温17、木炭在氧气中不完全燃烧3C +2Fe2O34Fe+3CO2↑ 高温18、碳还原氧化铜C + CO22CO 高温19、碳还原氧化铁C + H2O CO + H2 高温20、碳还原二氧化碳21、碳还原水蒸气CaCO3+2HCl CaCl2+CO2↑+H2O H2CO3CO2↑+ H2O22、实验室制取二氧化碳CaCO3 CaO + CO2↑ 高温23、碳酸分解CO2 + H2O H2CO324、工业上制备二氧化碳25、二氧化碳与水反应2CO+ O22CO2点燃CO2 + Ca(OH)2 CaCO3↓+ H2O26、检验二氧化碳的反应27、一氧化碳燃烧4CO + Fe3O43Fe +4CO2 高温CO + CuO Cu + CO2 △28、一氧化碳还原氧化铜29、一氧化碳还原四氧化三铁 CaO + H2O Ca(OH)2Na2CO3+2HCl2NaCl+ CO2↑+H2O30、灭火器的反应原理 CH4+2O2 CO2 +2H2O点燃31、氧化钙与水反应 C2H5OH +3O22CO2 +3H2O点燃32、甲烷燃烧33、乙醇(酒精)燃烧Zn + H2SO4 ZnSO4 + H2↑34、实验室制取氢气4Al +3O22Al2O335、铝常温下氧化Mg +2HCl MgCl2 + H2↑36、镁与盐酸反应2Al +6HCl2AlCl3 +3H2↑Zn +2HCl ZnCl2 + H2↑37、铝与盐酸反应Fe +2HCl FeCl2 + H2↑38、锌与盐酸反应Mg + H2SO4 MgSO4 + H2↑39、铁与盐酸反应40、镁与稀硫酸反应2Al +3H2SO4 Al2(SO4)3 +3H2↑41、铝与稀硫酸反应Fe + H2SO4 FeSO4 + H2↑42、铁与稀硫酸反应 Fe + CuSO4 Cu + FeSO443、铁与硫酸铜溶液反应 Zn + CuSO4 Cu + ZnSO444、锌与硫酸铜溶液反应2Al +3CuSO43Cu + Al2(SO4)345、铝与硫酸铜溶液反应 Cu +2AgNO32Ag + Cu(NO3)246、铜与硝酸银溶液反应 Al +3AgNO33Ag + Al(NO3)347、铝与硝酸银溶液反应 Fe +2AgNO32Ag + Fe(NO3)248、铁与硝酸银溶液反应3CO + Fe2O32Fe +3CO2 高温Zn +2AgNO32Ag + Zn(NO3)249、锌与硝酸银溶液反应50、工业上炼铁的反应原理。
初中化学用语总结

初中化学用语总结
固体的颜色
红色固体:铜,氧化铁
绿色固体:碱式碳酸铜
蓝色固体:氢氧化铜,硫酸铜晶体
无色固体:干冰,金刚石
黑色固体:铁,木炭,氧化铜,二氧化锰,四氧化三铁
紫黑色固体:高锰酸钾
银白色固体:银,镁,铝,汞
红褐色固体:氢氧化铁
白色固体:氯化钠,碳酸铜,氢氧化钠,氢氧化钙,氧化钙氧化镁,五氧化二磷气体颜色
无色气体:氧气,氮气,氢气,一氧化碳,二氧化碳,二氧化硫
红棕色气体:二氧化碳
黄绿色气体:氯气
液体颜色
无色液体:水,双氧水
蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
紫红色溶液:高锰酸钾溶液
紫色溶液:石蕊溶液
1、元素符号的意义。
2、离子符号的意义:
3、化学式的意义。
4. 化学方程式的意义。
5、原子、离子结构示意图的意义;6. 化学符号周围数字与符号的意义。
读记 初中化学基础知识汇总化学用语
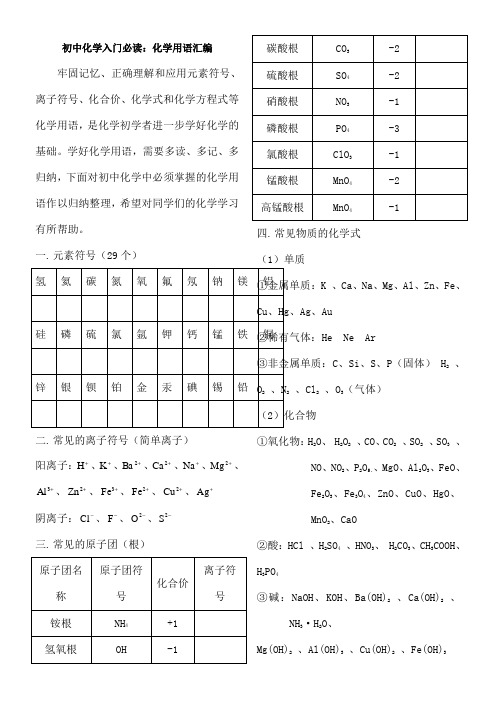
初中化学入门必读:化学用语汇编牢固记忆、正确理解和应用元素符号、离子符号、化合价、化学式和化学方程式等化学用语,是化学初学者进一步学好化学的基础。
学好化学用语,需要多读、多记、多归纳,下面对初中化学中必须掌握的化学用语作以归纳整理,希望对同学们的化学学习有所帮助。
一. 元素符号(29个)二. 常见的离子符号(简单离子)阳离子:+H 、+K 、+2Ba 、+2Ca 、+Na 、+2Mg 、+3Al 、+2Zn 、+3Fe 、+2Fe 、+2Cu 、+Ag阴离子:-Cl 、-F 、-2O 、-2S 三. 常见的原子团(根) 四. 常见物质的化学式 (1)单质K 、Ca 、Na 、Mg 、Al 、Zn 、Fe 、、Ag 、Au He Ne Ar C 、Si 、S 、P (固体) H 2 、2 、Cl 2 、O 3(气体) ①氧化物:H 2O 、 H 2O 2 、CO 、CO 2 、SO 2 、SO3 、NO 、NO 2、P 2O 5、、MgO 、Al 2O 3、FeO 、Fe 2O 3、Fe 3O 4、ZnO 、CuO 、HgO 、MnO 2、CaO②酸:HCl 、H 2SO 4 、HNO 3、 H 2CO 3、CH 3COOH 、H 3PO 4③碱:NaOH 、KOH 、Ba(OH)2 、Ca(OH)2 、NH 3·H 2O 、Mg(OH)2 、Al(OH)3 、Cu(OH)2 、Fe(OH)3④盐:NaCl 、KCl、CaCl2、BaCl2、MgCl2、ZnCl2、AgCl 、FeCl3、FeCl2、CuCl2、NH4Cl 、Na2SO4、K2SO4CaSO4、MgSO4、CuSO4、BaSO4、FeSO4、Fe2(SO4)3、ZnSO4、CaSO4、(NH4)2SO4、NaNO3、KNO3、Ba(NO3)2、Ca(NO3)2、Cu(NO3)2、AgNO3、Hg(NO3)2、NH4NO3、NaNO2、 CaCO3、Na2CO3、NaHCO3、BaCO3、NH4HCO3、Cu2(OH)2CO3、KClO3、KMnO4、K2MnO4、NH4H2PO4、(NH4)2HPO4、KH2PO4、K2HPO4⑤其它:CH4、NH3、C2H5COH 、CH3COOH 、C 6H12O6、CO(NH2)2五. 化学方程式1.分解反应2H2O22MnO2H2O+O2↑2KMnO4△K2MnO4+MnO2+O2↑2KClO32KCl+3O2↑2H2O通电2H2O+O2↑2HgO△2Hg+O2↑H 2CO3= H2O+CO2↑NH3·H2O = H2O + NH3↑Cu2(OH)2CO3△2CuO+ H2O +CO2↑2.化合反应C + O2点燃CO2S + O2点燃SO24P +5O2点燃 2P2O52H2 + O2点燃2H2O2Mg+O2点燃2MgO2Al+3O2 = Al2O33Fe + 2O2点燃Fe3O42Cu +O2△2CuO2Hg+O2△2HgO2CO+O2点燃2CO2C+CO2高温2COH2+Cl2点燃2HCl2Na+Cl2点燃2NaClCO2+H2O = H2CO3CaO+ H2O = Ca(OH)2NH3+H2O = NH3·H2OCuSO4+5H2O= CuSO4·5H2O3.置换反应(1)氢气或碳粉还原某些金属氧化物H2+CuO△Cu + H2O3H2+Fe2O3△2Fe + 3H2O4H2+Fe3O4△3Fe + 4H2O6H2+WO3△W+3H2OC+2CuO高温2Cu + CO2↑3C+2Fe2O3高温4Fe+3CO2↑2C+Fe3O4高温3Fe+2CO2↑(2)金属单质与酸的反应Mg+2HCl = MgCl2+ H2↑Zn+2HCl = ZnCl2+ H2↑Fe+ 2HCl = FeCl2+H2↑Mg + H2SO4=MgSO4+ H2↑Zn + H2SO4= ZnSO4+ H2↑Fe + H2SO4= FeSO4+ H2↑(3)金属单质与盐溶液的反应Fe + CuSO4= Cu + FeSO42Al +3CuSO4=3 Cu + Al2(SO4)3Cu + 2AgNO3=2Ag + Cu(NO3)2Cu + Hg(NO3)2= Hg + Cu(NO3)24.复分解反应(1)酸与金属氧化物6HCl + Fe2O3=2 FeCl3+ 3H2O3H2SO4+ Fe2O3= Fe2(SO4)3+3 H2OH2SO4+ CuO = CuSO4+ H2O2HNO3+ CaO = Ca(NO3)2+ H2O(2)酸与碱(中和反应)HCl + NaOH = NaCl + H2O2HCl + Ca(OH)2= CaCl2+ H2O2HCl + Mg(OH)2= MgCl2+ 2H2O3HCl + Al(OH)3= AlCl3+3H2OH2SO4+ 2NaOH = Na2SO4+ 2H2OH2SO4+ Ba(OH )2= BaSO4↓+ 2H2O3H2SO4+ 2Fe(OH)3= Fe2(SO4)3+ 3H2OH2SO4+ Cu(OH)2= CuSO4+ 2H2O(3)酸与盐2HCl+CaCO3= CaCl2+ H2O +CO2↑2HCl+Na2CO3= 2NaCl + H2O + CO2↑HCl+NaHCO 3 = NaCl+ H 2O + CO 2↑ HCl+AgNO 3 = AgCl↓+ HNO 3 H 2SO 4+Na 2CO 3 = Na 2SO 4+ H 2O + CO 2↑ H 2SO 4+BaCl 2 = BaSO 4↓ + 2HCl H 2SO 4+Ba(NO 3)2 = BaSO 4↓ + 2HNO 3 2HNO 3+Na 2CO 3 = 2NaNO 3 + H 2O +CO 2↑ 2HNO 3+ CaCO 3 = Ca(NO 3)2 + H 2O +CO 2↑ 2HNO 3 + BaCO 3 = Ba(NO 3)2 + H 2O +CO 2↑ (4)碱与盐3NaOH + FeCl 3 = Fe(OH)3↓ + 3NaCl 2NaOH+CuSO 4 = Cu(OH)2↓+ Na 2SO 4 Ba(OH)2+MgSO 4 = Mg(OH)2↓+ BaSO 4↓ Ca(OH)2+Na 2CO 3 = CaCO 3↓ + 2NaOH Ca(OH)2+2NH 4Cl = CaCl 2 + H 2O +NH 3↑ (5)盐与盐NaCl+ AgNO 3 = AgCl ↓+ NaNO 3 Na 2SO 4 + BaCl 2 = BaSO 4↓+2NaClNa 2SO 4 + Ba(NO 3)2 = BaSO 4↓+ 2NaNO 3 CaCl 2+Na 2CO 3 = CaCO 3↓+ 2NaCl BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaCl 5.其他3CO + Fe 2O 3高温2Fe + 3CO 2 4CO + Fe 3O 4高温3Fe + 4CO 2 CH 4 + 2O 2 点燃 CO 2 + 2H 2O C 2H 5COH + 3O 2点燃 2CO 2 + 3H 2O CO 2+Ca(OH)2 = CaCO 3↓+ H 2OCO 2+NaOH = Na 2CO 3 + H 2O SO 2+2NaOH = Na 2SO 3 + H 2O SO 3+2NaOH = Na 2SO 4 + H 2O 附:C+H 2O (气)高温H 2+CO (制水煤气) 2Al+Fe 2O 3高温2Fe+Al 2O 3(铝热反应) Cl 2+H 2O =HCl+HClO (自来水通氯气消毒)2CO+2NO 催化剂2CO 2+N 2(汽车尾气处理)C 6O 12O 6+6O 2 = 6CO 2 + 6H 2O (葡萄糖氧化)CO 2 + H 2O → C 6O 12O 6+O 2(光合作用)。
初中化学用语汇编

初中化学化学方程式汇编一、化合反应[“多变一”如: A+B=AB]1.与氧气反应磷与氧气______________________________ 硫与氧气___________________________________铝与氧气______________________________ 铁与氧气___________________________________碳与氧气(完全反应)_________________ 碳与氧气(不完全反应)_______________________ 氢气与氧气____________________________ 镁与氧气___________________________________铜与氧气________________________ 一氧化碳与氧气_____________________________2.与水反应氧化钙与水__________________________ 水与二氧化碳____________________________3.碳与二氧化碳________________________二、分解反应[“一变多”如:AB=A+B]1生成氧气过氧化氢与二氧化锰______________________ 电解水_____________________________________加热高锰酸钾_____________________________ 氯酸钾与二氧化锰________________________2.生成二氧化碳高温分解碳酸钙_____________________________ 碳酸分解___________________________________干粉灭火器的原理二、置换反应[“一换一” A+BC=B+AC](1)碳、氢气的还原性氢气与氧化铜________________________ 碳与氧化铁 ______________________________碳与氧化铜 ________________________ 氢气与氧化铁______________________________(2)(活泼)金属 + 酸→盐 + 氢气锌与盐酸______________________________ 锌与硫酸__________________________________镁与盐酸______________________________ 镁与硫酸__________________________________铁与盐酸______________________________ 铁与硫酸__________________________________铝与盐酸______________________________ 铝与硫酸__________________________________(2)金属 + 盐(溶液)→另一种金属 + 另一种盐(前金换后金)铁与硫酸铜______________________________ 铜与硝酸银________________________________三、复分解反应[“双交换、价不变” AB+CD=AD+CB](1)酸 + 碱→盐 + 水(中和反应)氢氧化钠与盐酸________________________ 氢氧化钙与盐酸____________________________氢氧化钙与硫酸____________________________ 氢氧化铝与盐酸________________________(2)酸 + 盐→新酸 + 新盐碳酸钙与盐酸________________________ 碳酸氢钠与盐酸____________________________碳酸钠与盐酸________________________ 硫酸与氯化钡______________________________盐酸与硝酸银________________________(3)碱(溶) + 盐(溶)→新碱 + 新盐碳酸钠与氢氧化钙________________________ 氢氧化钠与硫酸铜__________________________(4)盐1(溶) + 盐2(溶)→两种新盐氯化钙与碳酸钠________________________ 硝酸钡与碳酸钠____________________________氯化钠与硝酸银________________________ 硫酸钠与氯化钡____________________________(5)金属氧化物 + 酸→盐 + 水氧化铁与盐酸______________________________ 氧化铜与硫酸______________________________四、其他(1)非金属氧化物 + 碱(溶)→盐 + 水二氧化碳与氢氧化钙________________________ 二氧化碳与氢氧化钠________________________二氧化硫与氢氧化钠________________________ 三氧化硫与氢氧化钠__(2)一氧化碳与氧化铜______________________一氧化碳与氧化铁__________________________(3)甲烷燃烧 ____________________________ 酒精燃烧 ________________________________(4)光合作用呼吸作用初中化学常用化学式汇编一、单质:(1)金属单质:铝____ 银____ 汞(液体)____镁____ 锰____ 锌 ____ 钙____ 铜(紫红)____钠____钡____铁____(2)非金属单质:氧气____ 氮气____ 氢气____ 氯气____ 红磷____ 硫(黄)____ 木炭(灰黑)____ 硅____(3)稀有气体:氦气____ 氖气____ 氩气____二、化合物:(1)氧化物:一氧化碳________二氧化碳________二氧化硫________三氧化硫______水______二氧化氮 _______过氧化氢______五氧化二磷______氧化铁(红)_______四氧化三铁(黑)______二氧化锰(黑)________氧化汞(红)________氧化镁 ________ 氧化铜(黑)________氧化铝 ________ 氧化钙________(2)酸(酸=H+ + 酸根离子):盐酸________ 硫酸________ 硝酸________ 碳酸________ *乙酸(俗称醋酸CH3COOH)(3)碱(碱=金属离子 + OH-括号内为沉淀的颜色):氢氧化钠______ 氢氧化钾_______氢氧化钙_______ 氢氧化铜(蓝↓)________氢氧化钡_______氢氧化铝氢氧化铁氨水( NH3·H 2O )(4)盐(盐=金属离子 + 酸根离子括号内为溶液的颜色):氯化钠________氯化铜 ________ 氯化钙________ 氯化亚铁(浅绿)________氯化铁(黄)________硫酸铜(蓝)_______硫酸钾_______硫酸钠_____硫酸铝硫酸亚铁(浅绿)_______硫酸钡_______大理石或石灰石的主要成分________碳酸钾_______碳酸钠________碳酸钡______碳酸氢钠________硝酸钾________硝酸钠________硝酸钙________硝酸银________硝酸钡________氯化铵________硫酸铵 ________ 硝酸铵________碳酸氢铵________氯酸钾_______高锰酸钾(暗紫固体)________锰酸钾________亚硫酸钠________ 亚硝酸钠________(5)有机化合物:天然气、沼气的主要成分(甲烷)________ 乙醇________ 甲醛( CH2O有毒)*甲醇(CH 3OH有毒)葡萄糖淀粉三、其它化学符号:氢氧根离子_____ 硝酸根离子_____ 碳酸根离子_____ 硫酸根离子_____ 铵根离子_____二个氧原子________二个氧分子________二个氧离子________ 标出水中氧元素的化合价________ 二个水分子_______五个五氧化二磷分子_______二个氢氧根离子_______二个二氧化氮分子________三个碳酸根离子________ 二个二氧化碳分子 ________ 四个硫酸根离子________钾离子 _____ 钠离子_____ 氢离子_____ 银离子_____亚铁离子(浅绿)_____ 铜离子(蓝)_____ 镁离子_____ 钙离子_____ 钡离子_____ 锌离子_____ 铁离子(黄)_____铝离子_____ 氯离子_____四、常用物质的俗名:NaOH________ ________ ________Hg________H2O2________Ca(OH) 2 ________ ________CaO ________Na2CO3________ ________ NaHCO3________ NaCl________ CO 2 (固)________ C 2H 5OH ________。
九年级化学用语大全(1至8单元)

化学用语一、元素符号氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰 Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W 二、化学式氧气 O2氢气 H2氮气 N2氟气 F2氯气 Cl2氦气 He氖气 Ne 氩气 Ar 溴 Br2碘 I2臭氧 O3碳 C硫 S 磷 P 硅 Si 碳60 C60铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银 Hg 钠 Na水 H2O 过氧化氢 H2O2二氧化碳 CO2一氧化碳 CO 二氧化氮 NO2一氧化二氮 N2O 一氧化氮 NO 二氧化硅 SiO2五氧化二磷 P2O5二氧化硫 SO2三氧化硫 SO3二氧化氯 ClO2氧化钠 Na2O氧化镁 MgO 氧化铝 Al2O3氧化钾 K2O 氧化钙 CaO二氧化锰 MnO2四氧化三铁 Fe3O4氧化铁 Fe2O3氧化亚铁 FeO氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO盐酸 HCl 硫酸 H2SO4硝酸 HNO3碳酸 H2CO3磷酸 H3PO4氨气 NH3氨水 NH3·H2O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2氢氧化钡 Ba(OH)2氢氧化镁 Mg(OH)2氢氧化铝 Al(OH)3氢氧化锌 Zn(OH)2氢氧化铁 Fe(OH)3氢氧化亚铁 Fe(OH)2氢氧化铜 Cu(OH)2乙酸 CH3COOH甲烷 CH4乙醇 C2H5OH 葡萄糖 C6H12O6淀粉 (C6H10O5)n 蔗糖 C12H22O11氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl2氯化钙 CaCl2氯化镁 MgCl2氯化铝 AlCl3氯化锌 ZnCl2氯化铁 FeCl3氯化亚铁 FeCl2氯化铜 CuCl2氯化银 AgCl 硫酸钾 K2SO4硫酸钠 Na2SO4硫酸钡 BaSO4硫酸钙 CaSO4硫酸镁 MgSO4硫酸铝 Al2(SO4)3硫酸锌 ZnSO4硫酸铁 Fe2(SO4)3硫酸亚铁 FeSO4硫酸铜 CuSO4硫酸银 Ag2SO4硝酸钾 KNO3硝酸钠 NaNO3硝酸钙 Ca(NO3)2硝酸钡 Ba(NO3)2硝酸镁 Mg(NO3)2硝酸铝 Al(NO3)3硝酸锌 Zn(NO3)2硝酸铁 Fe(NO3)3硝酸亚铁 Fe(NO3)2硝酸铜 Cu(NO3)2硝酸银 AgNO3高锰酸钾 KMnO4锰酸钾 K2MnO4氯酸钾 KClO3碳酸钾 K2CO3碳酸钠 Na2CO3碳酸钙 CaCO3碳酸钡 BaCO3碳酸镁 MgCO3碳酸锌 ZnCO3碳酸亚铁 FeCO3碳酸银 Ag2CO3氯化铵 NH4Cl 硝酸铵 NH4NO3硫酸铵 (NH4)2SO4碳酸氢铵 NH4HCO3碳酸铵 (NH4)2CO3磷酸钙 Ca3(PO4)2三、常见的离子符号氧离子 O2-氟离子 F-硫离子 S2-氯离子 Cl-钠离子 Na+镁离子 Mg2+铝离子 Al3+钾离子 K+钙离子 Ca2+氢离子 H+锂离子 Li+铍离子 Be2+铁离子 Fe3+亚铁离子 Fe2+铜离子 Cu2+2++ 2+--四、化学方程式1.红磷在氧气中燃烧2.硫在氧气中燃烧3.铁丝在氧气中燃烧4.加热高锰酸钾5.过氧化氢溶液与二氧化锰混合6.加热氯酸钾与二氧化锰的混合物7.在氧气中加热汞8.氧化汞受热分解9.氢气在氯气中燃烧10.氢气在氧气中燃烧11.电解水12.镁条在氧气中燃烧13.铝箔在氧气中燃烧14.铜在空气中加热15.氢气还原氧化铜16.木炭在氧气中完全燃烧17.木炭在氧气中不完全燃烧18.碳还原氧化铜19.碳还原氧化铁20.碳还原二氧化碳21.碳还原水蒸气22.实验室制取二氧化碳23.碳酸分解24.工业上制备二氧化碳25.二氧化碳与水反应26.检验二氧化碳的反应27.一氧化碳燃烧28.一氧化碳还原氧化铜29.一氧化碳还原四氧化三铁30.灭火器的反应原理31.氧化钙与水反应32.甲烷燃烧33.乙醇(酒精)燃烧34.实验室制取氢气35.铝常温下氧化36.镁与盐酸反应37.铝与盐酸反应38.锌与盐酸反应39.铁与盐酸反应40.镁与稀硫酸反应41.铝与稀硫酸反应42.铁与稀硫酸反应43.铁与硫酸铜溶液反应44.锌与硫酸铜溶液反应45.铝与硫酸铜溶液反应46.铜与硝酸银溶液反应47.铝与硝酸银溶液反应48.铁与硝酸银溶液反应49.锌与硝酸银溶液反应50.工业上炼铁的反应原理。
初三化学上册化学用语(人教版)

九年级化学上册常见化学用语一、初三化学常见的离子(1)氢离子:H+ (2)氧离子:O2--(3)氟离子:F--(4)硫离子:S2—(5)氯离子:Cl-- (6)钠离子:Na+(7)镁离子:Mg2+(8)铝离子:Al3+(9)铁离子:Fe3+(10)亚铁离子:Fe2+(11)钙离子:Ca2+(12)铜离子:Cu2+(13)碳酸根离子:CO32—(14)硫酸根离子:SO42-- (15)硝酸根离子:NO3—(16)氢氧根离子:OH—(17)铵根离子:NH4+二、初三化学常见的化学式(一)单质的化学式:(1)金属单质的化学式:用元素符号表示:如:铜:Cu 镁:Mg 金:Au铁:Fe等(2)稀有气体的化学式:用元素符号表示:如:氦气:He氖气:Ne 氩气:Ar(3)带“石”旁的非金属单质的化学式:用元素符号表示:如:碳:C硫:S 磷:P 硅:Si (4)常温下呈气态的非金属单质的化学式:如:氢气:H2 氧气:O2 氮气:N2 氯气:Cl2 臭氧:O3(二)化合物的化学式书写:正价前,负价后,标出价,交叉约简定个数(1)氧化物的化学式的书写:如:水:H2O 二氧化碳:CO2 二氧化硫:SO2五氧化二磷:P2O5 二氧化硅:SiO2一氧化碳:CO 二氧化氮:NO2氧化钠Na2O:氧化钾:K2O 氧化钙:CaO 氧化钡:BaO氧化镁:MgO氧化锌:ZnO 氧化铝:Al2O3 氧化铁:Fe2O3 氧化亚铁:FeO 氧化铜:CuO(2)氯化物的化学式书写:氯化钠:NaCl氯化钾:KCl 氯化银:AgCl 氯化钙:CaCl2 氯化钡:BaCl2氯化镁:MgCl2 氯化锌:ZnCl2氯化铝:AlCl3 氯化铁:FeCl3 氯化亚铁:FeCl2 氯化铜:CuCl2(3)碱的化学式书写:如:氢氧化钠:NaOH 氢氧化钾:KOH氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2氢氧化镁:Mg(OH)2 氢氧化锌:Zn(OH)2氢氧化铝:Al(OH)3氢氧化铁:Fe(OH)3 氢氧化亚铁:Fe(OH)2 氢氧化铜:Cu(OH)2 (4)盐的化学式的书写:碳酸钠:Na2CO3碳酸钾:K2CO3 碳酸钙:CaCO3 碳酸钡:BaCO3碳酸镁:MgCO3 碳酸锌:ZnCO3(5)硫酸盐的化学式的书写:如:硫酸钠:Na2SO4 硫酸钾:K2SO4硫酸钙:CaSO4 硫酸钡:BaSO4 硫酸镁:MgSO4硫酸锌:ZnSO4硫酸铝:Al2(SO)3硫酸铁:Fe2(SO4)3硫酸亚铁:FeSO4硫酸铜:CuSO4(6)硝酸盐的化学式的书写:如:硝酸钠:NaNO3硝酸钾:KNO3 硝酸钙:Ca(NO3)2硝酸钡:Ba(NO3)2硝酸镁:Mg(NO3)2 硝酸锌:Zn(NO3)2硝酸铝:Al(NO3)3硝酸铁:Fe(NO3)3 硝酸亚铁:Fe(NO3)2硝酸铜:Cu(NO3)2(7)铵盐的化学式的书写:如:硝酸铵:NH4NO3 硫酸铵:(NH4)2SO4(8)酸的化学式的书写:如:碳酸:H2CO3盐酸HCl 硫酸:H2SO4硝酸:HNO3三、初三化学上册化学方程式的书写:(1)木炭燃烧:C+O2点燃CO2 ( 化合反应) (2)磷燃烧:4P+5O2点燃2P2O5 ( 化合反应)(3)硫燃烧:S+O2点燃SO2 ( 化合反应)(4)铁丝燃烧:3Fe+2O2点燃Fe3O4 ( 化合反应)(5)镁带燃烧:2Mg+O2点燃2MgO ( 化合反应)(6)铝燃烧:4Al+3O2点燃2Al2O3 ( 化合反应)(7)氢气燃烧:2H2+O2点燃2H2O ( 化合反应)(8)一氧化碳燃烧:2CO+O2点燃2CO2 ( 化合反应)(9)甲烷燃烧:CH4+2O2点燃CO2+2H2O(10)酒精燃烧:C2H5OH+3O2点燃2CO2+3H2O(11)加热氧化汞:2HgO△2Hg+O2↑(分解反应)(12)过氧化氢分解:2H 2O22H2O+O2↑(分解反应)(13)加热氯酸钾:2KClO3MnO2△2KCl+3O2↑(分解反应)(14)加热高锰酸钾:2KMnO4△KMnO4+MnO2+O2↑(分解反应)(15)电解水:2H2O通电2H2↑+O2↑(分解反应)(16)二氧化碳与石灰水的反应:CO2+Ca(OH)2==CaCO3↓+H2O(17)二氧化碳与水的反应:CO2+H2O==H2CO3 ( 化合反应)(18)碳还原氧化铜:C+2CuO高温2Cu+CO2↑(置换反应)(19)一氧化碳还原氧化铜:CO+CuO△Cu+CO2(20)实验室制取二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑(复分解反应)(21)碳酸钠与盐酸的反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑(复分解反应)(22)工业制二氧化碳:CaCO3高温CaO+CO2↑(分解反应)(23)镁在二氧化碳中燃烧:2Mg+CO2点燃2MgO+C(置换反应)(24)碳酸分解:H2CO3==H2O+CO2↑(分解反应)(25)碳与二氧化碳的反应:CO2+C高温2CO( 化合反应)九年级化学上册化学用语检测题(一)1、已知涂改液中含有二氯甲烷(CH2Cl2),则正确的是()A、它由碳、氢气、氯气组成;B、二氯甲烷由二氯甲烷分子构成C、二氯甲烷中含有1个碳原子,2个氢原子,2个氯原子;D、它由5种元素组成。
人教版九年级化学常用的化学用语大全
初中必背的化学用语
一、元素符号必记
1、1至20
2
+1 +1 -1 +1 +1
k Na Cl H Ag -2 +2 +2 +2 +2
O Ca Ba Mg Zn +2 +3 +2 +4 Fe F e C C
+3 +4 +5
Al Si P +2 +4 +6 S S S +2 +2 Cu Hg 0 0 H 2 O 2
负一氢氧硝酸根,负二硫酸碳酸根,负三记住磷酸根,唯有正一是铵根。
1 -1 -
2 OH - NO 3- SO 42- (三)离子和原子团
(1)常见的离子
氢离子一H + 钠离子一Na + 钾离子一K + 镁离子一Mg 2+钙离子一Ca 2+ 钡离子一Ba 2+ 锌离子一Zn 2+
铝离子一AI 3+银离子-Ag + 氧离子一O 2-
氯离子一Cl -
亚铁离子一562+(浅绿色) 铜离子一Cu 2+(蓝色) 铁离子一563+(黄色)
二、元素的化合价
(一)常见元素的化合价口诀
一价钾钠氯氢银 二价氧钙钡镁锌 二三铁 二四碳 三铝四硅五价磷 二四六硫都齐全 铜汞二价最常见 莫忘单质都为零
(二)常见原子团的化合价 -2
-3
+1 CO 32- P043-
NH 4+
⑵常见的原子团
氢氧根——OH- 碳酸根——CO32- 硫酸根SO42-
硝酸根——NO3-磷酸根PO43-铵根——NH4+三、常见的化学式
(一)、常见的单质
(二)、化合物
5、常见有机化合物
6、其他化合物
四、化学反应方程式。
初中化学知识点大全:化学用语总结
初中化学知识点大全:化学用语总结
初中化学知识点大全:化学用语总结
(1)相对原子质量和相对分子质量、分子—原子运动论、核外电子的排布规律
(2)元素符号的意义
① 某一种元素。
② 这种元素的一个原子。
③ 若物质是由原子直接构成的,则组成该物质的元素也可表示这种单质,例如: 、S、P
等。
(3)化合价:元素的原子相互化合的数目决定这种元素的化合价。
化合价与原子最外层电子数密切相关;在化合物里,元素正负化合价代数和为零;单质中元素
的化合价规定为零价。
(4)化学式:用元素符号来表示物质组成的式子。
(5)化学方程式:用化学式来表示化学反应的式子。注意书写原则、步骤、配平、反应条件、
箭头的正确使用。
(6)化学反应类型
(7)质量守恒定律
初中化学必背知识点(专题复习)
初中化学必背知识点一、化学用语1、化合价口诀(1) 常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三铝四硅五价磷;铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态4.(1)具有刺激性气体的气体: NH3(氨气)、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)、空气、稀有气体▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸(即醋);氨水;酒精为有特殊气体的液体。
四、一些物质的特性及用途:可燃性的气体:H2、CO、CH4 (甲烷) 都可做燃料,点燃前都要验纯,与空气混合点燃会爆炸。
还原性的物质:C、H2、CO 都可用来冶炼金属,将金属氧化物还原成金属单质。
具有氧化性的物质:O2,CO2助燃性物质:O2 能使带火星木条复燃,或使燃着木条燃烧更旺。
有毒的气体:CO,能与血红蛋白结合使人中毒,煤气中毒就是指CO中毒。
使澄清石灰水变浑浊气体:只有CO2最轻气体:H2也是唯一燃烧无污染的气体燃料干冰(CO2固体):用于人工降雨,致冷剂;CO2气体:用于灭火,做温室肥料,制汽水等盐酸(HCl):用于除铁锈,是胃酸的主要成份,浓盐酸有挥发性(挥发出HCl气体)石灰石(CaCO3):建筑材料,制水泥、高温煅烧制CaO;生石灰CaO:易与水反应并放热,做食品干燥剂,可用来制取Ca(OH)2。
熟石灰Ca(OH)2:用于改良酸性土壤,配制波尔多液,与Na2CO3反应制取NaOH五、化学与社会相关常识。
三大化石燃料:煤(固)、石油(液)、天然气(气)六大营养物质:糖类(主要供能物质,如:米、面、蔗糖、葡萄糖等)、油脂、蛋白质(鱼、肉、蛋、奶、豆)、维生素(蔬菜、水果)、水、无机盐缺乏某些元素导致的疾病:缺钙:骨质疏松症(老年人)、佝偻病(儿童);缺铁:贫血缺碘:甲状腺肿大(大脖子病)缺维生素A:夜盲症;缺维生素C:坏血病合金:生铁和钢都是铁的合金,区别是含碳量不同,钢含碳量低,黄铜是Cu-Zn合金铁生锈条件:铁同时与空气(主要是O2)和水接触防锈方法是:保持铁制品表面干燥和洁净,并在金属表面形成保护膜(涂油漆、涂油、镀其它金属等)。
初中上学期最重要的最全的化学用语(很实用)
常见的化学符号写出下列元素符号:氢氧氮氟氯氦氖氩碳硫磷硅碘钾钠银镁钙锌钡铝铁铜汞锰金写出下列离子符号:氢离子氧离子氟离子氯离子硫离子钾离子钠离子银离子镁离子钙离子锌离子钡离子铝离子铁离子铜离子亚铁离子铵根离子氢氧根离子硝酸根离子碳酸根离子硫酸根离子写出下列物质的化学式符号:氧气氢气氮气氯气氦气氖气氩气木炭硫粉红磷臭氧水二氧化碳二氧化硫五氧化二磷一氧化碳二氧化锰四氧化三铁氯酸钾氯化钾高锰酸钾锰酸钾氧化镁氯化钠碳酸钠硝酸铵氢氧化钙氧化铁硫酸盐酸碳酸钙氯化钙过氧化氢水银硫酸铜硝酸银硫酸铝甲烷乙醇硫酸锌氯化镁氯化亚铁1-20号元素的原子序数及原子结构示意图常见的化学方程式一、物质的燃烧1、木炭的燃烧2、硫粉的燃烧3、红磷的燃烧4、氢气的燃烧5、铁的燃烧6、镁的燃烧7、铜在氧气中加热8、一氧化碳的燃烧 9、甲烷的燃烧10、酒精的燃烧二、气体的制备1、实验室用过氧化氢制取氧气2、实验室用高锰酸钾制取氧气3、实验室用氯酸钾制取氧气4、实验室制备二氧化碳5、实验室制备氢气6、工业制备二氧化碳三、金属与酸、盐溶液的反应1、锌与稀盐酸反应2、铁与稀盐酸反应3、铁与稀硫酸反应4、镁与稀盐酸反应5、镁与稀硫酸反应6、铝与稀盐酸反应7、铝与稀硫酸反应8、铁与硫酸铜溶液反应9、铜与硝酸银溶液反应10、铝与氯化铜溶液反应四、氧化还原反应1、碳还原氧化铜2、氢气还原氧化铜3、一氧化碳还原氧化铁4、一氧化碳还原氧化铜5、二氧化碳与碳的反应五、其它1、二氧化碳的鉴定2、灭火器的反应3、二氧化碳与水的反应4、碳酸的分解5、碳的不完全燃烧。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学用语总结
一、单质
1、由原子直接构成的单质: 2、由分子构成的物质
(1)金属单质,如: Na 钠 Cu 铜 Mg 镁 Zn 锌 Al 铝 Ag 银 K 钾 Ba 钡 Ca 钙 Pt 铂 Mn 锰 Hg 汞 Fe 铁 Au 金…… (2)非金属固体 : C 碳 S 硫 P 磷 (3)稀有气体 : He 氦气 Ne 氖气 Ar 氩气 H2 氢气
N2 氮气
O2 氧气
O3 臭氧
Cl2 氯气
二、化合物
阴离子
阳离子 OH— (氢氧根离子) NO3— (硝酸根离子) Cl— (氯离子) SO42— (硫酸根离子) CO32— (碳酸根离子)
2O
H+ H2O 水 HNO3 硝酸 HCl 盐酸 H2SO4 硫酸 H2CO3 碳酸 H2O
水
NH4+ NH3·H2O 氨水 NH4NO3 硝酸铵 NH4Cl 氯化铵 (NH4)2SO4 硫酸铵 (NH4)2CO3 碳酸铵
K+ KOH 氢氧化钾 KNO3 硝酸钾 KCl 氯化钾 K2SO4 硫酸钾 K2CO3 碳酸钾 K2O
氧化钾
Na+ NaOH 氢氧化钠 NaNO3 硝酸钠 NaCl 氯化钠 Na2SO4 硫酸钠 Na2CO3 碳酸钠 Na2O
氧化钠
Ba2+ Ba(OH)2 氢氧化钡 Ba(NO3)2 硝酸钡 BaCl2 氯化钡 BaSO4 硫酸钡 BaCO3 碳酸钡 BaO
氧化钡
Ca2+ Ca(OH)2 氢氧化钙 Ca(NO3)2 硝酸钙 CaCl2 氯化钙 CaSO4 硫酸钙 CaCO3 碳酸钙 CaO
氧化钙
Mg2+ Mg(OH)2 氢氧化镁 Mg(NO3)2 硝酸镁 MgCl2 氯化镁 MgSO4 硫酸镁 MgCO3 碳酸镁 MgO
氧化镁
Al 3+ Al(OH)3 氢氧化铝 Al(NO3)3 硝酸铝 AlCl3 氯化铝 Al2(SO4)3 硫酸铝 此物质不存在 Al2O3
氧化铝
Zn2+ Zn(OH)2 氢氧化锌 Zn(NO3)2 硝酸锌 ZnCl2、 氯化锌 ZnSO4 硫酸锌 ZnCO3 碳酸锌 ZnO
氧化锌
Fe 2+ Fe(OH)2 氢氧化亚铁 Fe(NO3)2 硝酸亚铁 FeCl2 氯化亚铁 FeSO4 硫酸亚铁 FeCO3 碳酸亚铁 FeO
氧化亚铁
Fe 3+ Fe(OH)3 氢氧化铁 Fe(NO3)3 硝酸铁 FeCl3 氯化铁 Fe2(SO4)3 硫酸铁 此物质不存在 Fe2O3
氧化铁
Cu 2+ Cu(OH)2 氢氧化铜 Cu(NO3)2 硝酸铜 CuCl2 氯化铜 CuSO4 硫酸铜 CuCO3 碳酸铜 CuO
氧化铜
Ag + 此物质不存在 AgNO3 硝酸银 AgCl 氯化银 Ag2SO4 硫酸银 Ag2CO3 碳酸银 Ag2O
氧化银
三、化学反应
(一)、化合反应:“多变一”
1、氯化氢和氨气反应:氯化铵氨气氯化氢 ClNHNHHCl43
2、红磷燃烧: 五氧化二磷氧气磷点燃 522OP2O5P4点燃
3、硫的燃烧: 二氧化硫氧气硫点燃 22SOOS点燃
4、铁在氧气中燃烧:四氧化三铁点燃氧气铁 432OeFO2eF3点燃
5、镁的燃烧: 氧化镁氧气镁点燃 OMg2O2Mg2点燃
6、铝的燃烧: 氧化铝氧气铝点燃 322OAl2O34Al点燃
7、铜在空气中加热:氧化铜氧气铜加热 OCu2OCu22△
8、氢气的燃烧: 水氧气氢气点燃 OH2O2H222点燃
9、木炭燃烧: 二氧化碳氧气碳点燃 22COOC点燃
10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃 CO2OC22点燃
11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃 22CO2OCO2点燃
12、二氧化碳溶于水:碳酸水二氧化碳
13、生石灰遇水反应:氢氧化钙水氧化钙
(二)、分解反应:“一变多”
1、氧化汞加热分解: 氧气汞氧化汞加热 2OHg2OgH2△
2、过氧化氢催化分解:氧气水过氧化氢二氧化锰 22OMn22OOH2O2H2
3、高锰酸钾加热分解:
氧气二氧化锰锰酸钾高锰酸钾加热
4、氯酸钾与二氧化锰混合加热:
5、电解水: 氢气氧气水通电 222OH2O2H通电
6、碳酸分解: 二氧化碳水碳酸
7、碱式碳酸铜(孔雀石)热分解:
水二氧化碳氧化铜碱式碳酸铜加热
8、电解熔融氧化铝制铝:氧气铝氧化铝通电 232O3Al4OlA2通电
9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温 23COOaCaCOC高温
(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”
1、 氢气还原氧化铜:铜水氧化铜氢气加热
2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温
金属活动顺序:
3、 镁与稀盐酸反应:氢气氯化镁盐酸镁
4、 铝与稀盐酸反应:氢气氯化铝盐酸铝
5、 锌与稀盐酸反应:氢气氯化锌盐酸锌
6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁
7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁
8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌
9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝
10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁
11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝
12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁
13、铁与氯化铜反应:铜氯化亚铁氯化铜铁
(四)、复分解反应:
1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾
2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸
3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜
4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁
5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁
6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸
7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸
8、硝酸与氢氧化铜反应:
水硝酸铜氢氧化铜硝酸
9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡
9、氯化钡与碳酸钠反应:
氯化钠碳酸钡碳酸钠氯化钡
10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠
11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙
(五)、其他反应:
1、汽车尾气催化转换:
氮气二氧化碳一氧化氮一氧化碳
铂、钯
22
dPtPNCO2NO2CO2,
2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):
水碳酸钙氢氧化钙二氧化碳
3、大理石与盐酸反应:
二氧化碳水氯化钙盐酸碳酸钙
4、甲烷(天然气的主要成分)燃烧:
水二氧化碳氧气甲烷点燃
OH2COO2CH2224
点燃
5、一氧化碳还原氧化铁:
二氧化碳铁一氧化碳氧化铁高温
232
CO32FeCOOeF
高温
6、一氧化碳还原氧化铜:
二氧化碳铜一氧化碳氧化铜加热
2
COuCCOCuO
加热
10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵
11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△
(NH4)2SO4+2NaOH Na2SO4+ H2O+ NH3·H2O
7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶
