第7章-物质结构基础
热学课件:第7章-相-变

液体表面分子处于永不停息的热运动中 ,当逸出液面的分子数多于被液面俘获的分 子数时的物质迁移为蒸发;反之为凝结。
蒸发热:蒸发时,从液体表面跑出的分 子要克服液体表面分子对它的吸引力作功, 需吸收热量。液体温度越低,蒸发热越大。
1、饱和蒸气及饱和蒸气压 饱和蒸气是在气、液两相共存时满足力
学、热学及化学平衡条件的蒸气相,它是 与液体处于动态平衡的蒸气。
2、一级相变 摩尔熵和摩尔体积均发生突变的,可出现
过冷、过热现象的相变称为一级相变。所有发 生在气、液、固三种物态之间的相变及同素异 晶转变均属于一级相变。
3、连续相变 在发生相变时,相变前后摩尔熵和摩尔体
积均不发生突变,它们作连续变化,也不会出 现过冷过热现象的相变称为连续相变。也称λ 相变。在临界点发生的相变、液晶与液体之间 的相变均属于连续相变。
它们都是在气液分界面处以蒸发的方式 进行的,都是液态分子吸收潜热而转变成气 态分子的过程。在相同温度下,这两种形式 的液气相变都吸收(放出)相同的蒸发潜热 都有相同的饱和蒸气压Pr 。
二、真实气体等温线 1、真实气体等温线的测定
二、真实气体等温线 1、真实气体等温线的测定
压强计
.
二、真实气体等温线 1、真实气体等温线的测定
压强计
CO2 等温压缩实验
P
.
O
V
二、真实气体等温线 1、真实气体等温线的测定
压强计
CO2 等温压缩实验
P
.
O
V
二、真实气体等温线 1、真实气体等温线的测定
压强计
CO2 等温压缩实验
P
.
O
V
二、真实气体等温线 1、真实气体等温线的测定
压强计
CO2 等温压缩实验
第一章物质结构基础
第一章物质结构基础【知识导航】“上帝粒子”:希格斯玻色子(英语:Higgs boson)是粒子物理学标准模型中所预言的最后一种基本粒子(模型预言了62种基本粒子,已发现61种,包括质子、中子、电子、夸克等),以物理学者彼得·希格斯命名,是一种具有质量的玻色子,没有自旋,不带电荷,非常不稳定,在生成后会立刻衰变。
2012年7月4日,CERN(欧洲核子研究组织)宣布LHC(大型强子对撞机)的紧凑渺子线圈探测到两种新粒子,这两个粒子极像希格斯玻色子,但还有待物理学者进一步分析确定。
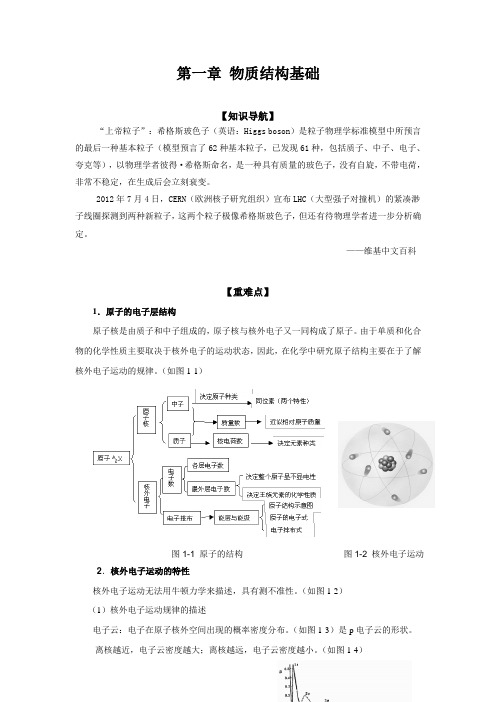
——维基中文百科【重难点】1.原子的电子层结构原子核是由质子和中子组成的,原子核与核外电子又一同构成了原子。
由于单质和化合物的化学性质主要取决于核外电子的运动状态,因此,在化学中研究原子结构主要在于了解核外电子运动的规律。
(如图1-1)图1-1 原子的结构图1-2 核外电子运动2.核外电子运动的特性核外电子运动无法用牛顿力学来描述,具有测不准性。
(如图1-2)(1)核外电子运动规律的描述电子云:电子在原子核外空间出现的概率密度分布。
(如图1-3)是p电子云的形状。
离核越近,电子云密度越大;离核越远,电子云密度越小。
(如图1-4)图1-3 p亚层结构图1-4 核外电子概率分布(2)核外电子运动状态的描述——四个量子数(n、l、m、m s)多电子原子中,决定能量的量子数是n、l。
(3)核外电子的排布遵循能量最低原理、泡利不相容原理及洪特规则。
根据n+0.7l的整数部分相同,近似分成若干近似的能级组。
3.原子结构与周期律元素周期律:元素的性质(原子半径、电离能、电负性、金属性等)随着核电荷数的递增而呈现周期性的变化。
一般而言,同一周期元素,从左到右原子半径逐渐减小,电离能和电负性逐渐增大,金属性减弱,非金属性增强。
同一族元素,从上到下原子半径逐渐增大,电离能和电负性逐渐减小,金属性增强,非金属性减弱。
周期表中共有7个周期,16个族(7个主族、7个副族、1个0族、1个第Ⅷ族)。
物质结构基础练习题

第1章物质结构基础习题一、思考题1. 试述下列各名词的意义(1)量子化(2)物质波(3)波函数(4)原子轨道(5)几率密度(6)量子数(7)电子云2. 原子中的能级主要由哪些量子数来确定?3. 试述描述核外电子运动状态的四个量子数的意义和它们的取值规则。
4. 基态原子的核外电子排布应遵循哪些规律?5. s轨道、p轨道、d轨道分别对应的l值为多少?6. s,2s,2s1各代表什么意义?指出4s、3d、5p各能级相应的量子数及轨道数。
7. n =2时,电子有哪些可能的空间运动状态?8. l =2的轨道,空间伸展方向有几种?9. p轨道角度分布图和p电子云角度分布图形的区别是什么?10. 用原子轨道符号表示下列各套量子数。
(1)n =2,l = 1,m = -1(2)n = 4,l = 0,m = 0(3)n =5,l =2,m = 011. 为什么任何原子的最外层上最多只能有8个电子?次外层最多只能有18个电子?12. 指出下列各元素的基态原子的电子排布式的写法违背了什么原理并予以改正。
(1)Be 1s22p2 (2)B 1s22s3(3)N 1s22s22p x22p y113. 现行的周期表中有几个区?每一个区包括哪几个族?各区的外层电子构型有何特征?14. 什么叫共价键的饱和性和方向性?为什么共价键具有饱和性和方向性,而离子键无饱和性和方向性?15. 共价键的轨道重叠方式有哪几种?16. 举例说明什么是σ键,什么是π键?它们有哪些不同?17. 价键理论和分子轨道理论的基本要点是什么?18. s、p原子轨道主要形成哪几种类型的杂化轨道?中心原子利用上述杂化轨道成键时,其分子构型如何?19. 实验测定BF3为平面三角形,而[BF4]-为正四面体形。
试用杂化轨道的概念说明在BF3和[BF4]-中硼的杂化轨道类型有何不同?20. 试用分子轨道表示式写出O2+的电子构型。
21. 分子间力有几种?各种力产生的原因是什么?试举例说明极性分子之间、极性分子和非极性分子之间以及非极性分子之间的分子间力。
第7章_二元相图

α, β两相平衡时,热力学条件为: μαA =μβA μαB =μβB 即两组元在两相中的化学势相等。因此,两 相平衡时的成分由两相G-x曲线的公切线确定, 见图7.4。
图7.4 两相平衡的自 由能曲线图
α、β、γ三相平衡时,热力学条件是: μαA =μβA =μγA μαB =μβB =μγB 三相的切线斜率相等,即为它们的公切线,切线所 示的成分表示α、β、γ平衡时的成分切线,与A、B轴 的截距是A、B组元的化学势,见图7.5。
Ω = NAZ[eAB―(eAA + eBB)/2]
(a) Ω<0:eAB <(eAA + eBB)/2,AB相互吸 引,形成 短程有序,此时ΔHm<0;
(b) Ω=0:eAB =(eAA + eBB)/2,组元配臵是 随机的,此时ΔHm=0为理想固溶体; (c) Ω>0:eAB >(eAA + eBB)/2,AB对结合不 稳定,形成偏聚状态,此时ΔHm>0。
二元相图是平面图形 纵轴表示温度 横轴表示成分,多以质量分 数表示
成 分 线
7.1.2 相图的测定方法
二元相图是根据各种成分材 料的临界点绘制的,临界点表 示物质结构状态发生本质转变 的相变点。
测定材料临界点的方法有: 热分析法、膨胀法、电阻 法、金相法、X射线法、 结构分析等。 现以Cu—Ni二元合金为例,用热分析法测定临界点绘 制二元相图。
练习:已知相图如下,画出T1、T2、T3、T4、 T5各温度下的自由能—成分曲线。
上节课复习
1、公切线原理
2、杠杆规则
x1 n1 x x2 n2
x2 x n1 = x x 2 1
n2 =
x x1 x2 x 1
第7章 固体表面与界面

2、铺展润湿
SV= SL+LV cos)
LVcos= SV-SL=F cos=(SV- SL)/LV
面能大小来估计。对于离子晶体,表面主要取决于晶格能和极化
作用(表面能与晶格能成正比)。主要形成化学吸附。
2
2、分子引力(范德华力)
一般是指固体表面与被吸附质点(如气体分子)之间相互作用
力。它是固体表面产生物理吸附和气体凝聚的原因。分子间引力 主要来源于三种不同效应。
1) 定向力:相邻两个极化电矩因极性不同而相互作用的力。主
c.凸面上的饱和蒸气压>平面>凹面(P凸>Po> P凹)。
12
讨 论:
1 Ln (球面), P0 RT r
P
2M
Ln
P P0
M
RT
(
1 r1
+
1 r2
)( 非球面)
r↓→凸面上蒸气压升高P凸↑; r↓→凹面上蒸气压下降P凹↓
这种蒸气压差,在高温下足以引起微细粉体表面质点由凸面
SL很大,不润湿。
16
3、浸渍润湿(液体表面没有变化)
浸渍润湿指固体浸入液体中的过程。 例:生 坯的浸釉。把固体浸在液体之中,固-气界面 为固-液界面所代替,γSV→γSL: ΔG=γSL-γSV 当γSV >γSL,润湿自发进行。
固
液体
三种润湿共同点:液体将气体从固体表 面挤开,由固-液界面→固-气(或液气) 界面,铺展是润湿的最高标准,能铺展 则必能附着和浸渍。
王顺荣编高教版社结构化学习题答案第7章
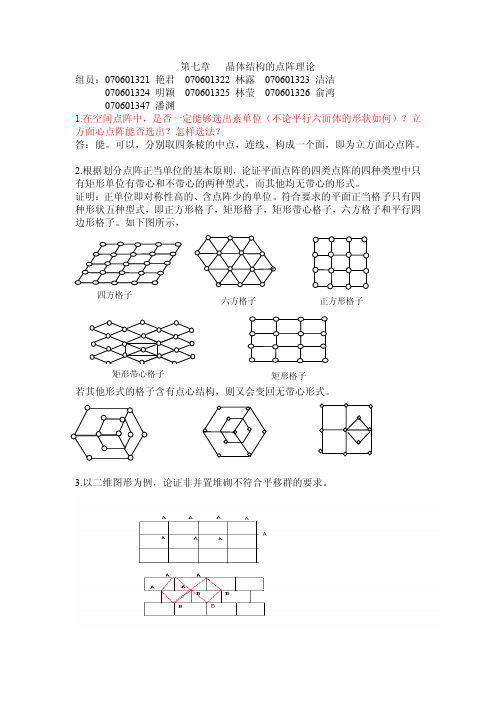
(010)与(210)的夹角为 arc tan1/2 (110)与(210)的夹角为 arc tan1/2-45° 13、利用立方体图形,计算 CH4 正四面体结构 C-H 键的夹角是 109o28' A、B、C、O 为 CH4 中 4 个 H,D 为 CH4 的 C A、O、D 的原子坐标分别为(1,0,1) ,(0,0, 0), (1/2,1/2,1/2) AD=√3/2 , OD=√3/2, AO=√2 ∠AOD 为两个 C-H 键的夹角 Cos∠AOD=(AD2+ OD2- AO2)/2 AD· OD=-1/3 ∠AOD=109o28' 即 CH4 中 C-H 键夹角为 109o28' 14.利用三角函数法,证明由于点阵结构的制约,晶体结构中不存在 5、7 及更高 次轴。
,
解: 设 A 的射散因子为 fa,B 的射散因子为 fb F(hkl)= faei2π(0+0+0) +fbei2π( =fa+ fbeiπ(h+k+l) =fa+ fb[cosπ(h+k+l)+i sin(h+k+l)] 当 fa=fb,即 AB 为相同物质时: 当 h+k+l=奇数时,F(hkl)=0 当 h+k+l=偶数时,F(hkl)=2f 在奇数时不衍射,故为体心点阵(I) 当 fa≠fb,即 AB 为不同物质时: 无消光现象,故为简单点阵(P)
b (s s 0) k
c (s s 0) l
式中 a,b,c 反映了晶胞大小形状和空间取向; s 和 s 0 反映了衍射 X 射线和入射 X 射线的方向;h,k,l 为衍射指标, 为 X 射线波长。 衍射强度 Ihkl 和结构因子 Fhkl 成正比,而结构因子和晶胞中原子种类及其坐标参数 x,y,z 有关:
卢嘉锡、徐光宪和《物质结构》
3 物构配化 一脉相承
我在本科一年级第一学期的高等数学和无机化学课程中均取得优秀的成绩,但从第二学期开始, 由于之前的知识缺漏和某种倦怠感,我开始表现出不适应,学习成绩起起伏伏,大二阶段是四年学 习中的低谷,连我自己也非常不满意。第三学年迎来了被文革前厦门大学化学系学生称为鬼门关的 物理化学和物质结构课程,对我来说却是转机,我不但延续了大二下学期的有机化学课程优秀的成 绩,而且在几门主科中都表现不俗,其中物质结构获取了92分,这个势头一直保持到四年级的三门 专业课,包括配位化学和毕业论文均全优,以及后来的在职研究生课程(量子化学、谱学和配位化学 选读等)学习的优良成绩。为胜任留校后的无机化学和配位化学的教学和科研工作打下了比较好的基 础。我把后来在学业上的急起直追归功于当时有《物质结构简明教程》这本“私家书”在手,有如 神助。
1957年暑假,吉林大学唐敖庆、厦门大学卢嘉锡、复旦大学吴征铠和北京大学徐光宪奉高教部 委托编写物质结构教材,在青岛集中写了一个月,完成了初稿的一半,字数估计将近百万。但以后 这四位老师总抽不出一个共同的时间来完成初稿的另一半,而各方面又等待着早日出版一本《物质 结构》教材,因此要求徐光宪以北京大学开课6年的物质结构讲义为基础修改整理,他用了2年的时 间修改完成了书稿。1959年12月,《物质结构》一书由高等教育出版社出版。1961年,人民教育出版 社将其分为上、下册(图3),再版两次,从此成为全国各大专院校相关专业的通用教材。
第二章 物质结构基础知识
基础化学
族 周 期 IA 1 2 3 4 5 6 7 H 氢 Li 锂 Na 钠 K 钾 Rb 铷 Cs 铯 Fr 钫 IIA Be 铍 Mg 镁 Ca 钙 Sr 锶 Ba 钡 Ra 镭 镧 系 s区 d区 IIIB IVB VB VIB VIIB Sc 钪 Y 钇 Lu 镥 Lr 铹 La 镧 Ti 钛 Zr 锆 Hf 铪 Rf V 钒 Nb 铌 Ta 钽 Db Cr 铬 Mo 钼 W 钨 Sg Mn 锰 Tc 锝 Re 铼 Bh Fe 铁 Ru 钌 Os 锇 Hs VIII Co 钴 Rh 铑 Ir 铱 Ni 镍 Pd 钯 Pt 铂 p区 f区 IB Cu 铜 Ag 银 Au 金 IIB Zn 锌 Cd 镉 Hg 汞
Essential Chemistry 我国化学家徐光宪教授,根据光谱实验数据, 对基态多电子原子轨道的能 级高低提出一种定量的依据,即 n+0.7l 值愈大,轨道能级愈高,并把 n+0.7l 值的第一位数字相同的各能级组合为一组,称为某能级组。
多电子原子能级组 能级 n + 0.7 l 能级组 组内电 子数
n 越大离核越远。
Z2 E 13.6 2 eV n
E :电子能量,Z:原子序数, eV:电子伏特,能量单位, 1eV = 1.603 10-19 J
基础化学
Essential Chemistry
2、角量子数 (l)
取值:受n限制, 对于确定的主量子数 n ,角量子数 l 可 以为 0,1,2,3,4 … … ( n - 1 ) , 共 n 个取值。
基础化学
Essential Chemistry
2、能量最低原理
在不违背保里不相容原理的前提下,电子在各轨道上的排布方式 应使整个原子能量处于最低状态。
《物质结构》习题答案
物质结构对应习题:王仁国主编《无机及分析化学》第1版第四章1.氮原子的价电子构型是2s22p3,试用4个量子数分别表明每个电子的运动状态。
解:n=2;l=0,1;m=0,±1;m s=12±;2.下列各组轨道中,哪些是简并轨道?简并度是多少?(1)氢原子中2s,2p x,2p y,2p z,3p x。
(2)He+离子中4s,4p x,4p z,4d xy,5s,5p x。
(3)Sc原子中2s,2p x,2p z,2p y,3d xy,4s。
解:(1)2s,2p x,2p y,2p z是简并轨道,简并度是4;(2)4s,4p x,4p z,4d xy是简并轨道,简并度是4;(3)2p x,2p z,2p y是简并轨道,简并度是3;3.下列各原子的电子层结构何者属于基态、激发态或不正确的?(1)1s22s12p2; (2)1s22s12d1;(3)1s22s22p43s1;(4)1s22s22p63s23p3;(5)1s22s22p83s1;(6)1s22s22p63s23p63d54s1。
解:原子的电子层结构属于基态的是:(4),(6)原子的电子层结构属于激发态的是:(1),(3)原子的电子层结构属于不正确的是:(2),(5)4.在氢原子中,4s和3d哪一个轨道能量高?19号元素钾的4s和3d哪个能量高?并说明原因。
解:氢原子中4s轨道的能量高,因为氢原子是单电子体系,其能量不受l的影响,只与n有关,n越大其能量越高;19号元素钾的3d比4s能量高,主要是因为多电子体系由于屏蔽效应和钻穿效应,发生能级交错。
5.写出下列原子和离子的电子结构式。
(1)Cu(z=29)和Cu+(2)Fe(z=26)和Fe3+(3)Ag(z=47)和Ag+(4)I (z=35)和I-解:(1)Cu(z=29):[Ar]3d104s1和Cu+:[Ar]3d10(2)Fe(z=26):[Ar]3d64s2和Fe3+:[Ar]3d5(3)Ag(z=47):[Kr]4d104s1和Ag+:[Kr]4d10(4)I (z=35) :[Ar]3d104s24p5和I-:[Ar]3d104s24p66.某一元素的原子序数为24,试问:(1)核外电子总数是多少?(2)它的电子排布式?(3)价电子层结构;(4)元素所处的周期、族、区?解:(1)核外电子总数是24(2)它的电子排布式:1s22s22p63s23p63d54s1(3)价电子层结构:3d54s1(4)元素所处的四周期、ⅥB族、d区7.AⅠ族最外层电子数虽然都为1,但它们的金属性却不同,为什么?Ⅰ族和BⅠ族其价层电子构型为n s1,属于活泼金属,容易失电子并形成稀有气体解:A结构1s2或n s2n p6稳定结构,而BⅠ族外层电子构型为(n-1)d10n s1,原子半径比同Ⅰ族差。
材料科学与工程基础 ppt课件
PPT课件
Figure 2.11 17
3. 共价键合 (Covalent Bonding)
两个原子共享最外壳电子的键合。
特点:
① 两原子共享最外壳层电子对;
② 两原子相应轨道上的电子各有一个,自旋方向 必须相反;
③ 有饱和性和方向性。电子云最大重叠,一共价 键仅两个电子。
PPT课件
6
第二章 物质结构基础
(Structure of Matter)
• What are atomic structures and interatomic bonds? • What are the equilibrium separation and the
bonding energy between atoms. • What is the difference in structures between
crystalline and noncrystalline materials. • What is solid solution. • What is the importance of phase diagrams. • What is the characteristic of materials surface.
PPT课件
15
2 . 金属键合 (Metallic Bonding)
特点: ① 由正离子排列成有序晶 格; ② 各原子最 (及次)外层电子 释放,在晶格中随机、自由、 无规则运动,无方向性;
PPT课件
Figure 2.11 16
2 . 金属键合 (Metallic Bonding)
特点: ③ 原子最外壳层有空轨道或 未配对电子,既容易得到电 子,又容易失去电子;
