有机化学 环烷烃
有机化学环烷烃

有机化学环烷烃在有机化学的广袤领域中,环烷烃是一类具有独特结构和性质的化合物。
它们就像是化学世界里的“小圈圈”,有着自己独特的魅力和价值。
环烷烃,简单来说,就是碳原子通过单键连接形成环状结构的烃类化合物。
与我们熟悉的直链烷烃相比,环烷烃的环状结构赋予了它们一些与众不同的特点。
从结构上看,环烷烃的碳原子排列成环。
环的大小可以不同,常见的有三元环、四元环、五元环等等。
环的大小对环烷烃的稳定性有着重要的影响。
比如,三元环和四元环由于环张力较大,相对来说不太稳定,容易发生开环反应。
而五元环和六元环则相对稳定得多。
稳定性的差异导致了它们在化学反应中的表现各不相同。
以开环反应为例,小环烷烃在一定条件下能够与氢气、卤素等发生开环加成反应。
这是因为小环烷烃的环张力使得它们的化学键相对更容易被打开,从而与其他物质发生反应。
而大环烷烃则相对较难发生这样的反应。
环烷烃的物理性质也有其特点。
一般来说,环烷烃的沸点和熔点比相同碳原子数的直链烷烃要高。
这是因为环状结构使得分子间的接触更为紧密,相互作用增强,从而需要更高的温度来打破这种相互作用。
在实际应用中,环烷烃有着广泛的用途。
在石油化工领域,环烷烃是重要的原料。
通过一系列的化学反应,可以将它们转化为各种有用的化学品,如溶剂、润滑油等。
在医药领域,一些含有环烷烃结构的化合物具有特定的生物活性,被用于药物的研发和制造。
让我们更深入地了解一下环烷烃的命名规则。
对于简单的环烷烃,通常以“环”字开头,然后根据环上碳原子的数目称为“环某烷”。
如果环上有取代基,则要按照一定的顺序为取代基编号,以表明它们在环上的位置。
再来看看环烷烃的同分异构体。
由于环的结构可以有多种变化,所以相同碳原子数的环烷烃可能存在多种同分异构体。
比如,C₅H₁₀就有环戊烷和甲基环丁烷等多种同分异构体。
环烷烃的存在和性质对于我们理解有机化学的整体框架有着重要的意义。
它们不仅丰富了有机化合物的种类,也为我们研究和应用有机化学提供了更多的可能性。
有机化学-环烷烃

得到的构型与原来的构型一样。 椅式C-H键的分类: 6个直立键:3个朝上,3个朝下。
23
都叫a键。平行于C3轴。
6个平伏键:3个朝上,3个朝下。
都叫e键,与直立键成109°28/。
结论:
C3
①. 椅式是环己烷的最稳定的构象,在各种构象的
平衡混合物中,椅式占99.9%。 因为在椅式构象中,相邻两个碳原子上C-H键都
1. 物理性质(自学) 2. 化学反应 1). 取代反应
+ Br2
hν
Br
+ HBr
机理:自由基机理 取代反应一般在五、六元环上易发生。
12
2). 加成反应 小环易发生加成反应。
①. 加 H2
+ H2
Ni
+ H2 + H2
② . 加 X2
40℃ Ni CH CH CH CH 3 2 2 3 100℃
16
三. 环烷烃的稳定性 (Stability of Cycloalkanes)
为什么三元环不稳定易发生加成?
为什么五元环、六元环较稳定不易发生开环加成,而易
发生取代? 1. 拜尔(Baeyer )张力学说要点
①. 形成环的碳原子都在同一平面上,并排成正多边形。 ②. 正常C-C键之间夹角为109.5°,环中C-C键之间夹
第三章 环烷烃
主讲:徐华
一. 环烷烃的分类、命名和异构 二. 环烷烃的物理性质和化学反应 三. 环烷烃的稳定性 四. 环烷烃的构象
2
一. 环烷烃的分类、命名和异构 概述:单环环烷烃通式:CnH2n 1. 分类
,
与烯烃互为异构体。
环烷烃的性质与烷烃相似。
小环:3~4个碳原子。 普通环:5~7个碳原子。 单环体系 中环:8~11个碳原子。 大环:12个以上碳原子。 螺环:两个环公用一个碳原子,公用的碳叫螺碳。 多环体系 桥环:两个环公用两个或两个以上碳原子。
环烷烃的概念

环烷烃的概念环烷烃是一类有机化合物,也被称为脂环烷烃或脂肪环烷烃。
它的分子结构由碳(C)和氢(H)原子组成,其中碳原子形成一个或多个环状结构,每个碳原子上连接着两个氢原子。
环烷烃的普遍化学式为CnH2n,其中n代表碳原子的数量。
环烷烃根据碳原子的环状结构可以分为多个类别,最简单的是环己烷(C6H12),它由六个碳原子组成一个环。
其他常见的环烷烃有环戊烷、环丙烷等。
环烷烃的特点是分子结构中含有一个或多个环状结构,这种环状结构使得环烷烃相对于直链烷烃具有一些特殊的性质。
首先,由于环烷烃分子内部有较大的空间限制,环烷烃的分子难以与其他分子进行反应,使得环烷烃的化学稳定性较高。
此外,环烷烃还具有较高的沸点和熔点,比直链烷烃的物理性质要高。
环烷烃可以通过多种方法合成,最常见的方法是通过烷烃的脱氢反应得到。
例如,环己烷可以由己烷经过加热脱氢反应制得。
此外,环烷烃还可以通过环状化合物之间的反应合成,如环戊烷可以由乙烯和乙烯二聚反应得到。
环烷烃在生活中有广泛的应用。
最典型的例子是石油和天然气中的环烷烃,它们是石油和天然气中最常见的组分之一。
石油和天然气中的环烷烃可以用于生产燃料、润滑剂和化工原料。
此外,环烷烃还可用作溶剂、塑料、橡胶等领域的原料。
但是,环烷烃也存在一些环境和健康方面的问题。
环烷烃是一类挥发性有机物,它们在大气中的存在会对空气质量产生负面影响,形成臭氧、光化学烟雾等污染物。
此外,环烷烃还可能引发健康问题,如呼吸道疾病和神经系统损伤。
总之,环烷烃是一类有机化合物,具有稳定性高、物理性质特殊的特点。
它们在能源、化工和其他领域有着广泛的应用,但也带来环境和健康方面的问题。
对环烷烃的深入研究和合理利用,有助于提高环境质量,推动可持续发展。
有机化学第三章环烷烃
2、加成反应 、
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 加氢(随碳原子数增加,环的稳定性增加; 件也愈苛刻) 件也愈苛刻)
Ni + H2 40 C Ni 110 C Pt 330 C以 上 以
互为构象异构体。 互为构象异构体。
重叠式构象
交叉式构象
一、环己烷的构象
1918年 Mohr提出非平面无张力环学说,提出环已烷 年 提出非平面无张力环学说, 提出非平面无张力环学说 的六个碳原子都保持正常键角109o28’的椅式和船式构象。 构象。 的六个碳原子都保持正常键角 的椅式和船式构象
1、椅式构象(稳定的极限构象) 椅式构象(稳定的极限构象)
环 丁烷 环 丙烷 cyclopropane cyclobutane
环戊烷 cyclopentane
CH3 CH3 A: Isopropylcyclopentane
CH2CH2CH2CH2CH3 B: 1-Cyclobutylpentane
C3
2
4
D
1
5 4 3 2
E
CH3 CH3 CH CH3
F
CH3 CH3 CH3CCH CH3 Br
+ HBr
3、氧化反应 、
a)小环不被高锰酸钾,臭氧所氧化 )小环不被高锰酸钾,
+ KMnO4 + O3 H+ × H+ ×
应用:鉴别小环与不饱和烃类化合物 应用:
CH3 CH=C H 3C H3C CH3 KMnO4 H3C H
+
COOH +
有机化学03环烷烃

CH3
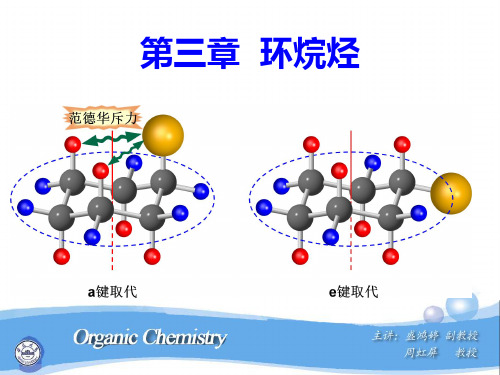
有不同取代基时,大基团 处于e键的构象为优势构象。
H 3C H 3C H 3C C H H CH3
H3C H
CH3 C
CH3 H CH3
(t-Bu,e; Me,a)优势构象
(t-Bu,a; Me,e)
trans-1-甲基-3-叔丁基环己烷 trans-1-tert-Butyl-3-methylcyclohexane
环戊烷的构象:
C:sp3杂化, 轨道夹角109.5° 正五边形内角为108° 角张力:109.5-108=1.5° 可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五个碳 原子亦不共平面,而是以“信封 式”构象存在,使五元环的环张 力可进一步得到缓解。
反-1, 3-二乙基环戊烷
环烷烃的结构与稳定性
(一)环烷烃的稳定性与环大小的关系
1、稳定性:
<
<
,
…...
2、环烷烃稳定性大小的解释:
(1)Baeyer 张力学说 (2)“弯曲键”理论。 “弯曲键”理论是Baeyer 张力学说现代解释。
拜尔张力学说(A.von Baeyer 1885年)
① ② 假设成环所有的碳原子都在同一平面上,构成正多边形。 。 假设所有键角为109 28′(即四面体结构)。
CH3 H3C H CH3 H H3C H H CH3 CH3 H CH3
H3C
H
顺(cis): 两个取代基在环同侧;
反(trans):两个取代基在环异侧。
顺-1, 4-二甲基环己烷
反-1, 4-二甲基环己烷
思考题
C2H5
H
H
有机化学:第五章 环烷烃

? CH3 C CH3 CHC3H3
CH3 H3C CHC3H3
e, a构象
e, a构象
33
1,3-二取代环己烷的构象
CH3
CH3
CH3 CH3
CH3 CH3
e, a构象
CH3 CH3
H3C
CH3
a, a构象
e, e构象,优势
34
小结:
1°环己烷有两种极限构象(椅式和船式),椅式为优势构象。 2°一元取代基主要以e键和环相连。 3°多元取代环己烷最稳定的构象是e键上取代基最多的构象。 4°环上有不同取代基时,大的取代基在e键上构象最稳定。
1885年,Baeyer提出了张力学说(strain theory):
a. 形成环的C原子都在同一平面上,并排成正多 边形; b. 在不同环中C-C键之间的夹角小于或大于正四 面体所要求的角度:109°28′; c. 环中C-C键键角的变形会产生张力,键角变形 的程度越大,张力越大,环的稳定性低,反应活 性越大。
+
Cl2
+
Cl2
+
Cl2
+
Br2
+
Cl2
hv hv 300 oC hv hv
Cl Cl
Cl Br
Cl
10
氧化反应
KMnO4
O + CO2H
O3
( Z)
Zn/H2O
OHC
CHO
11
中小环的加成反应
加氢反应
+
H2
+
H2
+
H2
Ni 80 oC
Ni 100 oC
Pt 300 oC
下列环烷烃

下列环烷烃环烷烃是一群重要的有机物质,其特性常被用于制造各种用途的物质。
它们主要是碳原子和氢原子组成的环烃结构,可以是含有两个至八个碳原子的环状结构,也可以是含有更多碳原子的非环状结构,下面就是一些常见的环烷烃:1、二环烷烃:主要有氧化萘、萘和芘,这些分子中的碳原子由两个碳原子组成,特征是两个碳原子可以连接在一起;2、三环烷烃:主要有芴、吡和苯,它们的碳原子由三个组成,特征是三个碳原子环状连接在一起;3、四环烷烃:主要有芘、特芘和蒽,它们的碳原子由四个组成,具有四个碳原子环状连接的特点;4、五环烷烃:主要有喹啉、芘和唑,它们的碳原子由五个组成,具有五个碳原子环状连接的特点;5、六环烷烃:主要有芘和芘烯,它们的碳原子由六个组成,以及有六个碳原子环状连接的特点;6、七环烷烃:主要有吡嗪和苯并唑,它们的碳原子由七个组成,以及有七个碳原子环状连接的特点;7、八环烷烃:主要有吡咯和亚油酸吡咯,它们的碳原子由八个组成,以及有八个碳原子环状连接的特点。
环烷烃在有机物质的分子结构中具有重要的意义,它们的性质决定了它们在化学合成中的重要作用。
环烷烃由碳原子和氢原子环状连接形成,这种结构使它们具有强烈的立体选择性,这也是它们在有机反应中有特殊作用的一个重要原因。
此外,环烷烃还具有表面活性,其表面活性可以改变溶液的动力学、物理和性质等特性,从而对化学反应有重要作用。
环烷烃也用于制造润滑油,保护机械部件免受磨损和摩擦。
有些润滑油的制造方法是使用环烷烃,它们具有良好的润滑性、抗磨擦性和抗渗透性,这样就可以保护机械部件的表面不被摩擦磨损。
此外,环烷烃在制药工业中也有重要应用,它们具有抗菌作用,因此常被用于制造抗菌药物。
环烷烃也可以用于制造着色剂、防腐剂、光稳定剂和抗氧化剂等,此外它们还可以用于制造某些高分子化合物,并可以用于生物化学,如用于抗病毒疗法、细胞增殖促进剂和荷尔蒙类药物等。
综上所述,环烷烃是一种重要的有机物质,它们具有重要的化学特性和应用,如润滑剂、保护剂、防腐剂、抗氧化剂、着色剂和制造高分子化合物等,它们还有一定的医药价值,如抗菌药物和抗病毒药物等。
第二章环烷烃

97%
C(CH3)3
C(CH3)3
3%
> 99.9% 从上述三个实验事实可看出:取代基体积越大, 取代占的 从上述三个实验事实可看出:取代基体积越大, e取代占的 比例越大。 比例越大。
2). 多取代环己烷的构象 结论: 多取代环己烷, 取代基最多的构象最稳定 取代基最多的构象最稳定。 结论:①. 多取代环己烷, e取代基最多的构象最稳定。 多取代环己烷, 体积较大的取代基为e型的构象 ②. 多取代环己烷, 体积较大的取代基为 型的构象 最稳定。 最稳定。 二甲基环己烷的最稳定构象。 例1:写出顺 :写出顺-1,2-二甲基环己烷的最稳定构象。 二甲基环己烷的最稳定构象
1-甲基 叔丙基环己烷 甲基-4-叔丙基环己烷 甲基
CH3 CH3
顺-1,2-二甲基环丙烷 二甲基环丙烷
H H
H CH3
CH3
反- 1,3-二甲基环戊烷 二甲基环戊-3-叔丙基环戊烷 反-1-乙基 叔丙基环戊烷 乙基 2). 多环烃 螺环烃: 确定母体:螺某烷(由螺环中总碳数确定)。 螺环烃 ①. 确定母体:螺某烷(由螺环中总碳数确定)。 编号:先编小环后编大环。 ②. 编号:先编小环后编大环。从小环中和螺碳相 邻的碳开始编号,使取代基位次最小。 邻的碳开始编号,使取代基位次最小。 写法: ③.写法: 写法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
联环丙烷 bicyclopropane
➢ 环可作为取代基 (称环基) ➢ 相同环连结时,可
用词头“联”开头。
®山东农业大学化学学院
桥环烃(Bridged hydrocarbon)的命名
桥环:两个或两个以上碳环共用两个以上碳原子
桥头碳原子
10 2
9
1
3
8
6
4
7
5
十氢萘
环的数目
桥头间的碳原子数
(用"."隔开)
§3.2 环烷烃的物理性质和化学反应
一、物理性质
环烷烃的bp. mp.和相对密度比同碳原子数的直链烷烃高。 例题:将下列化合物按沸点降低的顺序排列: (1)丁烷(2)己烷(3)3-甲基戊烷 (4)2-甲基丁烷(5)2,3-二甲基丁烷(6)环己烷
解:(6)(2)(3)(5)(4)(1)
®山东农业大学化学学院
(环丙烷)、
(环己烷)
二环:如
(十氢萘)又叫二环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如
按环的连接方式 桥环:共有2个或 以上碳原子如
®山东农业大学化学学院
二、命名:与烷烃命名相似
普通环烷烃的命名
环丙烷
环己烷
cyclopropane cyclohexane
CH3
甲基环丙烷 methylcyclopropane
H
2H
1
H H
H H
H
4
H1 H
2
H
3
H
H H
4
5H 6
H
H
H
HH 5 H 6
C2, C3, C5, C6 共平面 H
H
椅式构象 (chair form)
船式构象 (boat form)
两者互为构象异构体
®山东农业大学化学学院
®山东农业大学化学学院
®山东农业大学化学学院
椅式构象
H
H
3
H
H
2
➢ 编号从小环开始
➢ 取代基数目取最小
®山东农业大学化学学院
环烷烃的其它命名方法 :
➢按形象命名 ➢按衍生物命名
立方烷 cubane
金刚烷 adamantane
十氢萘
Decahydronaphthalene
萘 naphthalene
O
莰烷
2-莰酮(樟脑)
camphane camphor
®山东农业大学化学学院
环丙烷 环丁烷
697.1 686.1
环戊烷 环己烷 环庚烷
664.0 658.6 662.4
中 C8
环 C11
大 C12 环
每个CH2的燃烧热 (KJ/mol)
环辛烷 环壬烷 环癸烷
663.8 664.6 663.6
环十四烷 658.6 环十五烷 659.0
对比:开链烷烃每个CH2的燃烧热:658.6 KJ/mol
7
1
6
2
5
43
二环[2. 2. 1]庚烷
bicyclo[2. 2. 1]heptane
7
6
5
4
1 2
3
2, 7, 7-三甲基二环[2. 2. 1]庚烷
2, 7, 7-trimethylbicyclo [2. 2. 1]heptane
9
2
1
3
8 6
4
7
5
2
1
6
8-甲基二环[4. 3. 0]壬烷
2, 6, 6-三甲基二环[3.1.1]庚烷
1
H H4
56
H H
H
H
H
H
H H3
4
H H
H
5
1H
6
2H
H
C4-C3
C6-C1
交叉式
2.50nm
H
H
HH
H~H之间距离均大于
HH H
H H
H
2.49nm
H
H的Van der Waal’s半
H
2.49nm 径之和(2.40nm )
®山东农业大学化学学院
环己烷椅式构象的画法
H H
HH
H
H
H
H
H
HH
H 0.252nm H
H 凡与通过分
子中心的假 想垂直轴平 行的C—H键
H
H
H
®山东农业大学化学学院
平伏键[e键] Cyclohexane (equatorial bonds)
凡与垂直轴成109。 28’的C-H键e键
H H
H
H H
H
®山东农业大学化学学院
两种类型C-H键
a键 (axial bond) 竖键, 直键, 直立键
CH3CH2CH3 (打开一根 C-C 键)
2
2
H2 / Pt, 50oC
CH3
3 1 CH2CH3 or Ni, 80oC
3 CH3CHCH2CH3
1
主要产物
H2 / Pt, 120oC or Ni, 200oC
CH3CH2CH2CH3
支链 多较 稳定
Pd
H2
>300℃
ቤተ መጻሕፍቲ ባይዱ
CH3CH2CH2CH2CH3
(单)环烷烃
通式:CnH2n
(与烯烃通式相同)
桥环烃(稠环)
桥环烃
螺环烃
®山东农业大学化学学院
小 环 ( C3、 C4)
按环大小
普 通 环 ( C5-C 7) 中 环 ( C8- C12) 大 环 ( >C12)
环数:使环状化合物变 成开链化合物所需打破 的碳碳键的数目。
按环数
单环: 如
CH2 CH2 CH2
8-methylbicyclo[4. 3. 0]nonane 2,6,6-trimethylbicyclo[3.1.1]heptane
®山东农业大学化学学院
7
4
5
3
1
6
2
用","隔开 三环[2. 2. 1. 02, 6]庚烷 tricyclo[2. 2. 1. 02, 6]heptane
®山东农业大学化学学院
第三章 环烷烃
主要内容: ➢环烷烃类型与命名 ➢三元和四元环化合物的反应活性 ➢ 环丙烷和环丁烷的构象 ➢环己烷及其取代化合物的构象(椅式、船式、半 椅式和扭船式构象)及其相对稳定性,a键和e键
®山东农业大学化学学院
环烷烃:碳干为环状而性质与开链烷烃相似的烃类。
§3.1 环烷烃的异构和命名
一、分类 环烷烃的类型
®山东农业大学化学学院
例题:如何将丙烷、丙烯、环丙烷区别开?
解: 1、各取少许上述三种溶液,分别加入高锰酸钾的酸性溶液, 使其褪色的是丙烯。
2、另取剩余两种溶液,分别加入溴水,使其褪色的是环丙 烷。余下的是丙烷。
例题:如何将环丙烷、环丁烷和环戊烷区别开? 解:各取少许上述三种溶液,分别加入溴水,使其褪色的是环 丙烷,加热后退色的是环丁烷,不退色的是环戊烷。
二、化学性质 饱和环烷烃对强酸、强碱、强氧化剂稳定
自由基取代反应(普通脂环烃具有开链烃的通性 )
Br2
30 0 ℃
CH3
光
Cl2
Br HBr
CH3
Cl
HCl
®山东农业大学化学学院
小环化合物的特殊性质 —— 易开环加成
➢ 小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80oC
三、燃烧热和非平面结构
✓ 环丙烷:平面结构 ✓其它环烷烃:非平面结构 ✓ 燃烧热:此处用每个CH2单元的平均燃烧热,与开链烷烃
每个CH2单元平均燃烧热的差值×n来表示分子的张力能。
®山东农业大学化学学院
环的大小与稳定性
环烷烃的燃烧热数据
小 C3 环 C4
普 C5 通 环 C7
每个CH2的燃烧 (KJ/mol)
®山东农业大学化学学院
§3.4 环的张力
一、Baeyer张力学说(1885年)
®山东农业大学化学学院
sp3 碳原子键角应为109。28’, 任何与此正常键角的偏 差,都会引起分子的张力,这种张力具有力图恢复正 常键角的趋势。我们把这种张力叫角张力。
60。
90。
角偏差 49。28' 19。28'
108。
®山东农业大学化学学院
三、环烷烃的结构
1. 环丙烷的结构
H
平面型
H3
2
H
H
1
H
H
角张力(angle strain):
环的角度与sp3轨道夹角差 别引起的张力
H3 H
C1-C2
2
H H
1 HH
Newman投影式
所有C-H 键均为 重叠式构象,有 扭转张力
环丙烷为张力环,采取重叠式构象,所以容易破环。此外,环丙烷C-C 键为弯曲键,有点类似于烯烃的键,可以发生类似于烯烃的加成反应。
H H
HH
H
H
H
H
H
HH
H
H H
H H
H H
H H
e键 (equatorial bond) 横键, 平键, 平伏键
®山东农业大学化学学院
转环作用
一个椅式构象通过C-C键的转动变为另外一个 椅式构象,这种构象的互变,叫转环作用。
®山东农业大学化学学院
a键和e键的相互转换
H
H
3
H
H
4
H 2H
56
1
二环[4. 4. 0]癸烷
bicyclo[4. 4. 0]decane
