有机化学-环烷烃
有机化学环烷烃

有机化学环烷烃在有机化学的广袤领域中,环烷烃是一类具有独特结构和性质的化合物。
它们就像是化学世界里的“小圈圈”,有着自己独特的魅力和价值。
环烷烃,简单来说,就是碳原子通过单键连接形成环状结构的烃类化合物。
与我们熟悉的直链烷烃相比,环烷烃的环状结构赋予了它们一些与众不同的特点。
从结构上看,环烷烃的碳原子排列成环。
环的大小可以不同,常见的有三元环、四元环、五元环等等。
环的大小对环烷烃的稳定性有着重要的影响。
比如,三元环和四元环由于环张力较大,相对来说不太稳定,容易发生开环反应。
而五元环和六元环则相对稳定得多。
稳定性的差异导致了它们在化学反应中的表现各不相同。
以开环反应为例,小环烷烃在一定条件下能够与氢气、卤素等发生开环加成反应。
这是因为小环烷烃的环张力使得它们的化学键相对更容易被打开,从而与其他物质发生反应。
而大环烷烃则相对较难发生这样的反应。
环烷烃的物理性质也有其特点。
一般来说,环烷烃的沸点和熔点比相同碳原子数的直链烷烃要高。
这是因为环状结构使得分子间的接触更为紧密,相互作用增强,从而需要更高的温度来打破这种相互作用。
在实际应用中,环烷烃有着广泛的用途。
在石油化工领域,环烷烃是重要的原料。
通过一系列的化学反应,可以将它们转化为各种有用的化学品,如溶剂、润滑油等。
在医药领域,一些含有环烷烃结构的化合物具有特定的生物活性,被用于药物的研发和制造。
让我们更深入地了解一下环烷烃的命名规则。
对于简单的环烷烃,通常以“环”字开头,然后根据环上碳原子的数目称为“环某烷”。
如果环上有取代基,则要按照一定的顺序为取代基编号,以表明它们在环上的位置。
再来看看环烷烃的同分异构体。
由于环的结构可以有多种变化,所以相同碳原子数的环烷烃可能存在多种同分异构体。
比如,C₅H₁₀就有环戊烷和甲基环丁烷等多种同分异构体。
环烷烃的存在和性质对于我们理解有机化学的整体框架有着重要的意义。
它们不仅丰富了有机化合物的种类,也为我们研究和应用有机化学提供了更多的可能性。
有机化学-环烷烃

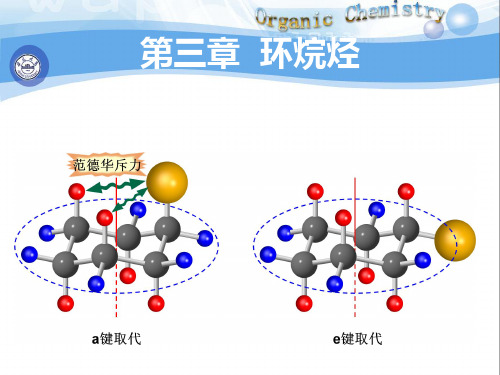
得到的构型与原来的构型一样。 椅式C-H键的分类: 6个直立键:3个朝上,3个朝下。
23
都叫a键。平行于C3轴。
6个平伏键:3个朝上,3个朝下。
都叫e键,与直立键成109°28/。
结论:
C3
①. 椅式是环己烷的最稳定的构象,在各种构象的
平衡混合物中,椅式占99.9%。 因为在椅式构象中,相邻两个碳原子上C-H键都
1. 物理性质(自学) 2. 化学反应 1). 取代反应
+ Br2
hν
Br
+ HBr
机理:自由基机理 取代反应一般在五、六元环上易发生。
12
2). 加成反应 小环易发生加成反应。
①. 加 H2
+ H2
Ni
+ H2 + H2
② . 加 X2
40℃ Ni CH CH CH CH 3 2 2 3 100℃
16
三. 环烷烃的稳定性 (Stability of Cycloalkanes)
为什么三元环不稳定易发生加成?
为什么五元环、六元环较稳定不易发生开环加成,而易
发生取代? 1. 拜尔(Baeyer )张力学说要点
①. 形成环的碳原子都在同一平面上,并排成正多边形。 ②. 正常C-C键之间夹角为109.5°,环中C-C键之间夹
第三章 环烷烃
主讲:徐华
一. 环烷烃的分类、命名和异构 二. 环烷烃的物理性质和化学反应 三. 环烷烃的稳定性 四. 环烷烃的构象
2
一. 环烷烃的分类、命名和异构 概述:单环环烷烃通式:CnH2n 1. 分类
,
与烯烃互为异构体。
环烷烃的性质与烷烃相似。
小环:3~4个碳原子。 普通环:5~7个碳原子。 单环体系 中环:8~11个碳原子。 大环:12个以上碳原子。 螺环:两个环公用一个碳原子,公用的碳叫螺碳。 多环体系 桥环:两个环公用两个或两个以上碳原子。
有机化学 第三章 环烷烃
张力学说( 一、Baeyer张力学说(strain theory) 张力学说 )
假定成环碳原子都在同一平面上 并排成正多边形。 同一平面上, ※ 假定成环碳原子都在同一平面上,并排成正多边形。 碳原子间的夹角必偏离正常键角。这种由于键角偏离 碳原子间的夹角必偏离正常键角。 正常键角而引起的张力称为角张力。 正常键角而引起的张力称为角张力。 角张力 。 碳环中碳原子键角偏离正常键角越大,角张力越大, ※ 碳环中碳原子键角偏离正常键角越大,角张力越大, 分子越不稳定,反应活性也越大。 分子越不稳定,反应活性也越大。
E
CH3 CH3 CH CH3
CH3 CH3
1
4-甲基环己烯 5-乙基-1,3-环己二烯 - -乙基- , -
顺-1,3-二甲基环丁烷 , -
第二节 环烷烃的性质
一、物理性质
n = 3,4 , 气态 n=5 ※状态 液态 n≥6 固态 ※m.p.: 环烷烃比直链烷烃能够更紧密地排列于晶格中 .: 同数碳原子的直链烷烃。 故m.p.>同数碳原子的直链烷烃。 同数碳原子的直链烷烃 0.688<d<0.853 ※d: 环烷烃不溶于水 ※s: 环烷烃不溶于水
在不同的环烃中键角大于或小于109° ,而正常的SP ※在不同的环烃中键角大于或小于 °28′,而正常的 3 杂化轨道之间的夹角为109°28′即C-C之间的电子云没有达 ° 即 - 之间的电子云没有达 杂化轨道之间的夹角为 到最大程度的重叠。 到最大程度的重叠。 1
( 109 °2 8′- 6 0°) = 24°64′ - ) 2 1 ( 1 09°28 ′- 90 °) = 9 °44 ′ - ) 2 1 ( 109 °2 8′- 1 08°) = 0°44′ - ) 2 1 1 09°28′- 120 °) = -5°1 6′ - ) 2(
第二节_环烷烃
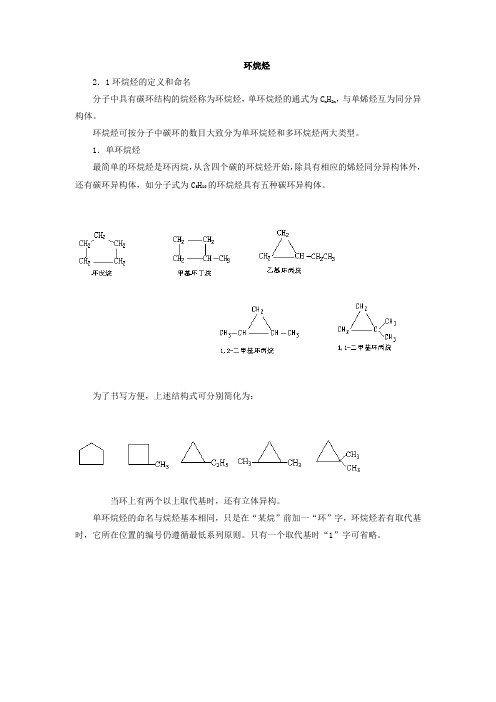
环烷烃2.1环烷烃的定义和命名分子中具有碳环结构的烷烃称为环烷烃,单环烷烃的通式为C n H2n,与单烯烃互为同分异构体。
环烷烃可按分子中碳环的数目大致分为单环烷烃和多环烷烃两大类型。
1.单环烷烃最简单的环烷烃是环丙烷,从含四个碳的环烷烃开始,除具有相应的烯烃同分异构体外,还有碳环异构体,如分子式为C5H10的环烷烃具有五种碳环异构体。
为了书写方便,上述结构式可分别简化为:当环上有两个以上取代基时,还有立体异构。
单环烷烃的命名与烷烃基本相同,只是在“某烷”前加一“环”字,环烷烃若有取代基时,它所在位置的编号仍遵循最低系列原则。
只有一个取代基时“1”字可省略。
当简单的环上连有较长的碳链时,可将环当作取代基。
如:2.多环烷烃含有两个或多个碳环的环烷烃属于多环烷烃。
多环烷烃又按环的结构、位置分为桥环、螺环等。
(1)桥环两个或两个以上碳环共用两个以上碳原子的称为桥环烃,两个或两个以上环共用的叔碳原子称为“桥头碳原子”,从一个桥头到另一个桥头的碳链称为“桥”。
桥环化合物命名时,从一个桥头开始,沿最长的桥编到另一个桥头,再沿次长的桥编回到起始桥头,最短的桥最后编号。
命名时以二环、三环作词头,然后根据母体烃中碳原子总数称为某烷。
在词头“环”字后面的方括号中,由多到少写出各桥所含碳原子数(桥头碳原子不计入),同时各数字间用下角圆点隔开,有取代基时,应使取代基编号较小。
例如:1,2,7-三甲基-双环[2.2.1]庚烷双环[4.4.0]癸烷双环[2.2.1]庚烷(2)螺环脂环烃分子中两个碳环共用一个碳原子的称为螺环烃,共用的碳原子为螺原子。
命名时根据成环的碳原子总数称为螺某烷,编号从小环开始,经过螺原子编至大环,在“螺”字之后的方括号中,注明各螺环所含的碳原子数(螺原子除外),先小环再大环,数字间用下角圆点隔开。
有取代基的要使其编号较小。
例如:5-甲基螺[3.4]辛烷 1,6-二甲基螺[3.5]壬烷2.2环烷烃的物理性质在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为液体。
有机化学03环烷烃

CH3
有不同取代基时,大基团 处于e键的构象为优势构象。
H 3C H 3C H 3C C H H CH3
H3C H
CH3 C
CH3 H CH3
(t-Bu,e; Me,a)优势构象
(t-Bu,a; Me,e)
trans-1-甲基-3-叔丁基环己烷 trans-1-tert-Butyl-3-methylcyclohexane
环戊烷的构象:
C:sp3杂化, 轨道夹角109.5° 正五边形内角为108° 角张力:109.5-108=1.5° 可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五个碳 原子亦不共平面,而是以“信封 式”构象存在,使五元环的环张 力可进一步得到缓解。
反-1, 3-二乙基环戊烷
环烷烃的结构与稳定性
(一)环烷烃的稳定性与环大小的关系
1、稳定性:
<
<
,
…...
2、环烷烃稳定性大小的解释:
(1)Baeyer 张力学说 (2)“弯曲键”理论。 “弯曲键”理论是Baeyer 张力学说现代解释。
拜尔张力学说(A.von Baeyer 1885年)
① ② 假设成环所有的碳原子都在同一平面上,构成正多边形。 。 假设所有键角为109 28′(即四面体结构)。
CH3 H3C H CH3 H H3C H H CH3 CH3 H CH3
H3C
H
顺(cis): 两个取代基在环同侧;
反(trans):两个取代基在环异侧。
顺-1, 4-二甲基环己烷
反-1, 4-二甲基环己烷
思考题
C2H5
H
H
有机化学:第五章 环烷烃

? CH3 C CH3 CHC3H3
CH3 H3C CHC3H3
e, a构象
e, a构象
33
1,3-二取代环己烷的构象
CH3
CH3
CH3 CH3
CH3 CH3
e, a构象
CH3 CH3
H3C
CH3
a, a构象
e, e构象,优势
34
小结:
1°环己烷有两种极限构象(椅式和船式),椅式为优势构象。 2°一元取代基主要以e键和环相连。 3°多元取代环己烷最稳定的构象是e键上取代基最多的构象。 4°环上有不同取代基时,大的取代基在e键上构象最稳定。
1885年,Baeyer提出了张力学说(strain theory):
a. 形成环的C原子都在同一平面上,并排成正多 边形; b. 在不同环中C-C键之间的夹角小于或大于正四 面体所要求的角度:109°28′; c. 环中C-C键键角的变形会产生张力,键角变形 的程度越大,张力越大,环的稳定性低,反应活 性越大。
+
Cl2
+
Cl2
+
Cl2
+
Br2
+
Cl2
hv hv 300 oC hv hv
Cl Cl
Cl Br
Cl
10
氧化反应
KMnO4
O + CO2H
O3
( Z)
Zn/H2O
OHC
CHO
11
中小环的加成反应
加氢反应
+
H2
+
H2
+
H2
Ni 80 oC
Ni 100 oC
Pt 300 oC
环烷烃的结构通式

环烷烃的结构通式环烷烃是一类分子中含有环状碳结构的有机化合物。
其中,碳原子按照一定的方式连接形成了环状结构。
环烷烃的通式可以表示为CnH2n,其中n代表碳原子数。
根据碳原子数的不同,环烷烃可以分为多个系列,每个系列的特点和应用都有所不同。
我们来看看最简单的环烷烃——环丙烷。
环丙烷是由三个碳原子组成的环状分子,其化学式为C3H6。
由于环丙烷的分子结构中没有任何取代基或双键,因此它是一种饱和的烷烃。
环丙烷常用作溶剂和燃料。
接下来,我们来看看四碳环烷烃——环丁烷。
环丁烷的化学式为C4H8,它是由四个碳原子组成的环状分子。
环丁烷也是一种饱和的烷烃,常用作燃料和溶剂。
在五碳环烷烃中,最常见的是环戊烷。
环戊烷的化学式为C5H10,它是由五个碳原子组成的环状分子。
环戊烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
六碳环烷烃中,最常见的是环己烷。
环己烷的化学式为C6H12,它是由六个碳原子组成的环状分子。
环己烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
七碳环烷烃中,最常见的是环庚烷。
环庚烷的化学式为C7H14,它是由七个碳原子组成的环状分子。
环庚烷也是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
八碳环烷烃中,最常见的是环辛烷。
环辛烷的化学式为C8H16,它是由八个碳原子组成的环状分子。
环辛烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
九碳环烷烃中,最常见的是环壬烷。
环壬烷的化学式为C9H18,它是由九个碳原子组成的环状分子。
环壬烷也是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
十碳环烷烃中,最常见的是环癸烷。
环癸烷的化学式为C10H20,它是由十个碳原子组成的环状分子。
环癸烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
除了以上所述的环烷烃,还存在着更多碳原子数较大的环烷烃。
它们的结构和性质也各不相同,但都具有环状结构。
总结起来,环烷烃是一类碳原子按照环状连接形成的有机化合物。
第二章环烷烃

97%
C(CH3)3
C(CH3)3
3%
> 99.9% 从上述三个实验事实可看出:取代基体积越大, 取代占的 从上述三个实验事实可看出:取代基体积越大, e取代占的 比例越大。 比例越大。
2). 多取代环己烷的构象 结论: 多取代环己烷, 取代基最多的构象最稳定 取代基最多的构象最稳定。 结论:①. 多取代环己烷, e取代基最多的构象最稳定。 多取代环己烷, 体积较大的取代基为e型的构象 ②. 多取代环己烷, 体积较大的取代基为 型的构象 最稳定。 最稳定。 二甲基环己烷的最稳定构象。 例1:写出顺 :写出顺-1,2-二甲基环己烷的最稳定构象。 二甲基环己烷的最稳定构象
1-甲基 叔丙基环己烷 甲基-4-叔丙基环己烷 甲基
CH3 CH3
顺-1,2-二甲基环丙烷 二甲基环丙烷
H H
H CH3
CH3
反- 1,3-二甲基环戊烷 二甲基环戊-3-叔丙基环戊烷 反-1-乙基 叔丙基环戊烷 乙基 2). 多环烃 螺环烃: 确定母体:螺某烷(由螺环中总碳数确定)。 螺环烃 ①. 确定母体:螺某烷(由螺环中总碳数确定)。 编号:先编小环后编大环。 ②. 编号:先编小环后编大环。从小环中和螺碳相 邻的碳开始编号,使取代基位次最小。 邻的碳开始编号,使取代基位次最小。 写法: ③.写法: 写法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
CH3
H
H
H3C H
CH3 H
H3C
CH3
顺-1,3-二甲基环戊烷 (cis-1, 3-dimethylcyclopentane)
CH3 H H3C
H
镜
H
面
CH3
CH3
CH3
H3C
CH3
顺反异构体
H CH3
➢ 顺反异构用“顺” 或“反”注明基团相 对位置。 英文用 “cis”和“trans”表示。
萘 naphthalene
O
莰烷
2-莰酮(樟脑)
camphane camphor
§3.2 环烷烃的物理性质和化学反应
一、物理性质
环烷烃的bp. mp.和相对密度比同碳原子数的直链烷烃高。 例题:将下列化合物按沸点降低的顺序排列: (1)丁烷(2)己烷(3)3-甲基戊烷 (4)2-甲基丁烷(5)2,3-二甲基丁烷(6)环己烷
解:(6)(2)(3)(5)(4)(1)
二、化学性质 饱和环烷烃对强酸、强碱、强氧化剂稳定
自由基取代反应(普通脂环烃具有开链烃的通性 )
Br2
30 0 ℃
CH3
光
Cl2
Br HBr
CH3
Cl
HCl
小环化合物的特殊性质 —— 易开环加成
➢ 小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80oC
环烷烃:碳干为环状而性质与开链烷烃相似的烃类。
§3.1 环烷烃的异构和命名
一、分类 环烷烃的类型
(单)环烷烃
通式:CnH2n
(与烯烃通式相同)
桥环烃(稠环) 桥环烃
螺环烃
小 环 ( C3、 C4)
按环大小
普 通 环 ( C5-C 7) 中 环 ( C8- C12) 大 环 ( >C12)
环数:使环状化合物变 成开链化合物所需打破 的碳碳键的数目。
按环数
单环: 如
CH2 CH2 CH2
(环丙烷)、
(环己烷)
二环:如
(十氢萘)又叫二环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如
按环的连接方式 桥环:共有2个或 以上碳原子如
二、命名:与烷烃命名相似
普通环烷烃的命名
环丙烷
环己烷
cyclopropane cyclohexane
反-1,3-二甲基环戊烷(两者为对映异构体) (trans-1, 3-dimethylcyclopentane)
43
环丙基环己烷 cyclopropylcyclohexane
2
2'
1 1'
3
3'
联环丙烷 bicyclopropane
3-甲基-4-环丁基庚烷 4-cyclobutyl-3-methylheptane
H2O H2SO4
H
OH
CH2CH2CH2
2
3
1 CH3
HI
H
I
CH2CHC2 H CH3
3 21
反应选择性 与碳正离子稳定性有关
氧化反应
CH
=
CH 3 C
CH3
K M nO4
COO H
CH3 C=O CH 3
区别:环丙烷对氧化剂(如高锰酸钾)稳定,而烯烃易被氧化。
例题:如何将丙烷、丙烯、环丙烷区别开?
➢ 环可作为取代基 (称环基) ➢ 相同环连结时,可
用词头“联”开头。
桥环烃(Bridged hydrocarbon)的命名
桥环:两个或两个以上碳环共用两个以上碳原子
桥头碳原子
10 2
9
1
3
8
6
4
7
5
十氢萘
环的数目
桥头间的碳原子数
(用"."隔开)
二环[4. 4. 0]癸烷
bicyclo[4. 4. 0]decane
7
4
5
3
1
6
2
用","隔开 三环[2. 2. 1. 02, 6]庚烷 tricyclo[2. 2. 1. 02, 6]heptane
螺环烃(spiro hydrocarbon)的命名
螺环:两个碳环共有一个碳原子
2
16
7
5
8
3
4 10 9
1
4
5
3
2
6
7
螺[4. 5]癸烷 spiro[4. 5]decane
7
6
5
4
1 2
3
2, 7, 7-三甲基二环[2. 2. 1]庚烷
2, 7, 7-trimethylbicyclo [2. 2. 1]heptane
9
2
1
3
8 6
4
7
5
2
1
6
8-甲基二环[4. 3. 0]壬烷
2, 6, 6-三甲基二环[3.1.1]庚烷
8-methylbicyclo[4. 3. 0]nonane 2,6,6-trimethylbicyclo[3.1.1]heptane
除螺C外的碳原子数 (用"."隔开)
组成螺环的 碳原子总数
4-甲基螺[2. 4]庚烷 4-methylspiro[2. 4]heptane
➢ 编号从小环开始 ➢ 取代基数目取最小
环烷烃的其它命名方法 :
➢按形象命名 ➢按衍生物命名
立方烷 cubane
金刚烷 adamantane
十氢萘
Decahydronaphthalene
CH3
甲基环丙烷 methylcyclopropane
➢ 以环为母体,名称用 “环” (英文用 “cyclo”)开头。
➢ 环外基团作为环上的取 代基
1
1
2
2 3
➢ 取代基位置数字取最小
3 4
1, 3-二甲基环己烷
1, 3-dimethylcyclohexane
1-甲基-4-异丙基环己烷
4-isopropyl-1methylcyclohexane
组成桥环的 碳原子总数
✓桥 头 碳:几个环共用的碳原子, ✓环的数目:断裂二根C—C键可成链状烷烃为二环;断裂三根C—C
键可成链状烷烃为三环 ✓桥头间碳原子数:不包括桥头C,由多到少列出 ✓环的编号方法:从桥头开始,先长链后短链
7
1
6
2
5
43
二环[2. 2. 1]庚烷
bicyclo[2. 2. 1]heptane
➢ 小环化合物与卤素的反应
Br2 / r.t. Cl2 / FeCl3
Br2 / r.t.
Br
Br
CH2CH2CH2
Cl
Cl
CH2CH2CH2
(离子型)加成反应
不反应(难开环)
注意区分:
C l2 / hv
自由基取代反应
C l
➢ 小环化合物与 HI 或 H2O/ H2SO4的反应
HI
H
I
CH2CH2CH2
CH3CH2CH3 (打开一根 C-C 键)
2
2
H2 / Pt, 50oC
CH3
3 1 CH2CH3 or Ni, 80oC
3 CH3CHCH2CH3
1
主要产物
H2 / Pt, 120oC or Ni, 200oC
CH3CH2CH2CH3
支链 多较 稳定
Pd
H2
>300℃
CH3CH2CH2CH2CH3
解: 1、各取少许上述三种溶液,分别加入高锰酸钾的酸性溶液, 使其褪色的是丙烯。
2、另取剩余两种溶液,分别加入溴水,使其褪色的是环丙 烷。余下的是丙烷。
例题:如何将环丙烷、环丁烷和环戊烷区别开?
