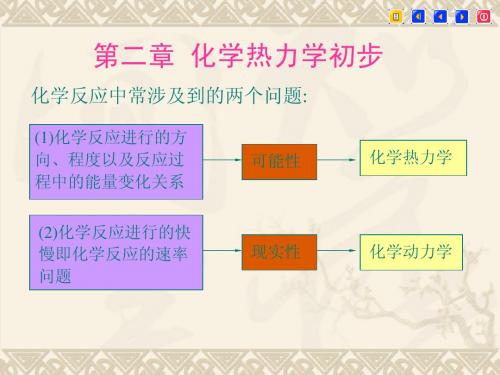
化学热力学初步
第二章---化学与热力学

对于有限变化:
dH =δQp,W 0
对于不做非体积功、等 压过程,体系的焓变在 数值上等于反应热效应。
H Qp,W 0
放热反应 △H < 0
吸热反应 △H > 0
2、等容热效应
对气相反应 : aA + bB = dD + eE 由
δQ dU psu dV
等容过程: △U= Qv 因为: △H = Qp 故: △H =△U+ △ n· RT 或: QP= Qv+ △ n · RT 其中: △ n =(d + e)–(a +b) 对固、液相(凝聚相)反应: △H ≈△U
例如:
2)标准燃烧焓 c Hm
在温度T 时,B 完全燃烧时的标准摩尔焓变 ---- B 的标准摩尔燃烧焓 燃烧热计算反应的标准焓变:
ΔrHo =∑ΔcHo反应物 - ∑ΔcHo 产物
第三节
化学反应的方向性
一、热力学第二定律 1、自发过程 不需外力能发生的过程 ---- 自发过程 自发过程的特点 --- 1) 单向性 (逆向不自发 ??)
ΔH < 0
ΔH > 0
ΔH
Ag+ (aq) + Cl-
×
ΔSo > 0
(aq)
O2 (g) + C (s) = CO2(g)
= AgCl (s) ΔSo <0
ΔS
×
37
二、化学反应的Gibbs自由能变
(一)Gibbs自由能(G)
定义: G = H –TS = U + PV - TS (G 为状态函数) 意义:是体系等温等压下做非体积功的能力。 反应过程G的减少量( -△G)是体系能做的最大非膨 胀功,即自由能降低的方向就是反应自发的方向。
2化学热力学初步(1)

化学热力学初步学号姓名一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画)1、系统的焓等于系统的热量。
...................... .................. .........................()2、在恒温恒压下,某化学反应的热效应Q p=△H=H2-H1,因为H是状态函数,故Q p也是状态函数。
............................................................ ....................()3、已知298K时,△f Gθm(SbCl5,g)=-334.3kJ·mol-1,△f Gθm(SbCl3,g)=-301.0kJ·mol-1,则反应SbCl5(g)→SbCl3(g)+Cl2(g)在298K、标准状态下不能自发进行。
....................()4.如果一个反应的△r Hθm和△r Sθm均为正值,当温度升高时,△r Gθm将减小.................()5.冰在室温下自发地融化成水,是熵增起了主要作用。
..................................()6、如果一个反应的△r Hθm和△r Sθm均为正值,当温度升高时,△r Gθm将减小................()二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)1、已知反应C2H2(g)+5/2 O2(g)→2CO2(g)+H2O(l)的△r Hθm (1)=-1301.0kJ·mol-1,C(s)+O2(g)→CO2(g)+H2O(l)的△r Hθm (2)=-393.5kJ·mol-1,H2(g)+1/2 O2(g)→H2O(l)的△r Hθm (3)=-285.8kJ·mol-1,则反应2C(s)+H2(g)→C2H2(g)的△r Hθm为.......................... .....................................()。
第3章化学热力学初步2010崔爱莉第1节_95909079

6. 热力学能(内能U):系统内部各种能量的总和 • 包括体系内分子运动的动能、分子间相互作用能及分子中 原子、电子运动能等。 • U是状态函数,无绝对数值。 U = U2U1
7. 相: 体系中物理性质和化学性质完全相同的任何均匀部分
* 相和相之间有明显的界面 * 相与聚集态不同。 * 相数与物质种类数。
热力学第一定律数学表达式:△U=Q + W
对于封闭体系,体系内能的变化(△U)等于体系从环 境所吸收的热量(Q)加上环境对体系所做的功(W)。
Q
U1
U2
W
△U:(+) 内能增加,(-) 内能减少 Q : (+) 吸热 , (-)放热 W : (+) 环境对体系做功, (-)体系对环境做功
12
3.1.3 反应进度
•若外压p=0或体积改变量ΔV=0时,体积功W =0。 •本章研究的体系都是只作体积功,不做非体积功的过程。
对于恒温(T)恒压(p)下理想气体参加的反应: W =-p外ΔV = -ngRT
16
例:2H2(g)+O2(g) =2H2O(l) ,求298K时标准状态下2mol的 H2与1mol 的O2生成2mol 的H2O(l) 反应所作体积功W。
2.0
t2时 nB/mol 1.5 5.5
3.0
rHm = 92 kJ·mol-1
1 ? 2 ?
1
n1N2 N2
(2.0 3.0)mol 1
1.0mol
1
n1H2 H2
(7.0 10.0)mol 3
1.0mol
1
n1NH 3 NH 3
(2.0 0)mol 2
1.0mol
始态
无机化学(人卫版)第五章化学热力学基础
CO 2 (g)
mol △ rHm (2) = -282.98kJ· -1 计算298.15K下,下列反应的反应热:
1 O2 (g) C(s) 2
CO(g) △ rHm (3)
解法一: (利用 △ rHm (1) 由始态 CO2 g 到终态 途径1 的不同 途径)
2
解:利用Hess定律 △ rHm (3) C(s) O (g )
B —物质B的化学计量数
B为物质B的化学计量数,其量纲为一,反应物的
化学计量数为负值,而生成物的化学计量数为正值。
νA=-a, νB=-b, νY=y, νZ=z 。
例: 反应 1/2N2 + 3/2H2 = NH3 化学计量数 B分别为:
(NH3) = 1 ,(N2)= 1/2, (H2) = -3/2
mol △ rHm (298.15K) = -571.66kJ· -1
△ • 化学计量数不同时, rHm 不同。 1 H2(g)+ O2(g) H2O(g) 2 mol △ rHm (298.15K) = -241.82kJ· -1
2.3.3 盖斯(Hess)定律 △ rHm 始态 终态
△ rHm,1 △ rHm,2
结论: aA + bB → yY + zZ
rHm(T)
=Σν B fHm(生成物) +Σ νBfHm(反应物)
= Σν B fHm(B)
§2.4 热力学第二定律
2.4.1 化学反应的自发性
•水从高处流向低处; •热从高温物体传向低温物体;
•铁在潮湿的空气中锈蚀;
•锌置换硫酸铜溶液反应: Zn(s)+Cu2+(aq)
解: 该反应在恒温恒压下进行,所以
化学热力学

第 二 章 化 学 热 力 学 初 步
3、掌握化学反应的标准摩尔焓变(standard molar enthalpy change)的各种 计算方法;(标准生成热( standard heat of formation )、燃烧热 (standard heat of combustion)。)
4、掌握化学反应的标准摩尔熵变(standard molar entropy change)和标 准摩尔吉布斯自由能变(standard molar Gibbs free energy change) 的计算方法; 5、会用ΔG来判断化学反应的方向,并了解温度对ΔG的影响。
不 可 逆 途 径 和 可 逆 途 径 的 功 和 热
第 二 章 化 学 热 力 学 初 步
2.1 热力学第一定律
*对于理想气体来说,热力学能U只是温度的函数,
第 二 章 化 学 热 力 学 初 步
根据热力学第一定律,比较不同途径时的功和热, 必然有如下结论: 理想气体恒温膨胀过程中,以可逆途径进行 时,体系对环境做的功最大,吸收的热量最多; 恒温压缩过程中,以可逆途径进行时,环境对体 系做的功最小,体系放出的热量最少。
2.1 热力学第一定律
3. 过程和途径(process and pathway)
方式 途径 过程 状态
第 二 章 化 学 热 力 学 初 步
基 本 概 念
过程 状态1 途径1 状态2
途径2
平衡状态
2.1 热力学第一定律
热力学中常见的过程 等温过程(isothermal process) :T1=T2=T环 等压过程(isobaric process):p1=p2=p环 等容过程(isochoric process):V1=V2 绝热过程(adiabatic process):Q=0 循环过程(cyclic process): 可逆过程*(reversible process):它是一种在无限接近于 平衡,并且没有摩擦力条件下进行的理想过程。 自发过程 (spontaneous process) : 一定条件下,自动进 行的过程。
工科基础化学-热力学

热量计的种类
保温瓶 常用于测量在溶液中进行的化 学反应的热效应。 常在等压下操作,测量的热效 应是化学反应的等压热效应。
(a) 绝热热量计
(b) 冰热量计
有冰水混合物的密闭容器 反应所释放的热使0℃的冰融 化为0℃的水 测量反应前后冰水混合物的 体积差,可求得反应的热效应。 是等温热量计,能直接测得 等温条件下的反应热效应
化学变化时发生系统与环境间的能量转换和传递 → → 系统内能的变化
3.1.5 过程(process)和途径(approach) 过程:系统状态发生的任何变化
等温过程 (isothermal):T始= T终 等压过程 (isobar) : 压力恒定 等容过程 (isovolume): 容积恒定 绝热过程 (adiabatic) : q = 0
与反应热测量有关的两个问题
常用钢弹热量计测得的热效应是qv ,如何求算qp ?
有些反应的热效应难以测量,例如:碳不完全燃烧而生 成CO时,总有CO2生成,有关反应的热效应如何求得?
反应热效应的理论计算
3.3.3.1 qp与qv的关系
qv :反应在弹式热量计中进行时所测得的反应热效应 qp :反应在敞口容器中(大气压、定压)进行时所测得的反应
(c)弹式热量计
基本条件: 耐高压的密闭容器 能吸收热量的介质 常用的弹式热量计:钢 弹/水 测量的热效应是化学反 应的等容热效应。
3.3.2 化学反应的反应热与焓
3.3.2.1 恒容过程反应热
恒容变化过程: V 0
体积功为零(W=0)
UV q W qV
在恒容条件下(密闭容器)进行的化学反应,其反 应热等于该系统中热力学能的改变量
简化2: 当反应中气态反应物的化学计量数之和与气态生成物的化学计 量数之和相等时,V ≈ 0 (∵ 恒压,理想气体), qv ≈ qp
第三章:化学热力学
1 Cal = 1000 cal = 1 kcal
1. 基本概念
Systems and Surroundings 体系和环境
我们要研究的部分称为 体系; 其他所有部分称为 环境. Systems may be open, closed, or isolated. (敞开体系,封闭体系,孤立体系)
在热化学中,我们通常研究的是封闭体系closed systems— 体系与环境只有能量的交换,没有物质的交换.
Energy diagram for the for the reaction 2H2(g) + O2(g) 2H2O(l)
1. 基本概念——热和功
Relating ΔE to Heat 热 and Work 功
1. 基本概念——热和功
Sign conventions for heat and work.
答案:1)-100kJ 2) +100kJ 3) -20kJ 4) +20kJ
1. 基本概念——吸热和放热
Endothermic 吸热 and Exothermic 放热 Processes
在一个过程中体系吸收热量,此过程称为吸热 endothermic (endo- means “into”).
Heat is the energy transferred from a hotter object to a colder one.
1. 基本概念——热力学第一定律
The First Law Of Thermodynamics
能量不会消失也不会多出,体系能量减少必然伴随环境 能量增加,反之亦然。这一“能量守恒”的现象称为热 力学第一定律first law of thermodynamics.
物理化学第九章 统计热力学初步
统计热力学的基本任务
根据对物质结构的某些基本假定,以及实 验所得的光谱数据,求得物质结构的一些基本常 数,如核间距、键角、振动频率等,从而计算分 子配分函数。再根据配分函数求出物质的热力学 性质,这就是统计热力学的基本任务。
定域子系统和离域子系统
粒子(子)(particles) ——聚集在气体、液体、固 体中的分子、原子、离子等。
t r v e n
同时,其简并度等于各独立运动形式的简并度之 积:
g gt gr gv ge gn
运动自由度
对于一个具有n个原子的分子,通常有3n个自 由度,分别为: 3个平动自由度(xyz轴方向的平动) 3个转动自由度(围绕三个轴的旋转) 3n-6个振动自由度 对于线型分子,转动自由度为2(围绕线轴的 旋转可忽略),振动自由度为3n-5
系统的可能的能级分布方式有:
能级分布数
能级分布 n0
n1
n2 n3
Σni
Σniεi =9hν/2
Ⅰ 0 3 0 0 3 3×3 hν/2=9hν/2
Ⅱ 2 0 0 1 3 2×hν/2+1×7hν/2=9hν/2
Ⅲ 1 1 1 0 3 1×hν/2+1×3hν/2 +1×5hν/2=9hν/2
2.状态分布
1.分子的平动
t
h2 8m
(
nx2 a2
n2y b2
nz2 c2
)
对立方容器a=b=c,V=a3
t
h2 8mV 3 / 2
( nx2
n2y
nz2
)
量子力学中把能级可能有的微观状态数称为该 能级的简并度(degeneration),用符号g表示。 简并度亦称为退化度或统计权重。
无机化学(周祖新)习题解答第二章
第二章化学热力学初步思考题1.状态函数的性质之一是:状态函数的变化值与体系的始态与终态有关;与过程无关。
在U、H、S、G、T、p、V、Q、W中,属于状态函数的是U、S、G、T、p、V。
在上述状态函数中,属于广度性质的是U、H、S、G、V,属于强度性质的是T、p。
2.下列说法是否正确:⑴状态函数都具有加和性。
⑵系统的状态发生改变时,状态函数均发生了变化。
⑶用盖斯定律计算反应热效应时,其热效应与过程无关。
这表明任何情况下,化学反应的热效应只与反应的起止状态有关,而与反应途径无关。
⑷因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的△S大大增加。
⑸△H,△S受温度影响很小,所以△G受温度的影响不大。
2.⑴错误。
强度状态函数如T、p就不具有加和性。
⑵错误。
系统的状态发生改变时,肯定有状态函数发生了变化,但并非所有状态函数均发生变化。
如等温过程中温度,热力学能未发生变化。
⑶错误。
盖斯定律中所说的热效应,是等容热效应ΔU或等压热效应ΔH。
前者就是热力学能变,后者是焓变,这两个都是热力学函数变,都是在过程确定下的热效应。
⑷错误。
物质的绝对熵确实随温度的升高而增大,但反应物与产物的绝对熵均增加。
化学反应△S的变化要看两者增加的多少程度。
一般在无相变的情况,变化同样的温度,产物与反应物的熵变值相近。
故在同温下,可认为△S不受温度影响。
⑸错误。
从公式△G =△H-T△S可见,△G受温度影响很大。
3.标准状况与标准态有何不同3.标准状态是指0℃,1atm。
标准态是指压力为100kPa,温度不规定,但建议温度为25℃。
4.热力学能、热量、温度三者概念是否相同试说明之。
4.这三者的概念不同。
热力学能是体系内所有能量的总和,由于对物质内部的研究没有穷尽,其绝对值还不可知。
热量是指不同体系由于温差而传递的能量,可以测量出确定值。
温度是体系内分子平均动能的标志,可以用温度计测量。
5.判断下列各说法是否正确:⑴热的物体比冷的物体含有更多的热量。
第2章-化学热力学基础1
4.相
系统中物理性质和化学性质完全相同,并与其 它部分在明确界面分隔开来的任何均匀部分称为 一相(phase)。
只含一个相的系统称为均相系统或单相系统。
例如:混合气体、NaCl水溶液、金刚石等。 相可以是纯物质或均匀的混合物组成。相和组分 不是一个概念。
2 状态与状态函数
热力学中是用体系的一系列性质来规定其状态(热力学平 衡态)。
状态:
描述一个体系的一系列物理性质和化学性质的总和就称为 体系的状态。 如质量、温度、压力、体积、密度、组成、热力学能(U)、
焓(H)、熵(S)、吉布斯函数(G)等,当这些性质都有确定值 时,体系就处于一定的状态。
返回主目录 返回主目录 返回次目录 返回次目录
ξ =[n2(N2)-n1(N2)]/v(N2) =(2.0-3.0)/(-1) = 1(mol)
或ξ =[n2(H2)-n1(H2)]/v(H2)=(7.0-10.0)/(-3) = 1(mol)
或ξ=[n2(NH3)-n1(NH3)]/v(NH3)=(2.0-0)/(2)=1(mol) 可见,对于同一反应式,不论选用哪种物质表示反应进度均是 相同的。
热和功与过程紧密联系,没有过程就没有能量的传
递。热和功不是体系的状态函数.
热力学中功的分类 体积功 : 体系因体积变化抵抗外压所作的功。用-pΔV表示
非体积功:
除体积功外的所有功。如电功、机械功、表面功等.
返回主目录 返回主目录 返回次目录 返回次目录
2.2.2 内能与热力学第一定律 内能U :
2.3.1 化学反应热效应
封闭体系在不作非体积功(Wf = 0)的条件下, 热力学第一定律表示为: △U = Q + W = Q – P△V
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10
化学热力学初步
1、热力学第一定律ΔU=Q-W,由于U为状态函数,所以Q和W也是
状态函数,对吗?为什么?
2、解释下列名词
(1)体系与环境 (2)热(Q) (3)功(W)
(4)焓(H)和焓变(ΔH) (5)热力学能U
(6)恒容反应热(Qv)和恒压反应热(Qp)
3、什么叫状态函数?它具有何特性?
4、何谓热效应?测量方法有哪两种?
5、什么叫热化学方程式?书写热化学方程式要注意哪几点?
6、①无机化学中常用的反应热有哪几种:反应热的实质是什么?什么类
型的化学反应Qρ=Qν?等摩尔的NaOH与NH3·H2O溶液分别与过量的HCl
溶液中和所放热量是否相等?为什么?
②反应2N2(g)+ O2(g)=2N2O(g)在298K时,ØmrH=164KJ·mol-1求
反应的ΔU?
7、什么叫标准生成热ØmfH?什么是标准燃烧热ØmcH?
8、何谓盖斯定律?
9、什么是自发过程?自发过程有何特征?
10、用焓变判断反应的自发性为什么是不全面的?
11、什么是熵?什么是绝对熵和标准熵?其符号、单位是什么?
12、影响熵值的因素有哪些?举例说明。
13、化学反应自发性的标准是什么,举例说明。
14、什么叫Gibbs自由能?怎样用自由能的变化(ΔG)来判断反应的方
向?
15、在标准状态下Gibbs方程如何书写?
16、什么叫标准生成自由能ØmfG?
11
17、判断下列说法是否正确?为什么?
(1)ΔS为正值的反应均是自发反应?
(2)物质的量增加的反应ΔS为正值;
(3)若ΔH和ΔS均为正值,则温度上升ΔG将下降;
(4)某反应的ØmrG>0,表明该反应在任何条件下都是不自发进行的;
(5)放热反应均是自发反应;
(6)纯单质的ØmfH,ØmfG,ØmS皆为零;
(7)ΔH和ΔS基本上不随温度而变化,G也是这样;
(8)物质的温度越高,熵值越大。
18、解释下列事实:
(1)KNO2溶于水的过程是吸热的(ΔH>0)但它在水中溶解度却很大,
溶解过程可自发进行;
(2)空气中的O2(g)不能自发分离成纯的O2(g);
(3)在一个装有O2(g)的容器中充入一定量的O2(g),两种气体(理
想气体)即自动混合均匀,混合过程的ΔH=O;
(4)冰在室温下自动溶化成水。
19、已知下列热化学方程式:
Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) ØmrH=-25KJ·mol-1
3Fe2O3(s) + CO(g) = 2Fe3O4(s) + 3CO2(g) ØmrH=-47KJ·mol-1
Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) ØmrH=19KJ·mol-1
不用查表,计算下列反应的热效应ØmrH
FeO(s) + CO(g) = Fe(s) + CO2(g)
20、有0.105克H2与Cl2在一个密闭的量热器中反应,结果使量热器的温
度提高0.192℃,量热器的热容是50.09KJ/℃,求1摩尔H2与Cl2反应放出的
热量。
21、根据提供的数据计算反应2Na2O2(s)+2H2O(l)=4NaOH(s)+O2(g)的
Ø
m
rH
。如有25.0克Na2O2按照这个反应式进行反应,将释放出多少热量?
[Na2O2(s)的ØmfH =-510.9KJ·mol-1,NaOH(s)的ØmfH =-427KJ·mol-1,
H2O(l)的ØmfH =-286KJ·mol-1。]
22、利用水的生成热求1mol水在298K,100KPa时由液态变成气态所吸
12
收的热量,并与水的气化热(Q气=-40.67KJ·mol-1)作比较,结果说明了什
么?
23、在25℃和100KPa下,铝热法反应为
8Al(s) + 3Fe2O3(s)= 4Al2O3(s) + 9Fe(s)
由生成热数据计算该反应的热效应ØmrH。
24、单斜硫和臭氧都是单质,它们的ØmfH是否等于零?并说明理由。
25、已知CaS(s)+ 2O2(g)+ 2H2O(l)= CaSO2·2H2O(s)的ØmrH=
-967.8 KJ·mol-1试求CaS(s)的生成焓变[CaSO2·2H2O(s)的ØmfH=-2023
KJ·mol-1]。
26、反应2SO2(g) + O2(g)= 2SO3(g)
计算说明:1、在标准态及25℃时,反应能自发进行的原因;2、在标准
态下反应自发进行的温度范围。
27、AgNO3的分解反应为
AgNO3(s)= Ag(s) + NO2(g) +21O2(g)
计算标准态下AgNO3(s)的分解温度。
28、计算反应Cu(s) + H2O = CuO(s) + H2(g)在500K时的ØmrG,并判断反
应进行的方向。
29、求下列反应的热效应:
① AgCl(s) + Br—(aq)→AgBr(s) + Cl—(aq)
② Fe2O3(s) + 6H+(aq)→2Fe3+(aq) + 2H2O(1)
③ H+(aq)+OH+(q)→H2O(1)
30、将下列每组物质按熵值增加的顺序排列,简述理由。
①LiCl(s) NaCl(s) Li(s)
②H2(g) Sn(s) H2O(1)
③I2(g) Na(g) Cl2(g)
④K(s) Na(s) Br2(l)
31、预测下列各过程ØmrS的符号,简述理由。
① 盐从过饱和水溶液中结晶出来;
② Ag+(aq)+Cl—(aq)→AgCl(s);
③ SnO2(s)+2H2(g)→Sn(s)+2H2O(l);
13
④ C6H6(l)→C6H6(g);
⑤ 撒盐在冰上使冰熔化;
⑥ 活性炭表面吸附氧气。
32、利用键焓,原子化能(把单质或化合物分子完全拆开成为气态原子所
需要的能量)数据计算C2H5OH(1)的标准生成焓,已知C2H5OH的蒸发焓
为41.8KJ·mol-1,将计算的结果与数据表对照,讨论偏差原因。
33、已知石墨的升华焓ΔH1=717KJ·mol-1,H2的离解焓Ø2H=436KJ·mol-1,
CH4的ØmfH =-74.8KJ·mol-1, 求C—H键平均键焓。
34、根据键焓数据计算出下列反应的焓变
CH4(g)+ Cl2(g) = CH3Cl(g) + HCl(g) 。
35、①查ØmrG数据求算下述反应的ØmrG
2SO3(g)= 2SO2(g) + O2(g) ;
②问逆反应的ØmrG为多少?
③先算出反应的ØmrH,再求算ØmrG,所得的结果与①比较。
36、斜方硫和单斜硫的标准熵各为31.9J·K-1·mol-1和32.6J·K-1·mol-1,
其标准燃烧焓分别为-296.8J·K-1·mol-1与-297.14J·K-1·mol-1求算下列过程
的ØG:
S(斜方)→S(单斜) 。
37、仅以如下数据:ØmfH(NF3)=114KJ·mol-1,EN≡N= 924KJ·mol-1,
EF-F=158KJ·mol-1。计算NF3中N-F键的平均键能。
38、在弹式量热计中,氮化铌燃烧的反应式为:
NbN(s)+ 45O2(g)= 21Nb2O5(s)+ 21N2(g) ,
在198K下测得内能变化为-712.97KJ·mol-1,求此反应的焓变。
39、CH3OH的标准状态下的燃烧热为-725.6KJ·mol-1,已知:Ø2mCOfH=
-393.5KJ·mol-1,)(Ø2lHOmHf=-285.9KJ·mol-1,计算Ø2OHmCHfH。
40、CH4和C2H5OH燃烧产物都是CO2(g)和H2O(l),分别求两物质的燃
烧热。
14
41、已知1mol甲醚CH3OCH3完全燃烧生成CO2和H2O(l)时,ØmrH=
-146KJ·mol-1(298K)
。
(1)求甲醚的ØmfH
(2)由键焓估算甲醚的ØmfH并与(1)比较。
42、根据热力学数据计算BCl3在298K时饱和蒸气压及正常沸点,在298K
和ØP条件下BCl3呈液态还是气态?
