铁的氧化物及氢氧化物
高一上化学铁的单质、氧化物和氢氧化物(教师版)

知识点一: 一、铁的存在与性质1.铁的存在与冶炼存 在含量 地壳中的含量仅次于氧、硅和① ,居第② 位,游离态③ 中的铁以单质形态存在化合态以④ 价和⑤ 价化合物的形态存在赤铁矿硫铁矿磁铁矿冶炼原理用CO 还原铁矿石(如Fe 2O 3)⑥2.铁的性质(1)铁的物理性质铁有 和 。
铁能导电,但其导电性不如铜和铝。
铁能被磁体吸引。
知识精讲考点导航铁的单质、氧化物和氢氧化物(2)铁原子的结构在一定条件下,铁作为还原剂,遇强氧化剂失去3个电子生成 价铁的化合物,遇到弱氧化剂失去2个电子生成 价铁的化合物。
(3)铁与非金属单质①铁与氧气反应生成Fe 3O 4的方程式为 。
②铁与Cl 2反应生成FeCl 3的方程式为 。
(2)铁与酸反应铁与稀H 2SO 4反应的离子方程式为 。
(4)铁与盐溶液反应铁与CuSO 4溶液反应的离子方程式为 。
(5)铁与水蒸气反应实验装置实验操作及现象导管口冒出大量气泡,用小试管收集一试管气体,点燃,听到① 声,证明生成了②用火柴点燃肥皂液,听到③ 声,证明生成了④实验结论在高温下,铁能与水蒸气反应生成H 2,化学方程式为 ⑤3.人体中的铁元素人体内的含铁化合物主要分为两类,即 和 。
人体缺铁,就会发生 。
我国已实施在某些酱油中加入 的措施。
【答案】1.①铝,②四③陨铁④+2价⑤+3⑥Fe 2O 3+3CO=====高温2Fe +3CO 22.(1)延展性、导热性。
(2)+3,+2。
(3)①3Fe +2O 2=====点燃Fe 3O 4。
②2Fe +3Cl 2=====△2FeCl 3。
(2)Fe +2H +===Fe 2++H 2↑。
(4)Fe +Cu 2+===Cu +Fe 2+。
(5)①爆鸣,②H 2③爆鸣,④H 2⑤3Fe +4H 2O(g)=====高温Fe 3O 4+4H 23.能性铁、储存铁。
贫血。
铁强化剂。
【即学即练1】1.下列物质中,不能由金属跟非金属单质直接化合而成的是A.Fe3O4B.CuS C.FeCl3D.Na2O2【答案】B【解析】A.Fe3O4可以通过铁在氧气中燃烧生成,A不符合;B.铜在硫中燃烧生成Cu2S,得不到CuS,B符合;C.FeCl3可以通过铁在氯气中燃烧生成,C不符合;D.Na2O2可以通过钠在氧气中燃烧生成,D不符合;答案选B。
铁的单质、氧化物和氢氧化物++课件高一上学期化学人教版(2019)必修第一册+

Fe具有较强 的还原性
(2)实验探究铁粉与水蒸气的反应
在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行
充分的干燥处理?
提供反应所 需的水蒸气
肥皂泡燃烧, 听到爆鸣声
在高温下,铁能与水发生反应。 3Fe+4H2O(g)=高==温= Fe3O4+4H2
归纳总结
金属与水反应的规律 1.K、Ca、Na等可以和冷水作用,生成可溶性碱和氢气。 2.Mg、Al很难与冷水反应,但是可与沸水迅速反应,生成难溶性碱和氢气。 3.Zn、Fe、Sn、Pb要和高温水蒸气反应,生成不溶性氧化物和氢气。 4.Cu、Hg、Ag、Pt、Au则不与水作用。
将用黏土制成的砖坯置于窑内,先用大火将砖坯从外 向内烧透,停火,使砖和窑体慢慢冷却下来,在这个过 程中,由于空气充足,砖坯中的铁元素被氧化成Fe2O3 (棕红色)使砖呈现红色。 红砖中含的是Fe2O3;青砖中含的是Fe3O4
思考:为什么不是氧化亚铁呢? 氧化亚铁不稳定 烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天, 水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(H2和CO)他们把 Fe2O3又逐渐还原成为Fe3O4而制得青砖。
6H++Fe2O3=== 2Fe3++3H2O
Fe3O4+8H+===2Fe3+ +Fe2++4H2O
稳定性
6FeO+O2==△===2Fe3O4
稳定
稳定
与CO、C、H2反应 用途
生成单质铁及CO2或H2O Fe2O3常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要
成分是Fe2O3)是炼铁的原料
△ 2Fe(OH)3===== Fe2O3+3H2O
练习1
判断正误
(1)磁铁矿的主要成分是Fe3O4( √ ) (2)FeO在空气中加热生成Fe2O3( × ) (3)Fe3O4中铁的化合价有+2和+3价,是一种混合物( × ) (4)Fe(OH)3不能利用化合反应生成( × ) (5)因为Fe(OH)2易被氧化,所以在制备时要隔绝空气( √ )
铁的氢氧化物有两种FeOH

这是因为白色的氢氧化亚铁被空 气中的氧气氧化成了红褐色的氢 氧化铁。反应的化学方程式分别 为:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么 在制备Fe(OH)2时应采取哪些措施防止其被 氧化?
(2)将溶解亚铁盐的蒸馏水煮沸(除去溶解的氧气);
A、在亚铁盐溶液液面上加隔氧剂(如加 入苯等密度比水小,而又不溶于水的有机溶
剂).装置如下图所示.
由于苯的液封作用,防止了生成的
Fe(OH)2被氧化,因而可较长时间观察到白 色Fe(OH)2沉淀.
B、特殊装置
• 思考:如何操作止水 夹,才能得Fe(OH)2沉 淀,并保存较长时间?
当堂训练:
1.将下列四种化合物溶于稀盐酸,滴
加硫氰化钾溶液没有颜色变化的是:
(A )
A.FeS C.FeCl3
B.Fe2O3 D.Fe2(SO4)3
当堂训练
• 2、判断下列说法正确与否。
(1)铁元素有+2、+3价,故铁的氧化物
只有FeO和Fe2O3两种.
( ×)
(2)铁的氧化物都为黑色固体. ( × )
(3)向FeCl3溶液中加入KSCN溶液,溶液 立刻变成血红色,而非沉淀. ( √ )
(5)FeO在空气中易被氧化为Fe2O3. ( × )
当堂训练:
• 3、除去下列物质中所含的杂质(括号内为杂质),将选 用的试剂和分离方法填在题后的横线上,并写出有关反 应的离子方程式.
• (1)Fe2O3[Fe(OH)3]_加__热_.2_F_e_(O_H_)_3 _==_=_F_e2_O_3_+_3_H_2O_; • (2)Fe2O3(Al2O3)_加2_O_入H_过-_=量_=_=的2_NA_al_OO_2H-+_溶_H液_2O_,_过_滤__._A_l2_O_3;+
考点梳理:铁的氧化物与氢氧化物

转 解析
变式训练
【变式】能正确表示下列反应的离子方程式是( D ) 。
A.浓盐酸与铁屑反应:2Fe+6H+===2Fe3++3H2↑
B.钠与 CuSO4 溶液反应:2Na+Cu2+===Cu↓+2Na+
C.NaHCO3 溶液与稀 H2SO4 反应:CO23—+2H+===H2O+CO2↑
D . 向 FeCl3 溶 液 中 加 入 Mg(OH)2 : 3Mg(OH)2 + 2Fe3 +
===2Fe(OH)3+3Mg2+
转 解析
分析产物、拆分及反应原理是否正确等
【思维启迪】把Na加入到CuSO4溶液中看到的现象?其 反应实质是什么?NaHCO3的拆分是否正确?
真题演练
【真题】 (2014·山东理综,9)等质量的下列物质与足量
+3
+2,+3
稳定性
不稳定
稳定
稳定
与H+反应的 FeO+2H+=== 离子方程式 Fe2++H2O
Fe2O3+6H+=== 2Fe3++3H2O
Fe3O4+8H+ === Fe2++ 2Fe3++4H2O
2. 铁的氢氧化物
色态
Fe(OH)2 白色 固体
Fe(OH)3 红褐色 固体
与盐酸反 Fe(OH)2+2H+
铁的氧化物与氢 氧化物
考点强化: 铁的氧化物与氢氧化物
➢ 1.考点精讲 ➢ 2.典例剖析 ➢ 3.变式训练 ➢ 4.真题演练
考点精讲
1.铁的氧化物
化学式 俗名
颜色状态
FeO 黑色 粉末
Fe2O3 铁红
红棕色粉末
Fe3O4 磁性氧化铁
黑色晶体 (有磁性)
溶解性
难溶于水
铁的化合物

铁三角
Fe
Fe3+
2+
〔3〕Fe2+的检验?
〔1〕参加碱液〔或氨水〕,先生成 白 色沉淀,又迅速转变为 灰绿 色,最后 变为 红褐 色沉淀的溶液中含有Fe2+
〔2〕滴入KSCN溶液,溶液颜色不变, 参加硝酸等强氧化剂后,溶液颜色变为 血红色则溶液中含有Fe 2+
铁及其化合物转化关系
Fe3O4
制备Fe3O4 做油漆、涂 料、炼铁原料
做磁铁、炼 铁原料
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
实验3-9:在FeCl3、FeSO4分别参加NaOH溶
液
红褐色沉淀
先产生白色絮状沉淀, 迅速变为灰绿色沉淀, 最后变为红褐色沉淀
讨论:
氢氧化亚铁实际是白色的固体,为什么在实验 中几乎观察不到白色,而最终沉淀变成了红褐 色呢?
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
实验3-9:在FeCl3、FeSO4分别参加NaOH溶 液
红褐色沉淀
先产生白色絮状沉淀, 迅速变为灰绿色沉淀, 最后变为红褐色沉淀
FeCl3 + 3NaOH = Fe(OH)3+ 3NaCl
FeSO4 + 2NaOH =
Fe(OH)2 + Na2SO4 4OF2e+(2OHH2O) 2 +
Al
Al2O3
AlO2-
Al(OH) 3
Al3+
3.在氯化铁和氯化铜的混合溶液中参加过量的 Fe粉,假设充分反响后溶液的质量没有改变, 则原混合溶液中Fe3+和Cu2+物质的量之比为多 少?
2﹕7
特别注意:
人教版高中化学必修一《铁的氢氧化物》课件

铁的氢氧化物 根据铁的化合物有+2、+3两种价态,可以推 断铁的氢氧化物有两种情势,分别为Fe(OH)2 和Fe(OH)3. 1、氢氧化铁(Fe(OH)3)
物理性质:红褐色,难溶于水。
2、氢氧化亚铁(Fe(OH)2)
实验现象:生成白色絮状沉淀,迅速变成灰 绿色,最后变成红褐色。 物理性质:白色,难溶于水。 化学性质:易被氧化,具有还原性。
程式Βιβλιοθήκη 3NaCl2NaCl离子方
程式 Fe(OH)3+3H+=Fe3++3H2O Fe(OH)2+2H+=Fe2++2H2O
稳定性
在空气中易被氧化成Fe(OH)3
转化关系
Fe3+与Fe2+的检验
实验3 1、在2支试管中分别加入5mLFeCl2溶 液和5mLFeCl3溶液 2、向2支试管中各滴入几滴KSCN溶 液,视察现象
www.themegalleryX
既然Fe(OH)2那么容易被氧化,我们应 该如何减缓它被氧化的速率呢?
由于被Fe(OH)2易被空气中的氧气、溶液中 的氧气氧化,因此在制备过程中要注意隔绝 氧气:
1、煮沸NaOH溶液赶尽空气 2、采用铁粉和稀H2SO4制备新FeSO4溶液 3、滴加NaOH溶液时使用长胶头滴管并插 入液面以下将NaOH溶液挤出。 4、制造还原性气氛(如H2),避免 Fe(OH)2被氧化。
铁的氢氧化物
氢氧化亚铁
氢氧化铁
化学式 颜色、状态
水溶性
Fe(OH)2
白色絮状固体 难溶于水
Fe(OH)3
红褐色固体 难溶于水
制备(离子方程式) Fe3++3OH-=Fe(OH)3↓ Fe2++2OH-=Fe(OH)2↓
【知识解析】铁、铁的氧化物和铁的氢氧化物
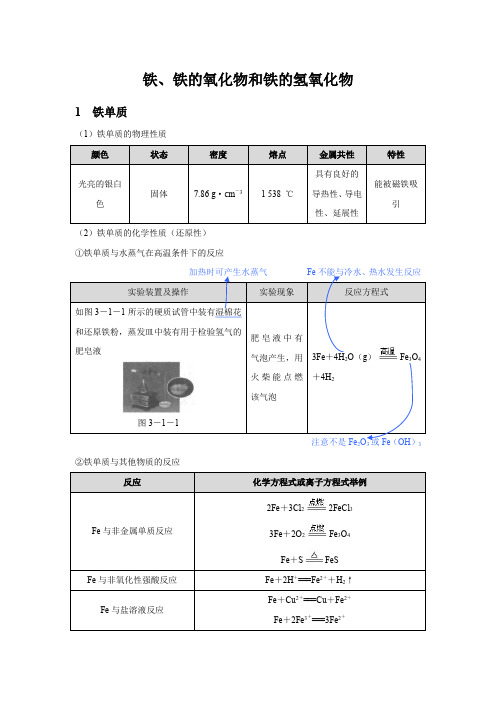
铁、铁的氧化物和铁的氢氧化物1 铁单质(1)铁单质的物理性质(2)铁单质的化学性质(还原性)①铁单质与水蒸气在高温条件下的反应如图3-1-1所示的硬质试管中装有湿棉花和还原铁粉,蒸发皿中装有用于检验氢气的肥皂液图3-1-13Fe+4H2O(g)Fe3O4+4H2②铁单质与其他物质的反应2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS教材延伸(1反应生成Fe 3O 4和H 2CO 和H 2。
(2)从铁与Cl 2、O 2、S 的反应中铁元素化合价的变化情况可以比较Cl 2、O 2、S 的氧化性强弱,即氧化性:Cl 2>O 2>S 。
2 铁的氧化物(1)铁的常见氧化物的性质及用途名师提醒(1)FeO 不稳定,在空气里受热,能迅速被氧化成Fe 3O 4。
(2)“朱门酒肉臭”中的“朱门”是指以Fe 2O 3为原料制备的油漆漆制的门。
(3)Fe 3O 4有固定的组成,属于纯净物,不是混合物。
Fe 3O 4可看成FeO ·Fe 2O 3,所以在书写其与硝酸的反应方程式时可看成硝酸将其中的二价铁氧化成三价铁。
(4)在高温条件下,Fe 与Fe 2O 3可以发生反应,当铁足量时发生反应Fe +Fe 2O 33FeO ,当铁不足时发生反应Fe+4Fe2O33Fe3O4。
(2)铝热反应【实验操作】①把两张圆形滤纸分别折叠成漏斗状套在一起,使四周都是四层。
把内层“纸漏斗”取出,在底部剪一个小孔,用水润湿,再与另一“纸漏斗”套在一起,架在铁架台的铁圈上,干燥使反应完全②把5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,在混合物上面加③用燃着的木条点燃镁条,观察现象。
【实验记录】热,火星四射;③“纸漏斗”Al与Fe2O3反应,置换出铁,反应方程式为2Al +Fe2O3Al2O3+2Fe教材延伸铝热反应3 铁的氢氧化物(1)Fe (OH )2与Fe (OH )3的性质比较不稳定[比Fe (OH )2稳定],受热易分解,2Fe (OH )3Fe 2O 3+3H 2O(2)Fe (OH )2在空气中转化为Fe (OH )3Fe (OH )2中铁元素的化合价为+2,具有还原性。
高中化学(新人教版)必修第一册同步习题:铁的单质和氧化物、氢氧化物(同步习题)【含答案及解析】

第三章铁金属材料第一节铁及其化合物第1课时铁的单质和氧化物、氢氧化物基础过关练题组一铁的性质1.(2019福建福州福清一中高一上期末)常温下,将铁片放入下列溶液中,不发生反应的是( )A.稀硫酸B.氯水C.氢氧化钠溶液D.硫酸铜溶液2.下列说法不正确的是( )A.铁与纯氧气和水蒸气反应都能生成四氧化三铁B.铁在高温下与水蒸气的反应是置换反应C.铁与盐酸反应生成氯化铁和氢气D.铁与盐酸或水蒸气反应,铁都做还原剂3.下列关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是( )A.铁丝燃烧产生白烟B.铁丝生锈是缓慢氧化C.铁丝燃烧的产物是Fe2O3D.铁锈的主要成分是Fe3O44.(2019湖北随州一中高一上学期期中)关于三个实验:①将铁钉放入CuSO4溶液中:Fe+CuSO4 Cu+FeSO4;②向硫酸亚铁溶液中滴入几滴浓硝酸:3FeSO4+6HNO3 Fe2(SO4)3+Fe(NO3)3+3NO2↑+3H2O;③将铁钉放入氯化铁溶液中:Fe+2FeCl33FeCl2。
下列判断正确的是( )A.实验①和③中铁做还原剂B.实验②中Fe2+既显氧化性又显还原性C.氧化性:Fe2+>Cu2+D.实验③中反应的离子方程式为Fe+Fe3+ 2Fe2+5.(2019山西太原高一上学期期末)还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )A.反应生成FeOB.湿棉花的主要作用是冷却试管,防止炸裂C.肥皂液的主要作用是检验生成的H2D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来6.(2019云南玉溪江川二中高二期末)红热的铁能与水蒸气反应,有氢气生成。
现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。
请回答下列问题。
(1)写出铁与水蒸气反应的化学方程式: 。
(2)干燥管C内盛放的药品是或;干燥管的(填“m”或“n”)端与g导管相连接。
(3)装置最后用一个试管来收集产生的气体,怎样用简单的方法检验收集到的气体是氢气?简述实验操作步骤和现象: 。
