考点梳理:铁的氧化物与氢氧化物
3.1.1铁的单质氧化物和氢氧化物课件高一上学期化学人教版
_6_H_+__+__F_e_2O__3_ _F_e_3_O_4_+__8_H_+_=__=_=_ _=_=_=_2_F_e_3_+_+___ _2_F_e_3_+_+__F_e_2_+_+___
_3_H_2_O__
_4_H_2_O___
稳定性
稳定
稳定
与CO、C、 H2反应
生成单质铁及CO2或H2O
2.下列有关铁的说法不正确的是 A.铁与水蒸气的反应中铁为还原剂
√B.铁和稀硫酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁在纯氧中燃烧生成Fe3O4 D.工业上用CO在高温条件下还原含Fe2O3的矿石炼铁
铁和稀硫酸反应的离子方程式应为Fe+2H+===Fe2++H2↑。
part 02
铁的氧化物
俗称
氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
—
__铁__红__
_磁__性__氧__化__铁__
颜色、状态 黑色粉末
红棕色 粉末 黑色晶体(有磁性)
溶解性
不 溶于水
类别
碱性 氧化物
碱性 氧化物
-
铁的价态
_+__2__
_+__3__
+2 、_+__3__
与H+反应 _F_e_O__+__2_H_+_=_=_=__F_e_2+__+__ 的离子方 _H__2O__ 程式
F e ( O H ) 2 : _ _ _ _F_ _e_(O_ _H_ _)2_ _=_△=_=_ _F_e_O_ +_ _ _H_2_O_ _ _ _ _ _ _ _ _
F e ( O H ) 3 : _ _ _ _2_ F_ _e_(O_ _H_ _)3_=_△=_=_ _F_e_2_O_3_+_ _3_H_2_O_ _ _ _ _ _ _
铁的氧化物和氢氧化物高一化学精美课件

红 砖?
青 砖?
结论:红砖中含的是Fe2O3 ,青砖中主要含的是Fe3O4
制备
氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2
[实验3-1]在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液, 然后各滴入NaOH溶液,观察并描述发生的现象。
制备
氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2
若要较长时间看到白色沉淀,需创造无氧环境
化学性质: 化学式 色态
氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2
Fe(OH)2 白色絮状沉淀
Fe(OH)3 红褐色沉淀
与盐酸反应 Fe(OH)2+2H+=Fe2++2H2O
受热分解
+2 Fe(OH)2
空气
+Fe32O3
Fe(OH)3+3H+=Fe3++3H2O 2Fe(OH)3==Fe2O3+3H2O
②若拔去连接管,将有白色沉淀的注射器抽入空气,振荡,则可观察 到 白色沉淀迅速转变为灰绿色,最后变为红褐色。。
方法三 集气排液法
操作步骤:
C
1. 检查装置气密性,按图示盛放药品
2. 打开止水夹a,反应一段时间后, 在C处收集H2并验纯
3. 待收集的H2纯净后,关闭a,左边试管中气压逐渐增大,其FeSO4 溶液被压入右边试管中,与NaOH反应生成Fe(OH)2白色沉淀。
那么青砖又是怎样制得的呢?
原来在砖胚烧透之后,不让它自然冷却, 而从窑顶不断向下淋水使砖冷却,结果砖 就变成了青砖。
淋水的结果是,水在窑内高温的环境
下,迅速变为水蒸气,使窑内压强增大, 阻止了空气进入,在窑内形成了一个缺氧 的环境,这些水蒸气还与窑内炽热的碳起 反应,产生大量还原性气体CO和H2,将砖 体内的Fe2O3转化为FeO或Fe3O4,由于它 们都是黑色的,所以烧出来的就是青砖
铁的氧化物、氢氧化物的主要性质

铁的氧化物、氢氧化物的主要性质铁是一种广泛应用的金属元素,在工业、建筑和生活中有着广泛的用途。
在自然界中,铁主要以氧化物和氢氧化物的形式存在。
本文将介绍铁的氧化物和氢氧化物的主要性质。
一、铁的氧化物性质1. 一般性质铁的氧化物是铁和氧反应生成的产物,它们有着广泛的应用。
铁的氧化物有多种形式,如黑色的FeO、红色的Fe2O3和Fe3O4等。
这些氧化物基本上都是不溶于水的,但它们通常可以在酸性或碱性溶液中溶解。
2. 化学性质铁的氧化物在化学反应中表现出不同的性质,比较常见的有以下几种。
(1)还原性铁的氧化物可以通过还原反应还原成纯铁或者其他具有还原性的物质。
例如,在高温下与氢气反应,氧化铁可以还原成纯铁和水。
Fe2O3 + 3H2 → 2Fe + 3H2O(2)氧化性铁的氧化物可以与其他化合物发生氧化反应,产生较稳定的化合物。
例如,FeO可以与氧气反应生成稳定的Fe2O3。
4FeO + O2 → 2Fe2O3(3)酸碱性不同的铁氧化物在酸性和碱性环境中表现出不同的性质。
例如,Fe2O3在酸性环境中可溶于酸,而在碱性环境中不溶。
二、铁的氢氧化物性质1. 一般性质铁的氢氧化物是一种碱性物质,它们可以和酸反应产生盐和水。
铁的氢氧化物在水中溶解度较低,但与酸或盐类反应后可以变得更易溶。
铁的氢氧化物常常作为催化剂和吸附剂应用于化工、水处理等领域。
2. 化学性质铁的氢氧化物在化学反应中表现出不同的性质,比较常见的有以下几种。
(1)酸碱性铁的氢氧化物是一种碱性物质,它们可以与酸作用产生盐和水。
例如,Fe(OH)2与硝酸反应可以产生Fe(NO3)2和水。
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O(2)氧化性铁的氢氧化物可以通过氧化反应转化成铁的氧化物或者其他化合物。
例如,Fe(OH)2可以通过空气氧化成Fe2O3。
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O(3)还原性铁的氢氧化物可以通过还原反应转化为纯铁或其他还原性物质。
【知识解析】铁、铁的氧化物和铁的氢氧化物
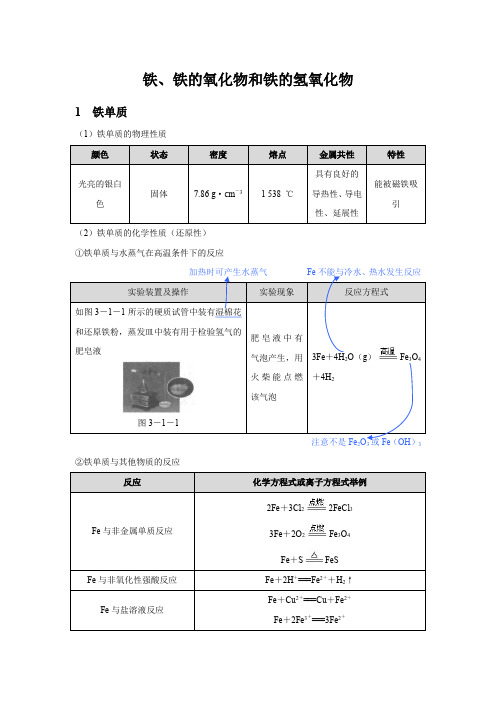
铁、铁的氧化物和铁的氢氧化物1 铁单质(1)铁单质的物理性质(2)铁单质的化学性质(还原性)①铁单质与水蒸气在高温条件下的反应如图3-1-1所示的硬质试管中装有湿棉花和还原铁粉,蒸发皿中装有用于检验氢气的肥皂液图3-1-13Fe+4H2O(g)Fe3O4+4H2②铁单质与其他物质的反应2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS教材延伸(1反应生成Fe 3O 4和H 2CO 和H 2。
(2)从铁与Cl 2、O 2、S 的反应中铁元素化合价的变化情况可以比较Cl 2、O 2、S 的氧化性强弱,即氧化性:Cl 2>O 2>S 。
2 铁的氧化物(1)铁的常见氧化物的性质及用途名师提醒(1)FeO 不稳定,在空气里受热,能迅速被氧化成Fe 3O 4。
(2)“朱门酒肉臭”中的“朱门”是指以Fe 2O 3为原料制备的油漆漆制的门。
(3)Fe 3O 4有固定的组成,属于纯净物,不是混合物。
Fe 3O 4可看成FeO ·Fe 2O 3,所以在书写其与硝酸的反应方程式时可看成硝酸将其中的二价铁氧化成三价铁。
(4)在高温条件下,Fe 与Fe 2O 3可以发生反应,当铁足量时发生反应Fe +Fe 2O 33FeO ,当铁不足时发生反应Fe+4Fe2O33Fe3O4。
(2)铝热反应【实验操作】①把两张圆形滤纸分别折叠成漏斗状套在一起,使四周都是四层。
把内层“纸漏斗”取出,在底部剪一个小孔,用水润湿,再与另一“纸漏斗”套在一起,架在铁架台的铁圈上,干燥使反应完全②把5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,在混合物上面加③用燃着的木条点燃镁条,观察现象。
【实验记录】热,火星四射;③“纸漏斗”Al与Fe2O3反应,置换出铁,反应方程式为2Al +Fe2O3Al2O3+2Fe教材延伸铝热反应3 铁的氢氧化物(1)Fe (OH )2与Fe (OH )3的性质比较不稳定[比Fe (OH )2稳定],受热易分解,2Fe (OH )3Fe 2O 3+3H 2O(2)Fe (OH )2在空气中转化为Fe (OH )3Fe (OH )2中铁元素的化合价为+2,具有还原性。
考点15铁的氢氧化物-

考点15 铁的氢氧化物【知识梳理】一、铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体溶解性难溶于水难溶于水与盐酸反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O受热分解—2Fe(OH)3=====△Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-=== Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3二、Fe(OH)2的制备(1)有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
(2)还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖一层苯(或煤油),如图3所示。
【核心归纳】1.FeO和Fe3O4与HNO3反应时,除考虑与H+的反应外,还考虑Fe2+被HNO3氧化成Fe3+。
2.Fe2O3、Fe3O4、Fe(OH)3与HI反应时,除考虑与H+的反应外,还考虑Fe3+被I-还原为Fe2+。
【对点例题】例1.(2023·河南河南·高一阶段练习)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是()A.①②③B.①②④C.①②③④D.②③④【答案】B【解析】Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,发生4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。
①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2 处在氢气的保护中;③无法避免氧气与氢氧化亚铁的反应;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀,选B。
新教材高中化学第3章第2课时铁铁的氧化物和铁的氢氧化物pptx课件鲁科版必修第一册

01 基础落实•必备知识全过关
内
容 索
02 重难探究•能力素养全提升
引ቤተ መጻሕፍቲ ባይዱ
03 学以致用•随堂检测全达标
1.根据生产、生活中的应用实例或通过实验探究,培养宏观辨
识与微观探析的化学核心素养。
素 养
2.能通过实验探究和交流研讨,掌握Fe、FeO、Fe2O3、Fe(OH)2、 Fe(OH)3的性质及典型实验现象,能书写主要的化学方程式和离
应,D不符合题意。
【变式设问】 若将铁粉投入AgNO3溶液中,铁粉和溶液的质量会发生怎样变化?写出反 应的离子方程式。
铝热反应
2Al+Fe2O3
2Fe+Al2O3
二、铁的氧化物——FeO、Fe2O3、Fe3O4性质的比较
项目 俗名
FeO
Fe2O3
Fe3O4
—
铁红
磁性氧化铁
颜色、状态
黑色粉末 红棕色粉末 黑色固体
水溶性 铁元素化合价
难溶 +2价
难溶 +3价
难溶 +2、+3价
与稀盐酸或稀硫酸 FeO+2H+== Fe2O3+6H+== Fe3O4+8H+==Fe2++ 反应(写离子方程式) Fe2++H2O 2Fe3++3H2O 2Fe3++4H2O
应用体验
【例1】(2022天津和平区高一期末)把铁粉放入下列溶液中,铁粉溶解,溶 液质量减小,但没有气体放出的是( ) A.稀硫酸 B.NaHSO4溶液 C.CuSO4溶液 D.NaCl溶液
答案 C
3.1.1 铁的单质、氧化物、氢氧化物 课件(共37张PPT)—2023-2024学年高中化学人教

3.1.1 铁的单质、氧化物、氢氧化物课件(共37张PPT)—2023-2024学年高中化学人教版-2023·高一上学期(共37张PPT)第三章铁金属材料第一节铁及其化合物第一课时铁的单质、铁的氧化物、铁的氢氧化物学习目标1.了解单质铁、铁的氧化物性质及用途;2.通过实验认识铁单质与水蒸气的反应的条件,加深对微观原子结构决定物质宏观性质的认识;3.掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
铁元素在自然界中的分布陨铁赤铁矿磁铁矿陨铁是自然界中铁元素的单质形态,但是铁元素更多地以化合物的形式存在于矿石中。
钠在自然界有单质吗?为什么?铁的性质1.铁的物理性质铁有_______和_______。
铁能_____,但其导电性不如铜和铝。
铁能被_____吸引。
2.铁的化学性质(1)铁与___________的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成____价铁的化合物。
(2)铁与___________的氧化剂(如氯气等)反应,铁原子则失去__个电子生成____价铁的化合物。
延展性导热性导电磁体氧化性较弱+2氧化性较强+33铁的性质(3)红热的铁能与水蒸气发生反应,生成___________和_____。
化学方程式:___________________________。
四氧化三铁氢气3Fe+4H2O(g) Fe3O4+4H2高温====铁的氧化物化学式FeO Fe2O3 Fe3O4纯净物俗称— _____ ___________颜色和状态___色粉末_______粉末___色晶体铁的价态____价____价+2价、+3价水溶性_____ _____ _____与盐酸反应(离子方程式) FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O铁红磁性氧化物黑红棕色黑+2+3不溶不溶不溶铁的氢氧化物在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
铁的化合物

错误!错误!铁及其化合物考点一 铁的单质、氧化物和氢氧化物1.铁 (1)物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
2.铁的物理性质和存在纯净的铁是银白色的金属,铁的熔点较高。
当含有碳和其它元素时,熔点将降低,导电性比铜、铝差。
铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性。
铁在地壳中的含量占第4位。
自然界中铁元素主要以化合态形式存在。
重要的铁矿石有(填化学式):赤铁矿Fe 2O 3,磁铁矿Fe 3O 4,褐铁矿2Fe 2O 3·3H 2O ,菱铁矿FeCO 3。
(2)结构(3)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
按要求书写下列反应的方程式: ①Fe 与Cl 2、S 反应的化学方程式:2Fe +3Cl 2=====点燃2FeCl 3;Fe +S ====△FeS 。
②Fe 与水蒸气的反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与氧化性酸(如HNO 3)的反应(写离子方程式)。
Fe 与过量稀HNO 3的反应:Fe 与少量稀HNO 3的反应:④Fe 与FeCl 3溶液的反应(写离子方程式):二、铁的氧化物和氢氧化物题组一铁的单质、氧化物和氢氧化物的性质1.下列有关铁及其化合物的说法中正确的是()A.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在B.铁在纯氧中燃烧或在氯气中燃烧所得产物中铁的化合价均为+3价C.工业上可用铁质容器储存浓硝酸和浓硫酸,原因是铁在常温下与两种酸不反应D.工业上用CO在高温条件下还原含Fe2O3的铁矿石炼铁2.(2017·大连高三调研)在一定条件下,下列物质能与铁单质发生反应,其中能将铁元素从0价转变为+3价的是()A.盐酸B.稀硫酸C.稀硝酸D.硫酸铜溶液3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
转 解析
变式训练
【变式】能正确表示下列反应的离子方程式是( D ) 。
A.浓盐酸与铁屑反应:2Fe+6H+===2Fe3++3H2↑
B.钠与 CuSO4 溶液反应:2Na+Cu2+===Cu↓+2Na+
C.NaHCO3 溶液与稀 H2SO4 反应:CO23—+2H+===H2O+CO2↑
D . 向 FeCl3 溶 液 中 加 入 Mg(OH)2 : 3Mg(OH)2 + 2Fe3 +
===2Fe(OH)3+3Mg2+
转 解析
分析产物、拆分及反应原理是否正确等
【思维启迪】把Na加入到CuSO4溶液中看到的现象?其 反应实质是什么?NaHCO3的拆分是否正确?
真题演练
【真题】 (2014·山东理综,9)等质量的下列物质与足量
+3
+2,+3
稳定性
不稳定
稳定
稳定
与H+反应的 FeO+2H+=== 离子方程式 Fe2++H2O
Fe2O3+6H+=== 2Fe3++3H2O
Fe3O4+8H+ === Fe2++ 2Fe3++4H2O
2. 铁的氢氧化物
色态
Fe(OH)2 白色 固体
Fe(OH)3 红褐色 固体
与盐酸反 Fe(OH)2+2H+
铁的氧化物与氢 氧化物
考点强化: 铁的氧化物与氢氧化物
➢ 1.考点精讲 ➢ 2.典例剖析 ➢ 3.变式训练 ➢ 4.真题演练
考点精讲
1.铁的氧化物
化学式 俗名
颜色状态
FeO 黑色 粉末
Fe2O3 铁红
红棕色粉末
Fe3O4 磁性氧化铁
黑色晶体 (有磁性)
溶解性
难溶于水
难溶于水
难溶于水
铁的化合价
+2
应
===Fe2++2H2O
受热分解
Fe(OH)3+3H+===Fe3++3H2O △
2Fe(OH)3=====Fe2O3+3H2O
制法
可溶性亚铁盐与 碱溶液反应 Fe2 ++2OH-=== Fe(OH)2↓
可溶性铁盐与碱溶液反应 Fe3++ 3OH-===Fe(OH)3↓
二的 关系
在空气中,Fe(OH)2能够非常迅速地被氧气氧化成 Fe(OH)3,现象是白色絮状沉淀迅速变成 灰绿色, 最后变成红褐色,反应方程式为 4Fe(OH)2+O2+ 2H2O===4Fe(OH)3
稀硝酸反应,放出NO物质的量最多的是 ( A )。 A
.FeO
B. Fe2O3 C. FeSO4 D.Fe3O4
Fe3O4可看作FeO·Fe 2O3,利用电子得失 守恒,比较等质量时Fe2+的物质的量。 解析显/隐
解析 Fe2O3不具有还原性,与稀HNO3反应不生成NO, 另外三种等质量的物质中,含Fe2+物质的量越多,与稀 HNO3反应失去的电子越多。根据得失电子守恒,则生 成NO的物质的量越多,经计算比较等质量的FeO、 FeSO4、Fe3O4中FeO含有Fe2+物质的量最多,故选A。
典例剖析
【典例】能正确表示下列反应的离子方程式是( D )。 A .将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑ B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O C .将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3- ===Fe3++2H2O+NO↑ D.将铜屑加入含Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+
