人脐静脉内皮细胞的培养
人脐静脉内皮细胞的培养及鉴定

本课题为安徽省自然科学基金安科医药专项资助项目(01043708)作者单位:230001 合肥 安徽省立医院普外科安徽医科大学2001级硕士研究生(傅斌生)人脐静脉内皮细胞的培养及鉴定余继海 许戈良 汪 建 荚卫东 傅斌生[摘 要] 目的 探讨新生儿脐静脉内皮细胞的培养及鉴定方法,建立血管内皮细胞培养模型,为体外研究血管内皮细胞提供实验手段。
方法 采用胶原酶 灌流消化法培养人脐静脉内皮细胞,当原代培养细胞80%以上汇合后,用胰蛋白酶消化传代;根据细胞生长特点、形态特征、细胞表型和分泌蛋白流式细胞术(F M 术)免疫荧光检查对细胞进行鉴定。
结果 种植在培养瓶中的内皮细胞12小时贴壁生长,48~72小时生长最快,7~10天汇合。
内皮细胞呈接触抑制生长、呈鹅卵石样外观,FM 术检测CD31和V -R-Ag 均为阳性表达。
结论 消化酶灌注脐静脉消化内皮细胞是获取血管内皮细胞的一种好方法,可靠性大,成功率高,可以构建体外研究血管内皮细胞的模型。
[关键词] 内皮细胞;培养C ulture and identif ication of human endothelial cells derived f rom umbilical veins Y u Jihai ,Xu Geliang,W ang J ian,et al A nhui Prouincial H osp ital,H ef ei 230001[Abstract] Objective T o extablish the methods of culturing human endothelial cells (EC)and identifing the cells ac cording to t he antigens expressed and their morpholog ical aspect.Methods A fter digestion w ith t ype collagenase at 37!for 10minutes,the cells were centrifuged,and the cell pellet was resuspended in DEM E medium containing fetal bovine serum (10%vol/vol),seeded on gelatin(0.1%w t/vol)procoated dishes at aconcentr at ion of 10,000per square centimeter.T he medium was changed 1days later when the cells w er e attached and every 2days,until the cells reached confluence.Phase con trast microscopy and flow cy tometry with specific antisera against von willebrand factor and CD31were used to obser ve and i dentify the culturedcells.Results At confuluence (7~9days),the cultured cells had a cobbestone appear ance wit h a strict monolayer grow th and contact inhibition.T he mean fluorescence intensity of the cells was similar w ith both antibodies for the cultured cells vs controls.C onclusion T he cultured cells are endothelial cells,and the method of identification is practical and convenient.[Key words] Endot helial cells;Culture我们采用胶原酶 灌流消化法成功培养人脐静脉内皮细胞,根据细胞生长特点、形态特征、细胞表型和分泌蛋白流式细胞术免疫荧光检查对细胞进行鉴定,从而构建体外研究血管内皮细胞的模型,现报告如下。
一种改进的人脐静脉内皮细胞的培养方法

一种改进的人脐静脉内皮细胞的培养方法作者:李琴山冯赞杰刘洋徐海燕钱民章【关键词】 ,内皮细胞;脐静脉;细胞培养【Abstract】 AIM: To establish a stable method to isolate and culture human umbilical vein endothelial cells (hUVEC) in vitro. METHODS: Endothelial cells of vein from newborn umbilical cord were successfully isolated using a combination of collagenase and trypsin (1∶1). Cells were not digested with trypsin until the cells reached confluence over 80%. The composition of culture medium was simplified by not adding vascular endothelial cell growth factor and heparin. The cultured cells were verified as hUVEC by morphology and immunofluorescence staining. RESULTS: The endothelial cells initially spread on the bottom of the dishes in 4 h, then coalesced and grew to form confluent monolayers of polygonal cells within 7-10 d. The cultured cells had a cobblestone appearance with a strict monolayer growth and contact inhibition. The purity of endothelial cells was more than 95% identified by immunocytochemistry staining for Ⅷ:Ag and KDR. CONCLUSION: Method of injection with mixed Enzyme solution is an optimized protocol which is reliable and of high achievement ratio. Cellsharvested with this protocol can be used as models on research of vascular endothelial cells in vitro.【Keywords】 endothelial cell; umbilical vein; cell culture【摘要】目的:建立稳定的人脐静脉内皮细胞分离和培养的方法. 方法:采用胰蛋白酶/胶原酶(1∶1)混合酶液消化法培养人脐静脉内皮细胞,简化完全培养液组分(不添加血管内皮细胞生长因子、肝素等辅助因子),当原代培养细胞80%以上汇合后用胰蛋白酶消化传代;用形态学、免疫细胞化学法进行鉴定. 结果:种植在培养瓶中的内皮细胞4h贴壁生长,48~96 h生长最快,7~10 d汇合. 内皮细胞呈单层铺路石样外观,Ⅷ因子相关抗原(Ⅷ:Ag)和内皮细胞生长因子受体2(KDR)鉴定内皮细胞纯度达95%以上. 结论:用混合酶液灌注脐静脉消化内皮细胞是获取内皮细胞的一种好方法,可靠性大,成功率高,可以构建体外研究血管内皮细胞的模型.【关键词】内皮细胞;脐静脉;细胞培养0引言血管内皮细胞(vascular endothelial cell, VEC)在心血管疾病的发生中占有重要的地位[1]. 采用培养的VEC进行相关机制研究是一种普遍应用的实验方法. 由于人体组织取材限制,很难获取大量原代培养的人VEC.我们以健康胎儿脐静脉血管为材料,建立起一种改良的人脐静脉内皮细胞(human umbilical vein endothelial cells, hUVEC)培养方法.1材料和方法1.1材料新生儿脐带由遵义医学院附属医院提供;胰蛋白酶、Ⅱ型胶原酶、EDTA(Sigma公司);M199、胎牛血清(Gibco公司);台盼蓝(Amresco公司进口分装);鼠抗人Ⅷ因子抗体、鼠抗人内皮细胞生长因子受体2(KDR)抗体(美国Dako公司);超净台(苏州苏净集团安泰空气公司)、倒置相差显微镜(日本Nikon公司), CO2孵箱(美国Thermo Formo公司)、酶标仪(德国Huma Reader公司). 完全培养液为800 mL/L M199培养液、200 mL/L胎牛血清、2 mmol/L L谷氨酰胺、1×105 U/L青霉素、100 mg/L链霉素,使用前调节pH至7.0~7.4.1.2方法1.2.1hUVEC的分离和培养在无菌条件下,取健康产妇分娩后6 h内[2]的脐带,长约30 cm,剪去脐带两端钳夹处. 于脐静脉一端插入一针头,用生理盐水反复冲洗至无血迹后,将脐静脉另一端用止血钳夹紧,用空针封闭. 灌入1 g/L胶原酶和2.5 g/L胰蛋白酶(1∶1)(V/V) 15 mL,置37℃水浴箱中孵育8 min,将消化液收集入离心管,用PBS冲洗脐静脉2次,将冲洗液一同收集入离心管,1000 r/min 离心10 min,去上清液,加入完全培养液重悬细胞,取0.1 mL细胞悬液用4 g/L台盼蓝染色后作活细胞计数. 将1.5×107/L细胞接种到24孔板中,每孔加入完全培养液1 mL,置37℃,950 mL/L O2,50 mL/L CO2培养箱内静置培养,次日换培养液,以后每3 d换液1次,7~10 d 融合.1.2.2细胞计数采用台盼蓝排斥法. 取0.1 mL混匀的内皮细胞悬液与4 g/L台盼蓝0.9 mL混匀后,取1滴在显微镜下计数100个细胞. 当细胞悬液中细胞存活率大于95%时可用于进行原代细胞培养.1.2.3hUVEC的鉴定[3-5]用Ⅷ因子抗体(抗von Willebrand 因子抗体)以及KDR抗体免疫细胞化学法鉴定内皮细胞. 将酸化处理的普通盖玻片消毒后放入6孔培养板,将原代或传代的内皮细胞悬液接种于盖玻片上,当细胞生长至近融合状态时用PBS缓冲液冲洗细胞爬片,-20℃丙酮固定10 min;PBS缓冲液洗3次,5 min/次;用30 mL/L H2O2,室温孵育5 min,灭活内源性过氧化物酶;分别滴加适量鼠抗人Ⅷ因子一抗工作液(1∶100); KDR(1∶200)一抗工作液,37℃作用60 min;PBS缓冲液洗3次,每次5 min;再分别滴加羊抗鼠的IgGFITC 和IgGTR的二抗工作液,37℃作用30 min后,PBS洗涤3次. 立即在荧光显微镜下观察、摄片. GAMFITC绿色荧光显示膜上KDR;GARTR红色荧光显示胞内的Ⅷ因子. 对于Ⅷ因子相关抗原还采用免疫细胞化学SABC法进行检测,显微镜下观察.1.2.4hUVEC的消化传代①取生长融合的细胞吸去培养液,PBS洗2次;②翻转培养瓶,加入1.25 g/L胰蛋白酶, 0.2 g/L EDTA 的细胞消化液;③倒置显微镜下观察细胞消化情况,待细胞与细胞分开、胞体变圆变亮时翻转培养瓶,吸去消化液;④加入完全培养液,小心吹散细胞,计数,接种到新的培养瓶或培养板, 置37℃, 50 mL/L CO2培养箱中培养.1.2.5细胞生长曲线的测定取待测生长状态良好细胞,增长至接近汇合时向培养瓶内加入1 mL 1.25 g/L胰蛋白酶液消化,待细胞接近脱离瓶壁前吸出消化液,加入完全培养液,轻轻吹打制成细胞悬液、计数. 向24孔板的每孔中接种等量细胞,置37℃,50 mL/L CO2培养箱中培养. 将细胞分成8组,每组3孔,培养8 d. 从接种次日起每24 h分别取3个孔计数,取平均值,以时间为横轴,细胞数为纵轴,绘制生长曲线.2结果2.1hUVEC的培养与鉴定在倒置显微镜下连续观察,培养的原代内皮细胞在接种4 h之后开始贴壁生长,细胞呈球形、小多角形,单个或小团块存在. 接种第2~3日,细胞即进入对数生长期,细胞生长迅速;第5~8日时铺满培养瓶瓶底,呈现典型的铺路石样形态特征(图1). Ⅷ因子mAb免疫细胞化学结果显示95%以上为阳性血管内皮细胞,细胞胞质为棕黄色,胞核为蓝色(图2). KDR(图3)和Ⅷ因子(图4)免疫荧光双标显示95%以上为阳性血管内皮细胞.图1培养6 d的原代脐静脉内皮细胞(略)图2脐静脉内皮细胞Ⅷ因子免疫组化检测(略)图3脐静脉内皮细胞内皮细胞生长因子受体2免疫荧光检测(略)2.2hUVEC生长曲线测定通过细胞计数,接种后第1日,细胞较接种时无明显变化,此时细胞仍处于滞留期,第2日则明显增加,第3~5日增长迅速,达到其生长高峰,此时细胞处于对数生长期,第6~8日细胞生长稳定,处于生长平台期(图5).图4脐静脉内皮细胞Ⅷ因子免疫荧光检测(略)图5原代人脐静脉内皮细胞生长曲线(略)3讨论我们以人脐静脉作为培养血管内皮细胞的来源,是因为它具有取材及操作方便,获得细胞数多,在某些方面尚具有与动脉生物学特征相似的优点.获取内皮细胞的方法有机械刮取[6]、组织块移植和酶消化法3种. 前两种易混杂其它血管壁细胞,近几年来已逐渐被酶消化法取代. 从分离细胞数量、保持细胞活性和结构完整性来看,胶原酶是理想的血管内皮细胞分离酶,自成功分离hUVEC以来,已得到广泛应用,但其价格昂贵. 用胰蛋白酶代替胶原酶分离血管内皮细胞已有文献报道. 我们比较了全胶原酶和胰蛋白酶加胶原酶混合两种酶液的消化能力,结果表明,采用胰蛋白酶加胶原酶混合消化的方法,hUVEC 收获量基本接近全胶原酶血管内皮细胞的收获量. 在混合酶液中,胶原酶仅占1/2,这种方法既经济,效果又好. 而且用胰蛋白酶处理可以降低非内皮细胞的贴壁能力,内皮细胞的贴壁能力比平滑肌细胞和成纤维细胞早,所以在接种后6 h可以去除未贴牢的细胞,这些非内皮细胞的污染如不去除,将抑制内皮细胞的增殖.hUVEC较动物内皮细胞的培养困难,只有在培养液中加入刺激细胞生长的物质,方能长期传代培养. 董玉兰等[7]和Relou等[8]报道,培养液中加入人血清、血管内皮细胞生长因子、肝素及培养瓶(皿)用明胶覆盖是hUVEC长期培养的重要条件. 但这些促进内皮细胞贴壁及生长的物质的加入可能成为影响实验结果的混杂因素,限制内皮细胞的实验应用范围. 有人[9-11]研究发现,血管内皮生长因子和碱性成纤维细胞生长因子等有助于培养的胚胎干细胞分化为内皮细胞. 胚胎干细胞有望成为新的种子细胞来源. 我们在改进内皮细胞分离和传代方式的基础上选择M199培养基,补充200 mL/L胎牛血清和2 mmol/L L谷氨酰胺,在维持内皮细胞正常生长和形态结构的前提下尽可能减少完全培养液的组分,能将hUVEC传5~6代. 总之,我们改进的hUVEC培养方法可获取足够数量高纯度可传代的内皮细胞,对内皮细胞生物学特性和心脑血管相关疾病的研究有重要意义.【参考文献】[1] Li XD, Lu kH, Guo SZ, et al. Culture of vascular endothelial cell [J]. Chin J Aesthetic Med, 2001,10(3):18-20.[2]王建民,刘荫秋,赖西南. 正常脐静脉离体后不同时间内皮某些物质含量的变化[J]. 第三军医大学学报,1995,17(1):86.[3] Jonathan B. Rosenberg, Judith S, et al. Genetic induction of a releasable pool of factor Ⅷ in human endothelial cells [J]. Arterioscler Thromb Vasc Biol, 2000, 20 (12):2689-2695.[4]李孟彬,王为忠,张宏伟,等. 猪血管内皮细胞的培养与表型鉴定[J]. 第四军医大学学报,2004,25(24):45.[5] Mario P, Afazal J, Daniel P, et al. Expression of VEGFR2 and AC133 by circulating human CD34+ cells identifies a population of functional endothelial precursors [J]. Blood, 2000,95(3):952-958.[6] Quattrone S, Chiappini L, Scapagnini G, et al. Relaxin potentiates the expression of inducible nitric oxide synthase by endothelial cells from human umbilical vein in in vitro culture [J]. Mol Hum Reprod, 2004,10(5): 325-330.[7]董玉兰,陈铁镇,王铁吉,等. 人脐静脉内皮细胞的继代培养[J]. 中国医科大学学报,1989,18(2):81-85.[8] Relou IAM, Damen CA, Van der Schaft. Effect of culture conditions on endothelial cell growth and responsiveness [J]. Tissue Cell, 1998,30(5):525-530.[9] Evans GR, Brandt K, Klatz S, et al. Bioactive poly(Llactic acid) conduits seeded with Schwann cells for peripheral nerve regeneration[J]. Biomaterials, 2002,23(1):841.[10] Liang PF, Zhang PH, Yang XH, et al. Experimental study on inductionof endothelial apoptosis by burn serum and subeschar tissue fluid [J].中华烧伤杂志,2004,20(5):275-277.[11] Savore C, Zhang C, Muir C, et al. Perlecanknockdown in metastatic prostate cancer cells reduces heparinbinding growth factor responses in vitro and tumor growth in vivo [J]. Clin Exp Metastasis,2005,22(5):377-390.。
人脐静脉血管内皮细胞的高效分离与培养

人脐静脉血管内皮细胞的高效分离与培养张臣;李彤;侯跃龙;严晓晔;高英堂【摘要】目的:建立人脐静脉内皮细胞(HUVEC)体外分离、培养、鉴定的高效方法.方法:胰酶消化法从脐静脉获得HUVEC,观察其形态并传代培养,检测其摄取Dil标记的乙酰化低密度脂蛋白(Dil-AcLDL)的情况,传3代流式榆测内皮细胞特异性表达.结果:消化分离的细胞呈小圆形且聚集成团;2h细胞开始贴壁,呈条索状;7d细胞增多呈漩涡样生长;此后细胞继续增多接近融合,呈铺路石样改变.流式检测细胞高表达血管内皮细胞特异性标志CD144、vWF、CD31,部分表达CD34,而白细胞共同抗原CD45为阴性表达.镜下发现贴壁细胞原代、第5代摄取Dil-AcLDL,胞浆呈现红色荧光,提示为有活性的内皮细胞.结论:利用胰酶消化法能从人脐静脉获得大量内皮细胞,体外培养后能成功增殖传代.【期刊名称】《天津医药》【年(卷),期】2010(038)007【总页数】3页(P605-607)【关键词】内皮细胞;脐静脉;细胞培养技术;细胞分离;连续传代【作者】张臣;李彤;侯跃龙;严晓晔;高英堂【作者单位】300170,天津市第三中心医院,天津市人工细胞重点实验室;300170,天津市第三中心医院,天津市人工细胞重点实验室;300170,天津市第三中心医院,天津市人工细胞重点实验室;300170,天津市第三中心医院,天津市人工细胞重点实验室;300170,天津市第三中心医院,天津市人工细胞重点实验室【正文语种】中文人的内皮细胞是血管壁的主要组成部分,在维持组织稳态、纤溶与凝血、血液组织交换、血管舒缩调节、血管新生、血细胞激活和迁移等生理和病理过程中发挥着重要作用,另外在免疫反应起始过程中也起着决定性的作用[1]。
因此体外获得血管内皮细胞可为阐明许多疾病血管并发症的病理过程提供重要研究模型[2]。
新生儿脐带由于取材经济、来源充足,而成为血管内皮细胞体外获得的主要材料。
人脐静脉血管内皮细胞HUVEC

第三:铺板加样方法错误。
• 6孔、12孔、24孔、48孔与96孔的细胞接种铺板过程中,你的 加样方式是哪种?你觉得加样方式对后期的接种均匀度影响大 吗?例如你是否有过垂直加入96孔板的经历?是不是有的孔就 比较均匀,而有的孔就聚集在了一起?六孔板怎么摇晃也不均 匀?其实也许你离铺好板就差一种适合你的方法。
• 2、不是所有细胞消化后都会变成圆形
• 有些细胞(比如U87,U251)消化好了也不会变成圆形, 只是呈半沙状。
• 3、有些细胞即使变圆,也有脱落的细胞,但还是没消化好 • 比如7860,要等到大部分细胞脱落培养皿底部才可以停
止消化,否则很难吹打下来,这种情况一般发生于难以消化 的细胞。
• 4、对于一些特殊的细胞需要消化过一点 • 有些细胞吹成单个细胞反而对细胞的状态会好一点,一
6孔板、12孔板或24孔板
• 为防止表面张力导致的中间液面太低细胞聚集的现象。通常 每孔首先滴加少量培基,轻轻晃动浸润整个孔底以保证板子 的孔底都是湿润的,这样加液后细胞悬液会平铺在整个孔底, 可以避免加在中间位置和加在周边晃匀后周边细胞局部太多 的现象,细胞分散会较均匀。注意加完细胞悬液后要放工作 台静置一下(5-10分钟)。镜下观察细胞均匀度,如不均匀 可采用以下8字法、十字法及震荡法等方法进行细胞均匀度 处理
• HUVEC细胞培养难度较高,建议使用内皮细胞专用培养基, 选用优质胎牛血清。细胞推荐传代比例为1:2-1:3,胰酶消化室 温1-2分钟,传代周期通常为3-4天。需要注意的是,如 HUVEC出现聚团生长,可能由于培养板亲水性差或者血清中 促贴壁因子不足,可考虑用人纤维粘连蛋白包被培养板,能有 效预防细胞聚团。
第二:细胞吹打次数不够,细胞悬
液密度不均匀。
huvec小管生成实验方法

huvec小管生成实验方法HUVEC小管生成实验方法引言:HUVEC(人脐静脉内皮细胞)是一种常用的体外模型系统,用于研究血管生成和血管内皮细胞功能。
HUVEC小管生成实验是一种常见的方法,用于评估血管形成的能力和细胞迁移的能力。
本文将介绍一种常用的HUVEC小管生成实验方法及其步骤。
材料与试剂:1. HUVEC细胞系:通过细胞培养技术获得。
2. 培养基:使用适合HUVEC细胞培养的培养基,如DMEM/F12。
3. 培养皿:使用96孔板或24孔板。
4. 载玻片:用于观察和分析小管生成。
5. Matrigel:一种基质蛋白,用于模拟细胞外基质环境。
实验步骤:1. HUVEC细胞的培养a. 将HUVEC细胞解冻并在培养基中孵育。
b. 细胞密度达到80-90%时,用PBS洗涤细胞。
c. 使用细胞消化酶(如胰酶)消化细胞。
d. 将细胞重新悬浮在培养基中,并计数细胞数目。
2. Matrigel涂层a. 在载玻片上滴加2-3滴Matrigel。
b. 使用移液器均匀涂覆整个载玻片表面。
c. 在37摄氏度下孵育30分钟至凝胶化。
3. 细胞接种a. 将预定细胞数目的HUVEC细胞悬浮在培养基中。
b. 将细胞悬浮液加入预先涂有Matrigel的孔板孔中。
c. 将培养皿放置在37摄氏度的细胞培养箱中,孵育24-48小时。
4. 观察和图像获取a. 使用显微镜观察HUVEC细胞在Matrigel上的小管生成。
b. 使用图像采集系统捕获并保存小管生成的图像。
5. 分析小管生成a. 使用图像处理软件对图像进行分析,包括测量小管长度、分支点数目等。
b. 统计和比较不同处理组的小管生成结果。
结果与讨论:通过HUVEC小管生成实验,可以评估细胞的血管生成能力。
实验结果显示,HUVEC细胞在Matrigel上能够形成分支的管状结构,模拟血管形成的过程。
小管长度和分支点数目可以作为评估血管生成能力的指标。
此外,通过比较不同处理组的结果,可以进一步研究各种因素对血管生成的影响。
HUVEC培养过程
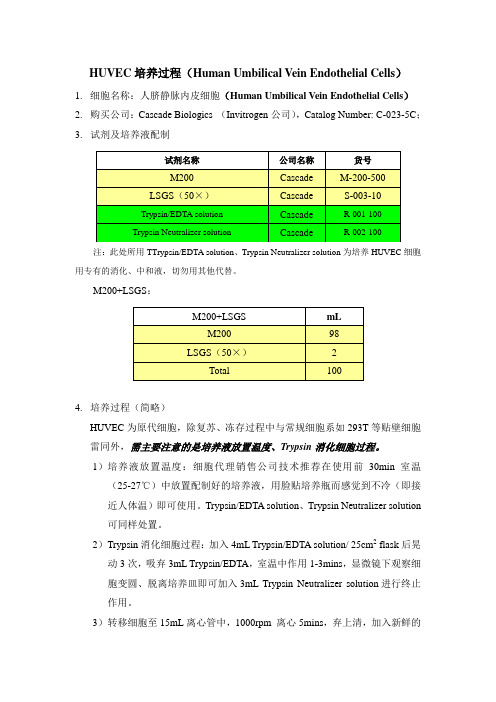
HUVEC培养过程(Human Umbilical V ein Endothelial Cells)1.细胞名称:人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells)2.购买公司:Cascade Biologics (Invitrogen公司),Catalog Number: C-023-5C;3.试剂及培养液配制注:此处所用TTrypsin/EDTA solution、Trypsin Neutralizer solution为培养HUVEC细胞用专有的消化、中和液,切勿用其他代替。
M200+LSGS:4.培养过程(简略)HUVEC为原代细胞,除复苏、冻存过程中与常规细胞系如293T等贴壁细胞雷同外,需主要注意的是培养液放置温度、Trypsin消化细胞过程。
1)培养液放置温度:细胞代理销售公司技术推荐在使用前30min室温(25-27℃)中放置配制好的培养液,用脸贴培养瓶而感觉到不冷(即接近人体温)即可使用。
Trypsin/EDTA solution、Trypsin Neutralizer solution可同样处置。
2)Trypsin消化细胞过程:加入4mL Trypsin/EDTA solution/ 25cm2 flask后晃动3次,吸弃3mL Trypsin/EDTA,室温中作用1-3mins,显微镜下观察细胞变圆、脱离培养皿即可加入3mL Trypsin Neutralizer solution进行终止作用。
3)转移细胞至15mL离心管中,1000rpm 离心5mins,弃上清,加入新鲜的培养液转移至新的培养皿/瓶。
4)复苏、冻存雷同其他细胞操作,细胞复苏、传代后不可多次传代,一次复苏的细胞尽量满足连续性试验需要。
5)可参考Cascade Biologics公司的操作。
人脐静脉内皮细胞分离培养及鉴定技术

2 1 4月 0 0年
第1 4卷
第 4期
一
5l 一 I
文 章 编 号 :07— 272 1)4 5 1 3 10 4 8 (00 0 —0 1 —0
人 脐 静 脉 内皮 细 胞 分 离 培 养 及 鉴 定 技 术
吴金 义 张 , 蕾 , 张秀英 曲丽梅 ,
(. 1吉林大学 中 日联谊 医院 心内科 , 吉林 长 春 10 3 ; . 303 2 一医院 病理科 ) 摘要: 目的 探讨人脐静脉 内皮 细胞 ( V C 体外 分离 原代 培养 的方法 ,  ̄JE ) 并总结对培养 的细胞 鉴定 方法。方法
通过胰酶灌注法从人脐带获取 内皮 细胞 进行分离培养 , 并采用免疫组 化法及 光镜和透射 电镜观察 超微结构 鉴定所获
得 的细胞系 。结果
分离 的 H V C在体外 7 0天左右可长成单层 , UE —1 光镜下 胞体 为单层铺 路石状排列 。第 VI 因子 I I
用胰酶灌 注法是获
相关抗原 的检测 为阳性 。透射 电镜下 观察培养的内皮细胞胞浆内可见 We e—a d 小体 。结论 il le b Pa 得脐静脉 内皮细胞 的有效 方法 。本 方法 为血 管内皮细胞的研究提供 了实验模型 。
( ’ L bD a n 2 1 ,4 0 1 ) C J a / , 0 1 : 1 g 0 5
ce a n te c i p a m u d ree t n—m co c p h c e e ie t e C . n l s n T ed g s o f a c e t e _ l sw s i el l e lcr h s n o i rs o yw ih w r d ni d a E s Co c i h i t n o n rai p d — i f s u o ei p n u s n i a f c v t o o g i C , d ti me o r vd se p r na d lfrV Cl C e e r h i e e t e meh d t an E s a hs t d p o ie x e i t mo e o a la E sr s ac . o sn i n h me l s l r Ke r s h ma a c lr n oh l eli mbl a v i c l c tr ;d n i c t n y wo d : u n v s u a d tei c l n u i c en; e u u e i e t ai e l a il l i f o
ScienCell 原代细胞培养方法

ScienCell原代细胞培养方法2018.06.01原代细胞在复苏和传代前一定要包被培养瓶,以促进细胞贴壁。
以人脐静脉内皮细胞(sciencell,货号#8000)为例:1.培养瓶包被包被液纤维粘连蛋白(sciencell,货号#8248)以1-2ug/cm2的浓度包被培养瓶。
可将1mg/ml的纤维粘连蛋白不含钙镁离子的磷酸盐缓冲液(sciencell,货号#0303)稀释100倍,T-75培养瓶中加入10ml左右,37度孵箱1小时或4度冰箱过夜,并用灭菌双蒸水洗涤培养瓶2遍(此步骤非常重要,必须清洗2遍),包被好的培养瓶不要放置超过24小时。
2.配制培养基以ECM培养基为例把胎牛血清(sciencell,货号#0025)、生长因子(sciencell,货号#1052)和双抗(sciencell,货号#0503)加入培养液中,混匀后的完全培养基于4度保存,应尽快使用。
可分装以延长效期。
3.细胞复苏在培养瓶中加入配制好的ECM培养基10ml(推荐复苏至T75培养瓶,如T25瓶子加5ml)从液氮中取出冻存原代细胞,37度水浴冻融,冻融过程中可以轻轻转动细胞,加快冻融速度(注意原代细胞复苏时一定不要离心),将融化的细胞放入已加入培养基的培养瓶中,再用1ml培养基洗涤细胞冻存管,保证原代细胞都被加入培养瓶中,然后静置于孵箱,12-16小时后更换培养基以除去DMSO。
4.原代细胞传代细胞生长至70-80%左右可以传代,传代比例1:2或1:3为佳。
首先弃去培养基,PBS或D-Hank’s液洗涤培养瓶2遍,加入适量0.25%Trypsin-EDTA,37度孵育,轻拍培养瓶侧面,显微镜下观察原代细胞消化情况。
细胞消化好后,加入适量的胰酶中和液以中和胰酶,然后将原代细胞和培养基转移至离心管中,1000rpm离心5分钟。
然后弃去上清液,以1-2ml培养基重新悬浮原代细胞,加入包被好的已加入培养基的培养瓶中。
根据原代细胞生长情况,大概每2天更换培养基。
